Навигация
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
2 ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Проблема создания биологически активных волокнистых материалов в последние десятилетия вызывает все возрастающий интерес. Широкое развитие исследований по приданию биоцидных свойств именно целлюлозным волокнистым материалам обусловлено тем, что целлюлоза является доступным и распространенным в природе полимерным материалом. Исследования, посвященные синтезу производных целлюлозы, содержащих антимикробные вещества, разработке научных основ получения биоцидных целлюлозных волокнистых материалов с заданными свойствами, методов и технологии их изготовления, а также изучению свойств и наиболее эффективных областей применения указанных материалов имеют большое научное и практическое значение.
Перед исследователями стоит вопрос о том, при каких типах химической связи между антимикробным веществом и макромолекулой целлюлозы проявляется антимикробная активность материала, как влияет строение введенных биоцидных веществ, в том числе и полимеров, на химические и антимикробные свойства модифицированной целлюлозы. Систематическое исследование этой проблемы имеет существенное теоретическое и большое практическое значение, так как только научно обоснованный подход позволит создать высокоактивные антимикробные волокнистые материалы, антимикробные свойства которых будут сохраняться на протяжении всего периода применения изготовленных из них изделий даже при очень жестких условиях эксплуатации и многократных мокрых обработках.
В настоящее время описано большое число биоцидных производных целлюлозы и других волокнообразующих полимеров разного строения. Вопрос о влиянии строения производных целлюлозы, содержащих химически связанные антимикробные вещества, на антибактериальные свойства этих полимеров был изучен в цикле работ, обобщенных в [28-29]. В этих работах были синтезированы производные целлюлозы (в виде волокнистых мате- риалов), содержащие антимикробные вещества акридинового ряда, галоген- производные фенола (ГПФ), галогены или ионы серебра, связанные с различными функциональными группами макромолекулы модифицированной целлюлозы разными типами химических связей (координационными, ионными, лабильными и стабильными ковалентными), и исследована их антимикробная активность.
Анализ приведенных выше литературных данных показывает, что в последние годы синтезировано большое число производных целлюлозы, содержащих разные антимикробные вещества, присоединенные различными типами химических связей. В настоящее время происходит процесс накопления экспериментальных данных о влиянии строения нерастворимых в воде производных целлюлозы, содержащих химически связанные антимикробные вещества, и характера связи между молекулой антимикробного вещества и макромолекулой полимера на антимикробные свойства волокнистого материала. Установлено, что полимеры с прочной ковалентной связью между производным целлюлозы и антимикробным веществом не обладают антибактериальной активностью. Антимикробная активность волокнистых материалов, содержащих антимикробные вещества, присоединенные ионной или координационной связью, обусловлена отделением антимикробного вещества от полимера вследствие гидролиза указанных связей, диффузией антимикробного вещества из полимерного материала и взаимодействием его с микробной клеткой. Аналогичный механизм антимикробного действия может быть принят для производных целлюлозы, содержащих антимикробные вещества, присоединенные лабильной ковалентной связью (альдиминовой, аце- тальной, триацетальной, сложноэфирной).
Проведенные исследования позволили обосновать и сформулировать представления о механизмах антимикробного действия волокнистых материалов, содержащих химически связанные антимикробные вещества: антимикробная активность изученных волокнистых материалов, обусловлена тем, что антимикробное вещество, присоединенное химической связью к функциональной группе модифицированной целлюлозы, постепенно отщепляется от этой группы вследствие гидролиза связи, диффундирует из волокнистого материала и вступает во взаимодействие с микробной клеткой .
Как было показано в литературном обзоре, способность целлюлозы и ее производных образовывать ковалентные, ионные или координационные связи с солями четвертичных аммониевых оснований широко используется для модификации большого числа целлюлозных волокнистых материалов, при этом в конечном продукте часто проявляется синергизм уникальных свойств исходных компонентов. Выбор окисленной целлюлозы хлопковой и аминогуани- динсодержащих цвиттер-ионных делокализованных резонансных структур для получения новых модифицированных моно- и биматричных композиционных материалов открывает перспективу создания наноструктур и нанокомпозитов с трансформерной полимерной матрицей, представляющих существенный научный и практический интерес. Изделия на их основе можно использовать для изготовления одежды, упаковки, перевязочных материалов медицинского назначения, а также фильтрующих мембран для стерилизации воздуха и обеззараживания речной воды, обладающих одновременно пролонгированными биоцид- ными и легко регенирируемыми адсорбционными свойствами, поскольку в состав аминогуанидинсодержащих мономеров и полимеров входят ионогенные группы. Именно назначение будущих изделий в значительной степени определило способы их получения, состав и важнейшие параметры новых биоцидных мономеров, тип связывания в них основного биоцидного компонента, природу супрамолекулярных связей, обуславливающих его иммобилизацию с матрицей в композитах, полученных нами.
Отметим, что все исследования проводились с одной партией исходных и синтезированных веществ.
При создании композиционных материалов, в том числе и нанокомпозитов с полимерной биматрицей, мы руководствовались тем, что каждый из предполагаемых процессов взаимной иммобилизащш можно условно разделить на четыре типа включения основного биоцидного компонента (катиона гуанидиния) в зависимости от природы носителя:
механический, когда за счет пропиточного раствора аминогуанидинметакрилата (АГМ) биоцидный компонент остается на поверхности окисленной целлюлозы (ОЦХ) и может быть использован как «ударная доза», т.к. деиммобилизуется первым;
сорбированный, когда биоцидный компонент связан с носителем за счет ионных, водородных, ван-дер-ваальсовых связей; деиммобилизуется пролонгировано;
химический, когда биоцидный компонент связан ковалентными связями с карбонильными и карбоксильными группами ОЦХ, или в результате привитой полимеризации АГМ (матрица - ОХЦ) в присутствии персульфата аммония.
сорбционно-химический, при полимеризации АГМ in situ.
Ключевым фактором при создании композитов на основе целлюлозы хлопковой и биоцидного компонента явилась предварительная активация исходных компонентов для придания способности к структурной и химической взаимной иммобилизации и дополнительной целенаправленной модификации. С этой целью целлюлоза хлопковая (взятая в виде волокнистого материала и бинта) обрабатывалась 1 М водным раствором перекиси водорода. Как было показано в литературном обзоре, при окислении целлюлозы перекисью водорода происходит неизбирательное окисление, в результате которого возможно образование карбонильных (альдегидных и кетонных) и карбоксильных групп, с разрывом и без разрыва пиранового кольца.
Вторым компонентом, используемым нами для получения биоцидного волокнистого нанокомпозита, явился метакрилат аминогуанидина. Как отмечалась в литературном обзоре, метакриловая кислота и ее производные характеризуются значительной реакционной способностью в реакциях ра- дикальной гомо- и сополимеризации. Ее производные, содержащие виниловый фрагмент и химически активные функциональные группы, представляют собой перспективный ряд мономеров. Соответствующие им полимеры могут сохранять потенциал активности, являясь удобными носителями биологически активных веществ.
Аминогуанидин NH2-NH-C(=NH)-NH2, который входит в метакрила- таминогуанидина, в отличие от гуанидина NH2-C(=NH)-NH2, наряду с амино- и иминогруппой содержит гидразиновую группу. Данный фрагмент в силу своего химического строения расширяет возможности химической модификации и способен дополнительно выполнять ту или иную специфическую функцию, в частности, введение такого фрагмента приводит к усилению биоцидных свойств.
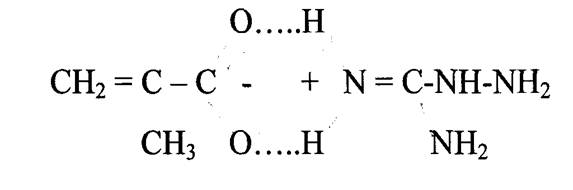
синтезировали по предлагаемой в литературе методике. По этой методике соль гуанидина (сульфат, карбонат, нитрат и др.) помещали в этилат натрия, через 12 часов отфильтровывали выпавшую натриевую соль и затем к раствору аминогуанидина при температуре 0-5 °С прикапывали очищенную от ингибиторов радикальной полимеризации метакриловую кислоту.
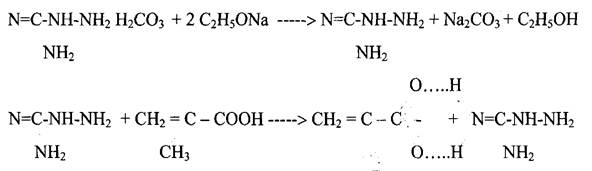
Были были найдены оптимальные условия проведения этой реакции: 2 М раствор одной из солей неорганических кислот аминогуанидина в абсолютном этаноле обрабатывали эквимольным количеством этилата натрия, при этом высаждается натриевая соль неорганической кислоты. К фильтрату, содержащему раствор аминогуанидина в этиловом спирте, при низких температурах приливали эквимольное количество метакриловой кислоты. Полученный продукт реакции высаждали из раствора диэтиловым эфиром. Аминогуанидин метакрилат перекристаллизовывали из смеси воды и этанола. Выход «80 - 85%. Температура плавления аминогуанидинметакрилата - 171 °С
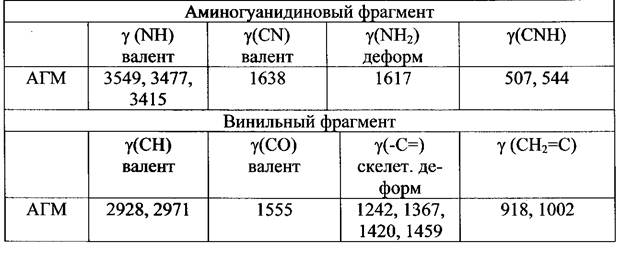
Строение и чистоту полученной соли определяли с помощью элементного анализа
Результаты элементного анализа: аминогуанидинметакрилат - Найдено, %: С =37,26; Н =7,71; N =35,08 . Вычислено для C5H12N402 %: С = 37,50; Н = 7,50; N = 35,00 В ИК-спектре метакрилатаминогуанидина ионизованный координационно-связанный карбоксил проявляется в спектре в виде типичной интенсивной полосы поглощения 1555,19 см"1, характерной для делокализо- ванного цвиттер-иона Остальные характеристические полосы поглощения, наблюдаемые в ИК спектре метакрилат аминогуанидина, приведены в таблице 1. ИК-спектральные данные для аминогуанидинметакрилата (АГМ) (в см"1)
Таблица 1
Биоцидный композит на основе окисленной целлюлозы и метакрилата аминогуанидина получали следующим путем. К суспензии окисленной целлюлозы (ОЦХ) в воде при перемешивании добавляли метакрилатаминогуа- нидин и персульфат аммония, нагревали смесь до 60°С и проводили полимеризацию в течение 4-20 часов. Соотношение ОЦХ : Н20 = 1:6 масс., концентрация АГМ в воде - варьировалась от 10 до 50% (масс), соотношение АГМ : ПСА = 1:0,001 мае. Полученный композит отделяли от маточного раствора, выдерживали 1 час в дистиллированной воде при 60°С, промывали в воде для отделения метакрилатаминогуанидина, не иммобилизованного в ОЦХ, и сушили.
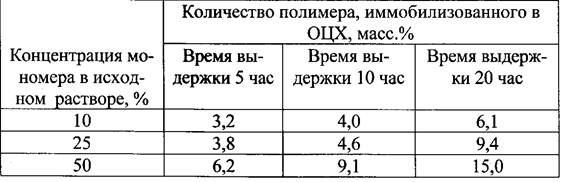
Проведенные исследования показали, что количество аминогуани- динметакриалата, вошедшего в состав композита, зависит от концентрации мономера.
Структуры, образующиеся при взаимодействии окисленной целлюлозы (ОЦХ) с цвиттер-ионными делокализованными парами метакрилат- и поли- метакрилатаминогуанидина представлены в общем виде на схемах а,б,в.
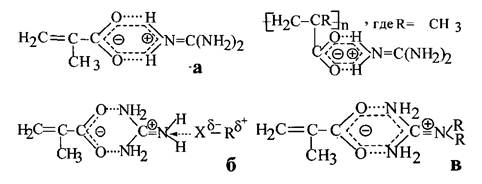
Для мономер/полимерных катионотропных четвертичных иминопроизвод- ных солей метакрилатаминогуанидина можно ожидать первый тип связывания (а) основного биоцидного компонента - катиона аминогуанидиния (C(NH))® (прото- нированная форма исходного гуанидина, который имеет симметрию третьего порядка) с карбоксилат-анионом метакриловой кислоты (исходный носи-тель основного биоцидного компонента, имеющий симметрию второго порядка). Надо отметить, что длина связи C-N в катионе равна 0,132 нм, и он является прекрасным центром связывания с различными структурными фрагментами нук- леофильной природы, т.к. остается протонированным в очень широком диапазоне рН, например,4% водные растворы гуанидингидрохлорида (H2N)2C=NH-HC1 и гуанидингидрокарбоната (H2N)2C=NH-0,5H2CО3 имеют значения рН = 6,4 и 11,2 [4]. Данный тип наиболее вероятен для истинных четвертичных иминопро- изводных солей слабых кислот [5]. Второй тип связыва-ния (б) скорее следует ожидать при наличии нуклеофилов, конкурирующих с карбоксилат-анионами (исходными носителями основного биоцидного компо-нента) при стабилизации четвертичных аммониевых катионов гуанидиния, но не образующих истинные цвитгер-ионные резонансные структуры. В нашем случае нуклеофильной составляющей -X в таких мономер/полимерных цвиттер- ион-ных делокализо- ванных резонансных структурах может выступить атом кислорода карбоксиль- ной(-СООН) или гидроксильной (-ОН) групп активированной целлюлозы химической. При этом указанные связи относительно легко могут разрушаться и восстанавливаться (иногда образуя другие структуры) как под действием различных природных факторов, так и в результате направленного целевого воздействия (изменение рН среды, температуры, природы растворителя, а также за счет взаимодействия с конкурирующими обменными катионами или мембранной поверхностью бактериальной клетки) [6]. Третий тип связывания (в) возможен за счет образования альдиминовых связей C=N (азот- углеродных ковалентных связей) при реакции конденсации метакрилатгуа- нидина с активированной целлюлозой. Не исключается также возможность образования углерод - углеродных связей за счет радикальной привитой сопо- лимеризации активированной целлюлозы с виниловой составляющей метак- рилатаминогуанидина. [7]. В этих случаях получаются достаточно устойчивые модифицированные продукты.
Возможность образования лабильных связей в ходе иммобилизации за счет взаимодействия альдегидных или гидроксильных групп активированной целлюлозы с мономер/полимерными цвиттер-ионными парами метак- рилатгуанидина была доказана ИК-спектроскопией, элементным и рентгено- дифракционным анализами опытных образцов целлюлозы хлопковой в виде волокнистого материала и бинта (ЦХ), окисленной целлюлозы (ОЦХ), композитов целлюлоза хлопковая + метакрилатаминогуанидин (ЦХ+АГМ), окисленная целлюлоза + метакрилатаминогуанидин (ОЦХ+АГМ), целлюлоза хлопковая + по- лиметакрилатаминогуанидин (ЦХ+ПАГМ), окисленная целлюлоза + полиме- такрилатаминогуанидин (ОЦХ+ ПАГМ). Косвенным подтверждением иммобилизации явилось наличие биоцидных свойств у исследованных образцов.
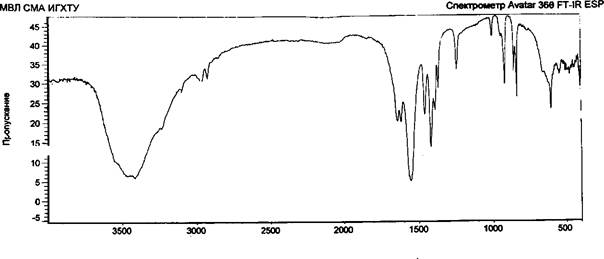
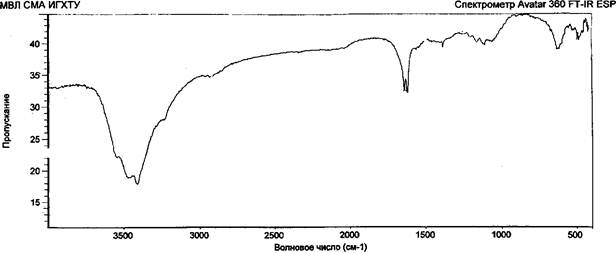
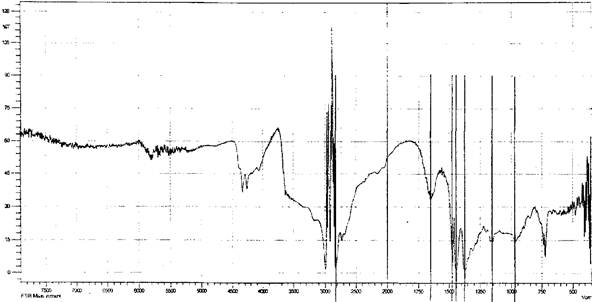
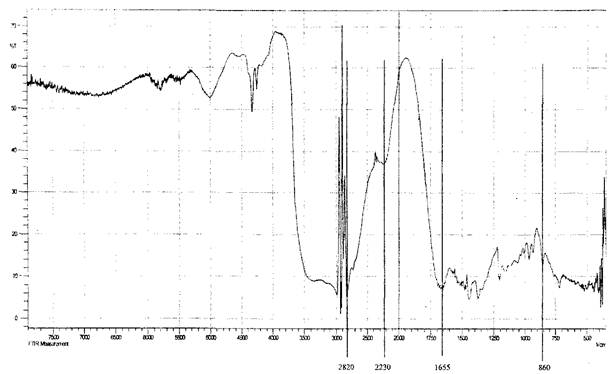
Обработка ОЦХ водным раствором АГМ (механическая смесь) приводит к увеличению степени кристалличности образцов, что связано, видимо, с рекристаллизацией ОЦХ.
Антимикробную активность ОЦХ/АГМ изучали в условиях Нальчикской городской ветеринарной лечебницы. Перед использованием препарата рану предварительно механически очищали без использования антимикробных препаратов, а затем покрывали салфетками из ОЦХ/АГМ и перевязывали стерильными бинтами. При необходимости в раны вставляли турунды из исследуемого композита и ставили провизорные швы.
Бактерицидная эффективность модифицированной целлюлозы оценивалась по динамике воспалительного процесса и характеру заживления раневого дефекта. При оценке течения раневого процесса учитывался внешний вид раны, наличие отделяемого, гиперемии, отека и инфильтрации окружающих тканей, сроки формирования грануляций, очищения раны от некротических тканей, эпителизации раневой поверхности и заживления ран. Наблюдение проводилось ежедневно с учетом гистологических изменений в ранах. Через 3 суток от начала лечения отмечено, что при применении ОЦХ/АГМ степень выраженности воспалительных процессов была снижена. Так, язвенный дефект кожи с гнойно-некротическими изменениями в дне сохранялся в течение первых 2 суток, к 5-м суткам происходило практически полное очищение раны от гнойно-некротического детрита и формирование соединительно-тканного рубца.
Таким образом, гистологические исследования свидетельствуют о том, что использование нанокомпозита ОЦХ/АГМ при лечении гнойных ран приводит к скорейшему купированию гнойного воспаления и ускоряет заживление инфицированных дефектов кожных покровов. Бактериологическими исследованиями установлено, что ОЦХ/АГМ эффективна против протея вульгарного (Proteus vulgaris), синегнойной палочки (Ps. aureginosa) и золотистого стафилококка (Staph. Aureus).
0 комментариев