Навигация
1.2.2 Ферментативне окиснення
Окиснювальні процеси не починаються у готовому пиві, вони вже відбуваються при виробництві солоду та сусла. Ячмінь містить складну ферментативну систему. Активність цих ферментів сильно зростає при пророщуванні зерна. У цей час відбувається часткове розщеплення ліпідів під дією ліпаз. Дія ліпаз спрямована на складноефірну групу між гліцерином та високомолекулярними жирними кислотами. Утворені вільні карбонові кислоти здатні окиснюватися набагато легше, ніж їхні ефіри. Ферментом, що зумовлює окиснення ліпідів, є ліпоксигеназа. Під дією цього ферменту у присутності кисню повітря ненасичені жирні кислоти (олеїнова, лінолева, ліноленова) перетворюються у гідропероксиди, які здатні розпадатися на різних стадіях виробництва пива з утворенням карбонілів[2,4]. Так, під дією ліпоксигенази утворюється такий діальдегід, як нонадінал, що відповідає за появу “огіркового” запаху солоду. Оптимальна умова дії ліпоксигенази рН=6,0 та температура 28 – 300С. Під час виготовлення сусла ліпоксигеназа активується і при значній кількості кисню відбувається активне утворення продуктів окиснення жирних кислот.
На стадії бродіння дріжджі відновлюють утворені карбоніли та гідроперекиси у відповідні спирти, які є безпечними для смаку напою. При розпаді гідроксикислот після бродіння утворені карбонільні речовини залишаються у пиві та погіршують його смак. Окрім ферментативних процесів окиснення з безпосередньою участю ферментів можна виділити процеси, де ініціаторами є метали змінної валентності (Fe), а ферменти виконують допоміжну роль. Як вже було описано у неферментативних процесах, залізо ініціює ланцюги окиснення за вищенаведеною схемою.
У випадку наявності у системі ферментів, де коферментом є НАДФН2, іони заліза відновлюються ланцюгом переносу електронів за наступною схемою [16,17]:
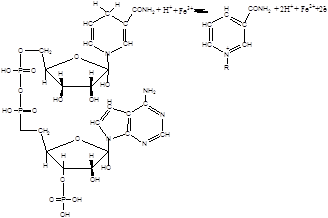
2. Експериментальна частина
2.1 Газоволюмометричний метод
Одним із простих і розповсюджених методів вивчення кінетики рідиннофазних реакцій окиснення органічних речовин є метод вимірювання кількості поглиненого кисню. Газоволюмометричний (ГВ) метод дозволяє вимірювати швидкість окиснення з великим ступенем точності при малих глибинах перетворення, коли впливом продуктів окиснення на кінетику реакції можна знехтувати.
Існують різні варіанти газоволюмометричних установок. Загальний принцип їхньої дії полягає у вимірюванні швидкості поглинання кисню при постійному тиску. Визначення кінетичних параметрів процесу інгібованого окиснення: період індукції, швидкість реакції з пероксильними радикалами, та ряд інших кінетичних характеристик проводили на установці для автоматичної реєстрації та запису поглинання кисню "Кулон-1" з фотоелектронним датчиком заводу Інституту хімічної фізики РАН (рис.2.1).
Установка складається з реакційної судини (1), зануреної у термостатовану комірку (2), термостатованої газової бюретки (3), електролітичної комірки з платиновими електродами (електроліт - насичений розчин щавлевої кислоти) (4), регулятора тиску (5), заповненого ундеканом і манометра (6), фотоелектроннного датчика (8), підсилювача датчика (9), стабілізатора струму (10). Перед початком досліду бюретка, регулятор тиску і реакційна судина з речовиною, що окиснюється, заповнюються до атмосферного тиску киснем. Для проведення окиснення реакційна судина нагрівається до певної температури за допомогою термостата при безперервному перемішуванні, після двоххвилинного прогріву з'єднується з бюреткою і регулятором тиску. Фотоелектронний датчик через стабілізатор струму з'єднаний з електролітичною коміркою. Під час реакції кисень з бюретки надходить у реакційну судину, при цьому тиск у системі падає, і у зв'язку з цим вмикається електролітична комірка. Газ, що виділився з комірки, підвищує тиск у термостатованому об'ємі і піднімає рівень ундекану в бюретці, в результаті чого тиск у системі вирівнюється. Швидкість просування меніска ундекана в бюретці пропорційна швидкості реакції.
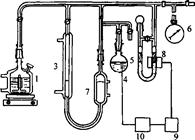
Рис. 2.1 Схема газоволюмометричної установки: 1 - реакційна судина; 2- термостат; 3 - газова бюретка; 4 - електролітична комірка; 5 - регулятор тиску; 6 - манометр; 7 - термостатований об'єм; 8 – фотоелектронний датчик; 9 - підсилювач датчика; 10 - стабілізатор струму.
Сила струму на електролізері складала 0.2 А. Установка дозволяє вимірювати швидкість поглинання кисню від 10-7-10-8 моль∙л-1∙с-1 і більше. Об'єм реакційної суміші дорівнює 5 мл, частота перемішування – 50-60 с-1. Вимірювання проводили в кінетичній області при тиску кисню 1 атм і температурі 313К та 343К.
2.2 Хемілюмінесцентний метод
Одним з методів вивчення кінетики хімічних реакцій може бути вимірювання хемілюмінесценції, тобто світіння, яке супроводжує хімічні процеси. Хемілюмінесценція (ХЛ) виникає в екзотермічних елементарних актах реакцій, тому її характеристики закономірно пов’язані з характеристиками реакцій. Детальне вивчення закономірностей хемілюмінесценції в реакціях, які йдуть за участю вільних радикалів, показало, що світіння виникає в елементарних актах рекомбінації вільних радикалів за схемою:
|
RO2• + RO2• → [ROOOOR] → R=O* + O2 → R=O + hυ
Як видно, світіння виникає при квадратичній рекомбінації пероксирадикалів і його інтенсивність (І) пропорційна швидкості цього процесу:
I = ŋ6k6[RO2•]2,
де ŋ6 – квантовий вихід світіння, тобто ймовірність перетворення енергії, що виділилася у результаті рекомбінації радикалів, в енергію кванта світла.
На рис 2.2 приведена схема приладу для вивчення реакцій рідиннофазного окиснення за хемілюмінесценцією. Прилад складається з реакційного сосуду 1, який знаходиться у світлонепроникній камері 2 і до якого під’єднана система продувки газу 3, охолодження 4 та термостатування 5, фотопомножувача ФЕУ-29, що захищений кожухом 7, підсилювача постійного струму (У1-7) 8, високовольтного випрямлювача стабілізатора (ІМТ-05) 9 та автоматичного електронного потенціометра (ЛКС4-003) 10. Світіння, яке виникає у процесі окиснення, через світлофільтр 11 спрямовується на зовнішній торець світлопроводу 12, а далі потрапляє на фотопомножувач, де світловий сигнал перетворюється у постійний струм, який через виносний каскад електрометричного помножувача потрапляє в електрометричний підсилювач 8 та реєструється за допомогою автоматичного потенціометра 10. Більш детально прилад описується в роботі [18].

Рис. 2.2 Схема хемілюмінесцентної установки: 1-реакційний сосуд; 2-світлонепроникна камера; 3-продувка газа у реакційний сосуд; 4-зворотній холодильник; 5-вводи термостату; 6-фотопомножувач; 7-кожух фотопомножувача; 8-підсилювач постійного струму; 9-високовольтний стабілізатор; 10-електронний потенціометр; 11-світлофільтр; 12-світлопровід; 13-виносний каскад електрометричного підсилювача.
Похожие работы
... живлення, дихання, ріст і розвиток, розмноження, реакції на зовнішні подразники, пластичність, інтенсивність взаємодії з факторами середовища. Фізіологія являється науковою основою промислового використання мікроорганізмів у мікробіологічних виробництвах біологічно активних речовин (БАР), ферментів, вітамінів, антибіотиків, амінокислот, органічних кислот. Мікроорганізми здатні до синтезу ...
0 комментариев