Навигация
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
13. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
13.1. Методика проведения эксперимента
Эксперименты по дегидратации метанола с получением диметилового эфира проводили при атмосферном давлении на лабораторной установке, схема которой представлена на рисунке 4.
Перед началом экспериментов в кварцевый реактор (3), помещенный в каталитическую печь (6), через вентиль тонкой регулировки (13), моностат (14) и реометр (11) подавался аргон, расход которого, необходимый для нахождения количества газа, образовавшегося за время опыта, определяли по пенному расходомеру (15). Разогрев катализатора до 150-180°С проводили в токе аргона, дальнейший нагрев до реакционной температуры осуществляли в токе испаренного сырья.
Контроль температуры обогрева реактора осуществляется с помощью терморегулятора ТРМ1 (9) и реле РЭР-10М (12), с точностью + ГС. Контроль температуры в слое катализатора (5) осуществляется потенциометром ПП-63А (8) по хромель-копелевой термопаре.
При достижении температуры 150-180°С в верхнюю часть реактора (3), заполненную кварцевой насадкой (4), начинали подавать метанол из бюретки (1) с помощью перистальтического микродозатора (ДЛВ) (2). Жидкие продукты реакции на выходе из реактора охлаждались в водяном холодильнике-конденсаторе (10).
Сконденсировавшиеся продукты реакции и не прореагировавший метанол собирались в приемнике холодильника-конденсатора. Остальная часть жидких и газообразные продукты реакции проходили через низкотемпературную ловушку, охлаждаемую смесью льда и NaCl (до Т = -22°С). В ловушке конденсировались и собирались, в зависимости от используемого катализатора диметиловый эфир, метанол, метилформиат и вода, а газообразные продукты направлялись на продувку кранов-дозаторов хроматографов. Сброс газа осуществлялся в вытяжную вентиляцию.
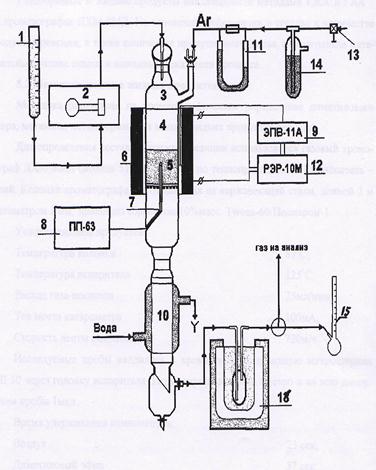
Рис.4 Схема лабораторной установки
I бюретка; 2 микродозатор; 3 кварцевый реактор; 4 кварцевая насадка; 5 слой катализатора 6 электрообогрев реактора; 7 термопара 8 потенциометр ПП-63; 9 регулятор температуры ЭПВ-11 А; 10 холодильник-конденсатор; 11 реометр; 12 электрическое реле РЭР ЮМ; 13 вентиль тонкой регулировки; 14 моностат; 15 пенный расходомер; 16 низкотемпературная ловушка.
Газообразные и жидкие продукты анализировали методами ГЖХ и ГАХ на хроматографах ЛХМ-8МД. На основании информации о составе и количестве продуктов реакции, а также количестве пропущенного сырья, рассчитывали материальный баланс опыта, и выходные показатели процесса.
13.2. Методика анализа жидких продуктов
Методика рассчитана на хроматографическое определение диметилового эфира, метанола, метилформиата и воды в жидких продуктах реакции.
Для определения состава продуктов реакции использовался газовый хроматограф ЛХМ-8МД (модель 5) с детектором по теплопроводности. Газноситель -гелий. Колонка хроматографа, изготовленная из нержавеющей стали, длиной 2 м и диаметром 2 мм, заполнена сорбентом 10%масс. Tween-60/ПолихроМ".
Условия анализа продуктов:
Температура колонки 85°С;
Температура испарителя 125°С;
Расход газа-носителя 25мл/мин;
Ток моста катарометра 100мА;
Скорость ленты самописца 720м/ч.
Исследуемые пробы вводились в хроматограф с помощью микрошприца МШ 10 через головку испарителя. Иглу шприца вводили быстро и на всю длину. Объем пробы 1мкл.
Время удерживания компонентов:
Воздух 23 сек;
Диметиловый эфир 37 сек;
Метилформиат
Метанол 2 мин. 13 сек;
Вода 4мин.51 сек.
Для количественного определения состава жидких продуктов реакции использовался метод абсолютной калибровки с учетом поправочных коэффициентов.
Поправочный коэффициент определяли как тангенс угла наклона прямой, построенной в координатах: Si/SCT=F(Gi/GCT), где Si, Sct - площади пиков определяемого вещества и стандарта; Gi,Gct - их весовые соотношения. За стандарт принимался метанол. Поправочные коэффициенты:
Диметиловый эфир 1,2
Метанол 1
Вода 1,21
Для определения содержания компонентов рассчитывались площади соответствующих пиков по формуле:
Si=hi*bi*Mi (1)
где: hi - высота пика, мм;
bi - ширина пика на середине высоты;
Mi - масштаб записи пика.
Процентное содержание каждого компонента вычислялось по формуле:
Ci=(Si*Ki*100)/ (2)
где: Si - площадь пика компонента, мм ;
Ki - поправочный коэффициент для данного компонента.
13.3. Методика анализа газообразных продуктов
Анализ газообразных продуктов реакции, содержащих Н2, СО, СО2, CH4, ДМЭ и смесь углеводородов С2 - С4, проводили на хроматографах ЛХМ-8МД с использованием катарометров, четырех насадочных колонок и печи конверсии углеводородов. Анализируемым газом последовательно продували петли кранов-дозаторов и далее пробу газа вводили на анализ в колонки А и Г. По завершении анализа на этих колонках газ подавался на колонки Б и В.
Условия анализа ДМЭ (колонка А):
Колонка из нержавеющей стали, L=1,5м, D=2мм.
Адсорбент Порапак PQS;
Газ-носитель Не ;
Температура испарителя 125°С;
Расход газа-носителя 30 мл/мин
Ток моста 120 мА.
Условия анализа углеводородов (колонка Б):
Колонка из нержавеющей стали, L=6м, D=2мм.
Колонка из нержавеющей стали, L=l ,5м, D=2мм.
Адсорбент А12О3;
Газ-носитель Аг;
Температура колонки 75°С
Расход газа-носителя 30 мл/мин
Ток моста 65 мА;
Температура печи конверсии углеводородов 900°С.
Условия анализа Аr, СО (колонка В):
Колонка из нержавеющей стали, L=4м, D=2мм.
Адсорбент молекулярные сита, 5А;
Газ-носитель Не ;
Температура колонки 75°С
Температура испарителя 125°С;
Расход газа-носителя 30 мл/мин
Ток моста 120мА.
Условия анализа Н2, CH4, CO2 (колонка Г):
Колонка из нержавеющей стали, L=2м, D=2мм.
Адсорбент уголь СКТ;
Газ-носитель Аr;
Температура колонки 75°С
Расход газа-носителя 30 мл/мин
Ток моста 65 мА.
Калибровочные коэффициенты определялись по площадям пиков, полученных при заколе чистых веществ на соответствующие колонки, в соответствии с уравнениями:
КДМЭ =SAr2 / SДМЭ
KH2=SH2/ SHе
KCO=SCO/SAr1
KCO2=SCO2/SAr2
KCH4=SCH4/SAr1
где SHе, SAr1 , SAr2 - площади пиков чистых аргона и гелия, полученных соответственно с колонок Г, В и А. Калибровочные коэффициенты проверяются каждые два месяца, площади пиков берутся как среднее значение из трех вводов. Значения калибровочных коэффициентов представлены ниже:
КДМЭ = 0,68
KH2= 1,64
KCO= 0,75
KCO2= 2,58
KCH4= 0,5
Ежедневно хроматографы калибровались по аргону и гелию.
Концентрации газообразных продуктов реакции (%об.) определялись по формулам:
CДМЭ=SДМЭ*KДМЭ*MДМЭ*100/(S Ar2*M Ar2) (3)
СН2=SH2*MH2*100/(KH2*SHe*MHe) (4)
CCO=SCO*MCO*100/(KCO*SAr1*MAr1) (5) CCO2=SCO2*MCO2*100/(KCO2*SAr2*MAr2) (6) CCH4=SCH4*MCH4*100/(KCH4*SAr1*MAr1) (7)
где: Sдмэ= SH2, Sco, SCO2, SCH4 - площади пиков компонентов газообразных продуктов реакции,
М - масштаб записи пика,
К - калибровочные коэффициенты.
Концентрации углеводородной смеси рассчитывались по формуле:
Ci=Si*Ki*100/(Si*Ki) (9)
где: Si- площади пиков компонентов углеводородной смеси,
Ki- количество молекул водорода в углеводороде.
Далее концентрация водорода в смеси углеводородов приравнивалась к СH2, полученной из уравнения (10) и соответственно пересчитывались концентрации всех углеводородов по пропорции:
CУ.В. (1) =CH2* CУ.В. / CH2 У.В. (10)
где: CУ.В. (1) - концентрация углеводорода, приведенная к одинаковой концентрации водорода в составах газа, полученных по результатам разных анализов.
Полученные концентрации углеводородной и не углеводородной газовых смесей приводились к одному составу по уравнению:
C i =C ri * 100 / ( ( Cr+( CУ.В. (1)- -( CH2 У.В. + CCH4 У.В.)) (11)
где: C ri - концентрация i-того компонента углеводородной или не углеводородной газовых смесей,
Сг - концентрации не углеводородной газовой смеси,
CH2 У.В. , CCH4 У.В концентрации водорода и метана в углеводородной газовой смеси.
Количество газа, полученное за время опыта, определялось исходя из известного количества аргона, подаваемого в реактор, и его концентрации в смеси газообразных продуктов реакции по уравнению:
Vr = (VAr/CAr)*100-VAr(12)
0 комментариев