Навигация
Получение хлора при электролизе хлорида алюминия
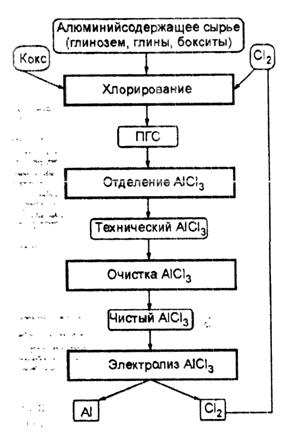
1. Электролиз хлорида алюминия
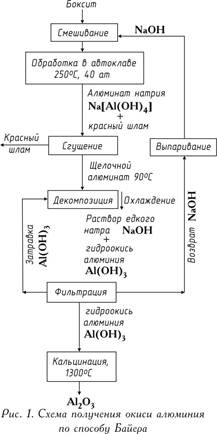
Комбинирование двух способов позволяет не только перерабатывать боксит с высоким содержанием кремния, но и заменить едкий натр более дешевым карбонатом натрия. Комбинированный способ применяют также для одновременной переработки низко- и высококремнистого боксита, а также с целью исключения процесса каустификации соды, которую можно использовать при спекании.
Основной целью переработки нефелинов является отделение Al2O3 от кремнекислоты и щелочи. При переработке нефелинов получают обычно три продукта: глинозем, поташ (или соду) и известково-кремниевые шламы, используемые для производства портланд-цемента. Переработка нефелинов аналогична переработке боксита методом спекания. Предложены и гидрохимические способы переработки нефелинов.
Переработка алунитов осуществляется восстановительно-щелочным способом в печах кипящего слоя. Принципиальной особенностью этого способа является обезвоживание и восстановительный обжиг алунитов. При этом в раствор переходят алюминат натрия и сульфаты щелочных металлов: раствор выпаривают, и сульфаты щелочных металлов выпадают в осадок. Раствор алюмината натрия далее перерабатывают по способу Байера.
Получение криолита
Процесс получения синтетического криолита состоит из стадий термической обработки плавикового шпата серной кислотой в цилиндрических вращающихся печах при 350°С, улавливания печных газов водой, очистки растворов от кремнекислоты и выделения криолита.
Основные реакции процессов:
CaF2 + H2SO4 → 2HF + CaSO4 (15.з)
SiO2 + 6HF →H2SiF6 + 2H2O
HF и H2SiF6 — газообразные продукты, улавливаемые водой. Для обескремнивания полученного раствора в него вначале вводят расчетное количество соды:
H2SiF6 + Na2CO3 → Na2SiF6 + CO2 + H2O (15.и)
Труднорастворимый Na2SiF6 отделяют, а оставшийся раствор плавиковой кислоты нейтрализуют избытком соды и гидроксидом алюминия с получением криолита:
12HF + 3Na2CO3 + 2Al(OH)3 → 2(3NaF·AlF3) + 3CO2 + 9H2O (15.к)
Таким же путем могут быть раздельно получены NaF и AlF3, если обескремненный раствор плавиковой кислоты нейтрализовать рассчитанным количеством Na2CO3 или Al(OH)3.
Электроды и другие материалы
С помощью электродов электрический ток подводят к шихте или электролиту. Поэтому электрод должен отличаться хорошей электропроводимостью и химической стойкостью при повышенной температуре, а также высокой чистотой. В большинстве случаев, в частности и при получении алюминия, электрод может и сам участвовать в электрохимических и химических процессах.
Различают два типа угольных электродов: прессованные обожженные и самообжигающиеся.
Для их изготовления мелкие угольные зерна смешивают с углеродистым связующим (пеком). Полученную пластичную массу прессуют и подвергают длительному обжигу без доступа воздуха при 1300 — 1400°С. Прессование электродов под высоким давлением ведут в формах нужных размеров. Прессованные необожженные электроды называют "зелеными" электродами. При обжиге происходит коксование связующего и отдельные зерна твердого углеродистого материала соединяются в общую массу.
Графитовые электроды получают путем дополнительной термической обработки обожженных угольных электродов при высокой температуре. Самообжигающиеся электроды коксуют непосредственно в самом электролизере за счет тепла, выделяющегося при прохождении тока через сырую углеродистую массу, набиваемую в металлический кожух электрода. При этом из массы удаляются летучие вещества.
Обожженные прессованные блоки применяют в качестве анодов, как при получении электролитического алюминия, так и в процессе его рафинирования.
Электролиз криолит-глиноземного расплава
В соответствии с современными данными о структуре расплавленных солей можно считать, что криолит-глиноземные расплавы являются однородными, упорядоченными в ближнем порядке системами из ионов Na+, Al3+, F-, O2-. Процесс разложения глинозема при электролизе с инертными по отношению к кислороду анодами (например, из платины) может быть в общем виде представлен реакцией
2Al2O3 → 4Al + 3O2 (15.л)
На практике электролиз криолит-глиноземного расплава проводят на анодах из углеродистых материалов, поэтому конечными анодными продуктами являются не кислород, а СО и СО2.
Суммарная реакция разложения глинозема в промышленных электролизерах может быть представлена в виде:
2Al2O3 + 3C → 4Al + 3CO2 (15.м)
Al2O3 + 3C → 2Al + 3 CO
Значения э.д.с. этих реакций, рассчитанные по термодинамическим данным, равны 1,167 и 1.034 В. Экспериментально найденное значение э.д.с. в алюминиевых электролизерах при плотности тока 10 кА/м2 (1 А/см2) лежит в пределах 1,4 — 1,8 В. Различие между фактической и расчетной э.д.с. отдельные авторы объясняют хемосорбцией кислорода на угольных электродах, который сохраняется и после отключения тока.
В криолит-глиноземном расплаве возможно существование различных катионов и анионов, причем каждый из таких ионов может принимать участие в электрохимических или промежуточных химических процессах, протекающих в электролизере.
Выход по току при электролизе криолит-глиноземного расплава не достигает 100% и составляет 85 — 90%. Это объясняется возможностью обратного растворения катодного металла в электролите и образованием соединений одновалентного алюминия, так называемых субсоединений:
2Al + Na3AlF6 → 3AlF + 3NaF
Одновалентный алюминий вновь легко окисляется на аноде, что снижает долю тока, расходуемого на обычные анодные процессы.
Другими побочными реакциями могут быть разряд ионов Na+ на катоде и дальнейшее его взаимодействие с электролитом с образованием субфторидов натрия (Na2F).
Необходимая температура электролита — от 940 до 960°С. При этой температуре электролит как бы "перегрет" на 10 — 30°С по отношению к температуре начала кристаллизации
Межэлектродное расстояние в процессе электролиза криолит-глиноземного расплава — весьма важный параметр. Оно определяет не только температуру расплава, но и напряжение на ванне при постоянных силе тока и составе электролита. Для поддержания напряжения 4,2 — 4,5 В межэлектродное расстояние должно быть в пределах 4 — 5 см.
Состав электролита
Глинозем и криолит являются основными составляющими электролита при производстве алюминия электролизом. Многочисленные попытки заменить криолит другими расплавленными средами не привели к положительным результатам. Преимущества криолита заключаются в хорошей растворимости в нем глинозема и отсутствии элементов с более положительным потенциалом, чем алюминий, которые, разряжаясь на катоде могли бы загрязнять металл. Криолит-глиноземные расплавы характеризуются достаточной электропроводимостью, сравнительно небольшим давлением насыщенного пара. Плотность электролита меньше плотности расплавленного алюминия, что позволяет применять в качестве катода алюминий, располагаемый под слоем электролита.
Все физико-химические свойства электролита существенно зависят от содержания Al2O3, которое изменяется в процессе электролиза. По мере уменьшения содержания Al2O3 растут температура начала кристаллизации, плотность и электропроводность электролита, уменьшается его вязкость.
Конструкция и эксплуатация электролизеров
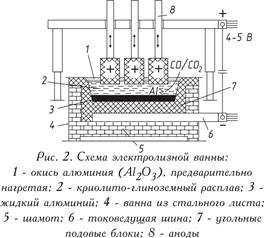
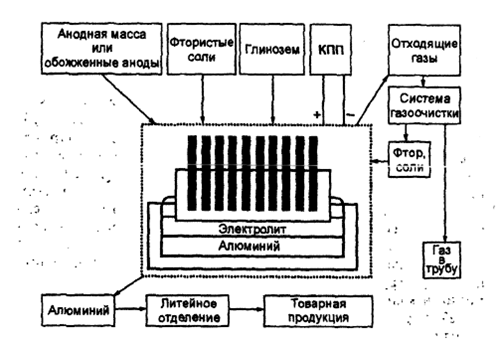
Современный электролизер состоит из пяти основных частей: корпуса ванны, катода, анода, катодного токоподвода и анодного токоподвода
Корпус ванны изготавливают из стальных листов, футеруют угольными блоками 4 и плитами 6.
В работающей ванне образуется корка застывшего электролита — гарниссаж 5, которая предохраняет футеровку от разрушения расплавленным электролитом.
Катодом служит расплавленный алюминий, который расположен на дне электролизера в виде слоя высотой 0,1 — 0,2 м. Подвод тока к расплавленному алюминию через угольные блоки 4 осуществляется с помощью стержней 3. Введенные в блоки стальные стержни для улучшения контакта заливают чугуном или утрамбовывают углеродистой массой.
В качестве анодов в электролизерах применяются угольные блоки 4. Многоанодные электролизеры на большинстве заводов теперь заменены одноэлектродными, что значительно упростило регулирование работы электролизеров.
Аноды подвешивают на железную раму 12 с помощью стальных штырей 16, которые одновременно служат для подвода тока. На углах анодной рамы закреплены тяги, соединенный с подъемным механизмом. С помощью подъемного механизма анод по мере его сгорания можно опускать вниз.
В современных электролизных цехах ванны расположены в два или четыре ряда. В связи с применением электролизеров большой мощности предлагают располагать ванны в один ряд в двухэтажном здании. Число последовательно соединенных в серии алюминиевых ванн может достигать 160.
С увеличением мощности агрегатов снижаются удельные капитальные вложения, повышается производительность труда, но с увеличением токовой нагрузки возрастает и отрицательное влияние электромагнитных и гидродинамических сил. С повышением мощности ванн удельные капитальные затраты и себестоимость алюминия достигают минимальных значений в интервале 150 — 175 кА при ширине анода в 3 м.
В настоящее время свыше 80% цеховых затрат приходится на долю сырья, основных материалов и электроэнергии.
Рафинирование алюминия
Извлекаемый из электролизных ванн алюминий часто не является конечным продуктом, его называют алюминием-сырцом или черновым алюминием. Он содержит в виде примесей газы (Н2), глинозем, карбид и нитрид алюминия, углерод и некоторые металлы (кремний, железо, медь). В зависимости от чистоты исходных материалов содержание примесей в алюминии составляет 0,15 — 0,50%. Примеси ухудшают механические свойства алюминия и его коррозионную стойкость, а также снижают его электропроводимость.
Для очистки от включений натрия и других щелочных и щелочноземельных металлов жидкий алюминий может подвергаться хлорированию.
На современных заводах повышение чистоты первичного алюминия достигают посредством продувки газами, вакуумированием, обработкой флюсами. Известно комбинированное рафинирование, в котором совмещена продувка газом, вакуумирование и восстановление. Вакуумирование алюминия в миксере непосредственно перед разливкой считается наиболее надежным способом удаления водорода.
Предусмотрен выпуск алюминия различных марок. В процессе электролиза получают алюминий технической чистоты 99,5 — 99,85%. Металл высокой чистоты (99,95 — 99,995% Al) получают путем электролитического рафинирования технического металла, а металл особой чистоты (не менее 99,999% Al) — в результате специальной очистки.
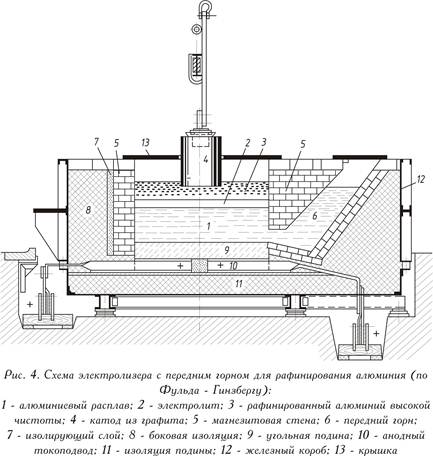
Процесс промышленного электролитического рафинирования осуществляется в электролизере, особенностью которого является наличие в нем трех жидких слоев. Нижний слой служит анодом. Он состоит из рафинируемого алюминия, в который с целью его утяжеления добавляют 30 — 40 масс. % меди. При анодной поляризации медь в этих условиях не растворяется. Плотность анодного сплава должна быть выше 3,0·103 кг/м3.
Средний слой является расплавленным электролитом (смесь фторидов и хлоридов бария, натрия, алюминия, кальция, магния) с плотностью 2,7·103 кг/м3. Один из возможных составов электролита (в масс. %): 60 BaCl2, 23AlF3, 12 — 17 NaF, до 4% NaCl. Температура плавления такого электролита 720 — 730°С.
Третий, верхний, слой представляет собой расплавленный рафинированный алюминий (плотность 2,35·103 кг/м3), который служит катодом.
В процессе электролиза такие примеси в рафинируемом металле, как Cu, Fe, Si, Zn, Ti, остаются в анодном сплаве, Na, Ca, Mg переходят в электролит.
Выход алюминия по току при рафинировании в промышленных условиях (плотность тока 4,5 — 7,5 кА/м2 (0,45 — 0,75 А/см2)) составляет 95 — 98%.
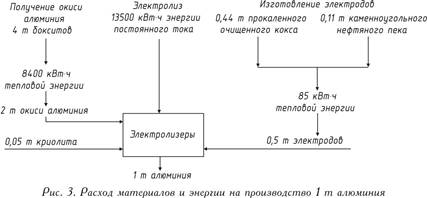
Срок работы электролизера для рафинирования алюминия 4 — 5 лет. Современные промышленные ванны для получения рафинированного алюминия рассчитаны на силу тока 25 — 70 кА. Удельный расход электроэнергии постоянного тока 17370 — 19830 кВт·ч/т. Расход материалов на получение 1 т рафинированного алюминия составляет (в кг): алюминий сырец 1020 — 1030, графит 12 — 17, медь 10 — 16, хлорид бария 27 — 41, криолит 16 — 23, фторид алюминия 4 — 13.
Электролитическое рафинирование алюминия является одним из наиболее энергоемких процессов в металлургии легких металлов, причем 93 — 95% используемой энергии расходуется на поддержание теплового режима электролизера.
Важными задачами являются снижение удельного расхода электроэнергии и изыскание новых футеровочных материалов взамен магнезита, обеспечивающих повышение срока службы электролизеров и уменьшение перехода примесей в алюминий.
Для производства полупроводниковых материалов требуется алюминий чистотой 99,9999 — 99, 999990% Al, что не достигается при электролитическом рафинировании. Глубокую очистку алюминия осуществляют с помощью зонной плавки или дистилляции через субфторид. Очистка путем зонной плавки основана на различной растворимости примесей в твердом и жидком алюминии. При затвердевании кристаллы алюминия содержат меньше примесей, чем жидкая фаза.
Метод дистилляции алюминия основан на взаимодействии алюминия с AlF3 при высокой температуре (1000 — 1050 °С) с образованием летучего монофторида. Парообразный AlF, попадая затем в "холодную" зону (700 — 800 °С), распадается.
Для получения металла чистотой 99,999% иногда используют процесс электролитического рафинирования в органических средах. Для обеспечения чистоты 99,9999% проводят дополнительную зонную перекристаллизацию. Первый процесс протекает в электролите, содержащем AlF3·2Al(C2H5)3 и толуол (1:1), при 100°С. Катодная плотность тока 30 А/м2 и напряжение на ваннах 1,0 — 1,5 В, межэлектродное расстояние 3 см, выход по току близок к 100%.
Электролиз хлорида алюминия
Классический способ получения алюминия электролизом криолит-глиноземных расплавов имеет ряд недостатков, главными из которых являются высокий расход электроэнергии и углеродистых материалов и вредные выделения фторидов. Наиболее перспективным процессом, конкурирующим с классическим способом, может быть электролиз хлорида алюминия.
Технологическая схема предусматривает восстановительную электроплавку алюминий содержащего сырья с получением сплава состава (в %): Al — 50, Fe — 30, Si — 10, Ti — 5, C — 5. Далее путем хлорирования сплава при 13000С хлоридом алюминия получают AlCl, из которого диспропорционированием при 700°С выделяют AlCl3 и металлический алюминий.
Похожие работы
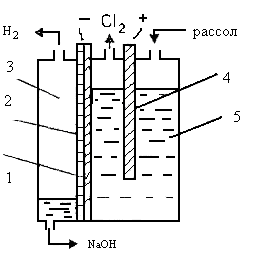
... и щелочи служат, главным образом, растворы поваренной соли, получаемые растворением твердой соли, или же природные рассолы. Растворы поваренной соли независимо от пути их получения содержат примеси солей кальция и магния и до того, как они передаются в цеха электролиза, подвергаются очистке от этих солей. Очистка необходима потому, что в процессе электролиза могут образовываться плохо растворимые ...
... 11,9 11,5 16,6 медь 9,8 15,5 16,4 Выпуск алюминия высокой чистоты, % марок: А995 47,8** 3,5 2,1 А99 30,4 67,1 54,2 А97 8,3 21,5 43,7 А95 10,4 7,9 — ниже А95 3,1 — — * Показатели производства алюминия высокой чистоты. ** Сортность по электролизерам без расшихтовки. Основным фактором, снижающим выход по току, помимо прямых потерь тока ...
... , обусловлено значительными трудностями по технической реализации этого сложного многоэтапного процесса. 3.4. Электролиз хлоридных расплавов В январе 1973 г. фирма "Alcoa" заявила о разработке нового способа получения алюминия. Фирма работала над процессом 15 лет и затратила 23 млн. долларов. Данный способ предусматривает получение хлорида алюминия и последующий его электролиз. В 1976 г. ...
... а в анодное—ионы SO42- . Таким образом, раствор во всех его частях будет оставаться электронейтральным. Однако в катодном пространстве будет накапливаться щелочь, а в анодном—кислота. Схема электролиза раствора сульфата калия: 2K2SO4 Катод ← 4K+ 2SO42- → Анод 4K+ 2SO42- 4Н2О + 4е- =4ОН- + 4Н 2Н2О=4Н+ + 2О + 4e- KОН ...




0 комментариев