Навигация
Исследование и разработка безотходной технологии утилизации алюминийфторуглеродсеросодержащих отходов алюминиевого производства
3. Исследование и разработка безотходной технологии утилизации алюминийфторуглеродсеросодержащих отходов алюминиевого производства
При производстве алюминия электролизом растворенного глинозёма в расплаве фтористых солей при температуре =960°С происходит хроническое образование высокотоксичных алюминийфторуглеродсеросодержащих отходов — отработанной угольной футеровки электролизёров и тонкодисперсного шлама с содержанием углерода 25-70%, фтора 6-16%, алюминия 4-10%, натрия 6-19%, серы 0,1-1,3%, цианидов до 1% и других компонентов [1. 2.].
Наибольшую опасность в твердых отходах представляют водорастворимые фториды, например, NaF и цианиды.
Известно несколько разработанных способов утилизации рассматриваемых отходов. Однако до промышленной реализации доведены лишь некоторые из них, по которым не полностью утилизируется отработанная футеровка из-за низкой эффективности или по экономическим соображениям [1-5]. Алюминийфторуглеродсеросодержащие шламы в настоящее время не перерабатываются и в значительных количествах хранятся на полигонах, загрязняя окружающую среду. По самым скромным оценкам, в мире накопилось несколько десятков миллионов тонн таких отходов, которые можно отнести к техногеннымм видам металлургического сырья.
Рассматриваемые отходы содержат в своем составе ценные компоненты, при переработке которых можно получить существенный экономический и экологический эффект.
Для эффективной утилизации отходов необходимо исследовать и разработать безотходную технологию, наносящую минимальный экологический ущерб окружающей среде, имеющую низкие капитальные затраты на ее реализацию и позволяющую получать прибыль. Этому посвящена данная работа.
В исследованиях в качестве отходов использовали алюминийфторуглеродсеросодержащий шлам Красноярского алюминиевого завода (ОАО "РУСАЛ Красноярск"), отобранный со шламового поля с влажностью 30% и высушенный при температуре 100°С. Шлам представляет собой механическую смесь пыли электрофильтров, шлама "мокрой" ступени газоочистки, хвостов флотации угольной пены и содержит, % масс. 8,15А1; 0,15 Si; 0,97 Fe; 0,01 Ti; 0,76 Са; 0,27 Mg; 6,46 Na; 1,06 К; 7,085 R (R = Na+K в пересчете на Na); 1,25 S; 10,31 F; 51,6 C; 58,11 п.п.п. (потери при прокаливании). По крупности шлам имеет частицы размером менее 0,05 мм 74,19% и более 0,2 мм 4,37%. Для разработки технологии переработки алюминийфторуглеродсеросодержащих отходов алюминиевого производства и их обезвреживания представляет интерес исследовать поведение при нагреве содержащихся в них фторидов в смеси с СаС03 и Na2C03 и углерода, предполагая, что при этом углерод будет сгорать в воздухе, а фториды прореагируют по следующим химическим реакциям:
2NaF + СаСОз = CaF2 + Na2C03; (1)
2Na3AlF6 + бСаСОз = Na20-Al203 + 6CaF2 + 2Na2C03 + 4C02T; (2)
2A1F3 + 3CaC03 = 3CaF2 + A1203 + 3C02;(3)
2A1F3 + 4Na2C03 = Na20-Al203 + 6NaF + 4C02; (4)
CaF2 + Na2C03 = 2NaF + CaO + C02T; (5)
CaF2 + Na2C03 = 2NaF + CaC03. (6)
С этой целью были приготовлены согласно стехиометрическим коэффициентам в вышеприведенных реакциях следующие смеси веществ марки ч.д.а. крупностью менее 0,08 мм:
2NaF + СаСОз (1), 2Na3AlF6 + 6СаС03 (2), 2A1F3 + ЗСаСО3 (3),
2A1F3 + 4Na2C03 (4), CaF2 + Na2C03 (5).
Указанные смеси и используемый в исследованиях алюминийфтроруглеродсеросодержащий шлам проанализированы дифференциально-термическим (ДТА) и термогравиметрическим (TG) методами.
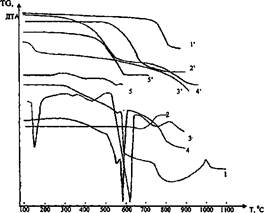
Рис. 1. Термогравиметрический анализ смесей фторидов с известняком и содой.
1, 1' - смесь NaF + СаС03; 2, 2' - смесь A1F3 + СаС03; 3, 3' - смесь Na2C03 + CaF2;
4, 4' - смесь Na3AlF6 + CaC03; 5, 5' - смесь A1F3 + Na2C03.
1, 2, 3, 4, 5 - кривые ДТА; Г, 2', 3', 4', 5' - кривые TG
Проведенные исследования подтвердили предположение, что фториды разлагаются известняком и содой при температуре 600-650°С по вышеприведенным реакциям (1-6).
По кривым 1, Г видно, что реакция 1 начинается при температуре 420°С, но идет очень медленно. С повышением температуры скорость ее увеличивается, достигая максимума при 530-590°С, и при 600°С она практически заканчивается полным переходом растворимого в воде NaF в нерастворимый CaF2, о чем свидетельствует большой эндотермический эффект на кривой ДТА. При нагревании смеси 2NaF + СаС03 до температуры 620°С практически не наблюдается убыль веса (кривая Г). Это указывает на то, что протекает обменная химическая реакция взаимодействия NaF и СаС03 с образованием CaF2 и Na2C03. Однако при температуре более 620°С образовавшиеся CaF2 и Na2C03, по-видимому, взаимодействуют между собой с образованием снова NaF по реакциям 5 и 6, о чем свидетельствует изменение угла наклона кривой ДТА (кривая 1). Причем до температуры 750°С преимущественно протекает реакция 6, так как на кривой TG (1') отмечается небольшая убыль веса, а при температуре более 750°С в основном идет реакция 6 с образованием, кроме NaF, СаО и улетающего в атмосферу углекислого газа, что резко увеличивает убыль веса (кривая Г).
Реакция 2 между криолитом и известняком начинается при температуре 320°С и заканчивается при температуре 620°С с полным переходом алюминия в алюминат натрия. Образовавшиеся при этом CaF2 и Na2C03 реагируют также между собой при температуре более 620°С по реакциям 5 и 6 (кривые 2 и 2'). Реакция 3 между фторидом алюминия и известняком начинается при температуре 540°С, идет активно и при 710-730°С заканчивается полностью (кривые 3 и 3').
Фторид алюминия начинает реагировать с содой по реакции 4 при температуре 490°С, а с известняком — по реакции 3 при температуре 540°С, и заканчивается реакция 4 при температуре 590-600°С, что видно из кривых ДТА и TG (кривые 4 и 4'). Поэтому следует ожидать, что сода, образовавшаяся по реакциям 1, 2 прореагирует с A1F3 с образованием алюмината натрия, а не оксида алюминия по реакции 3.
На кривой ДТА шлама (кривая 6) в области температур 350-915 °С наблюдается большой экзотермический эффект с максимумом при 620"С, относящийся, по-видимому, к горению углеродистой массы, которому соответствует убыль массы образца (кривая 6'). Видно, что углерод в шламе горит в широком температурном интервале, что свидетельствует о присутствии в шламе различных его модификаций. Нами установлено, что теплотворная способность углеродистого шлама составляет 12544,8-14635,6 кДж/кг (3000-3500 ккал/кг).
Предварительно расчетом было установлено, что молярные отношения в шламе R:A1 = R2O: AI2O3 = 1,02 ед., т.е. для образования алюмината натрия (Na2O.Al2O3) в спеке вводить дополнительно щелочь в шихту для спекания не следует. Поэтому исследования проводили по спеканию шлама только с известняком.
В отходах алюминиевого производства содержатся, как было отмечено выше, от 0,1 до 1,3% серы в виде, главным образом, растворимых сульфатов щелочных металлов (Na2S04 и K2SO4), которые при спекании не взаимодействуют с глинозёмом и не образуют алюмината, т.е. являются инертными по отношению к глинозёму [6]. Поэтому важно при спекании серу перевести в нерастворимую форму — CaSO4, а сульфаты натрия и калия в активную форму — карбонаты по химическим реакциям:
(Na,K)2S04 + 2С + СаСОз = (Na,K)2C03 + CaS + 2C02; (7)
CaS+ 2O2 = CaS04. (8)
При выщелачивании спека сера уходит в осадок в виде CaS04. Из стехнометрических коэффициентов реакций 7, 8 видно, что для образования в спеке CaS04 и CaS в шихте должно быть молярное отношение Са: S = 1,0. Поэтому в шихтах для спекания шлама нами выдерживалось это отношение.
Образующиеся по реакции 7, 8 карбонаты щелочных металлов взаимодействуют с AIF3 по реакции 4, образуя в спеке легкорастворимые алюминаты — (Na,K)20- AI2O3. Без добавки в шихты известняка для связывания серы в CaS04 щелочь в составе сульфатов не образует алюминатов и снижает извлечение глинозёма из спека (отходов).
Для исследования влияния режимов спекания и состава шихты на качество получаемого спека нами были рассчитаны и приготовлены шихты, состоящие из алюминийфторуглерод-серусодержащего шлама ОАО "РУСАЛ Красноярск" и известняка марки ч.д.а. с различными молярными отношениями Ca:F2(oт 0,86 ед. до 1,10 ед.) и постоянными Ca:S = 1,0 ед., R:A1 = 1,02 ед. Характеристика шихт приведена в табл. 1.
Методика опытов заключалась в следующем. Предварительно высушенные при температуре 100°С и измельченные до крупности -0,08 мм материалы шихты тщательно перемешивали и спекали, при температурах 550-800"С. Приготовленные шихты помещали на огнеупорных пластинках слоем 1,0-1,5 см. Подъем температуры до заданной осуществляли со скоростью 15-20°С/мин., затем следовала выдержка в течение 1 часа. Спеки охлаждали вместе с печью до 200°С, а далее до комнатной температуры на воздухе. Затем спеки измельчали до крупности -0,08 мм и выщелачивали по стандартной методике содощелочным раствором, содержащим 5,7 г/дм3 Na2Oк (каустической) и 8,4 г/дм3 Na2Oу (углекислой), при отношении жидкого к твердому 20, температуре 70 °С в течение 7 мин.
Таблица 1 Характеристика исследуемых шихт из алюминийфторуглеродсеросодержащих отходов и известняка
| Номер шихты | Мол. отн. Са: F2, ед | Содержание, % (в пересчете на оксиды) | |||
| А1203 | R20 | СаО | ппп | ||
| 1 | 0,86 | 12,29 | 7,62 | 12,13 | 55,27 |
| 2 | 0,90 | 12,10 | 7,51 | 12,81 | 55,09 |
| 3 | 1,04 | 11,82 | 7,33 | 13,83 | 54,83 |
| 4 | 1,10 | 11,55 | 7,16 | 14,79 | 54,56 |
Таблица 2 Показатели спекания шихт при различных температурах
| Номер шихты по табл. 1 | Мол. отн. в шихте Ca:F2, ед. | Температура спекания, °С | Извлечение в р-р при выщелачивании спека, % | Содержание в спеке (в пересчете на оксиды) % | |||
| А1203 | R20 | А1203 | R20 | CaO | |||
| 1 | 0,86 | 650 | 68,72 | 97,85 | 27,06 | 16,90 | 26,90 |
| 2 | 0,90 | 650 | 74,04 | 97,12 | 26,11 j | 16,58 | 28,28 |
| 3 | 1,04 | 550 | 71,58 | 96,62 | 25,11 | 15,80 | 29,81 |
| 3 | 1,04 | 600 | 77,40 | 97,91 | 25,89 | 16,06 | 30,30 |
| 3 | 1,04 | 650 | 80,67 | 97,32 | 25,89 | 16,06 | 30,30 |
| 3 | 1,04 | 750 | 77,26 | 97,65 | 25,89 | 16,06 | 30,30 |
| 3 | 1,04 | 800 | 74,18 | 96,92 | 26,01 | 16,06 | 30,44 |
| 4 | 1,10 | 650 | 75,23 | 97,38 | 24,78 | 15,36 | 31,74 |
Показатели спекания исследуемых шихт приведены в табл. 2, из которой видно, что оптимальными режимами для спекания являются температура 600-650°С и молярные отношения в шихте Ca:F2 = 1,04; Ca:S = 1,0; R:A1 = 1,02. При этих режимах достигается максимальное извлечение глинозёма и щелочей из спека в раствор, равное соответственно 77,40-80,67% и 97,30-97,90%.
Снижение температуры спекания менее 600°С нецелесообразно, так как приводит к неполному выгоранию углерода из отходов, неполному протеканию вышеуказанных химических реакций, результатом которых является образование в спеке легкорастворимых алюминатов щелочных металлов и нерастворимого фторида кальция (CaF2). Все это ухудшает качество спека, снижает эффективность переработки и обезвреживания экологически опасных алюми-нийфторуглеродсеросодержащих отходов алюминиевого производства.
Увеличение температуры спекания более 650°С также нежелательно, так как при этом развиваются вторичные реакции 5, 6, приводящие к переходу в спеке нерастворимого CaF2 в растворимый NaF и, за счет этого, к уменьшению извлечения глинозёма из спеков, снижению эффективности переработки отходов и образованию водорастворимого фтора.
При уменьшении молярного отношения в шихте Ca:F2 ниже 1,04 ед. для полного разложения фторидов по реакциям 1-4, образования алюминатов щелочных металлов и связывания фтора в нерастворимый CaF2 при спекании известняка недостаточно. Это обуславливает снижение качества спека и эффективности переработки отходов, ухудшение экологии.
Увеличение молярного отношения Ca:F2 более 1,04 приводит к повышению удельных расходных коэффициентов на 1 тонну перерабатываемых отходов (по известняку, шихте, спеку) без улучшения качества получаемого спека и снижению эффективности переработки отходов.
Следует отметить, что спекание алюминийфторуглеродсеросодержащих отходов с известняком при температуре 600-650°С позволяет извлечь алюминий, присутствующий в отходах в составе криолита (Na3AJFg) или AIF3, но не позволяет извлечь металлический алюминий и оксид алюминия из отходов, так как для их полного извлечения необходима температура спекания более 1150°С [6]. Учитывая, что количество последних в отходах незначительно, то этими потерями можно пренебречь.
Кроме того, при выщелачивании спеков из алюминийфторуглеродсеросодержащих отходов алюминиевого производства получаются флюоритовые шламы, содержащие, % масс: 9-1 А1203, 54-55 СаО; 31-32 F; 0,5-0,6 R20; 0,5-0,6 Si02; 3-4 Fe203; 0,5-0,6 MgO; 0,2-0,3 SO3; 6-8 п.п.п., пригодные для производства фтористых солей, т.е. являющиеся товарным продуктом, которые можно реализовать в качестве флюоритового сырья на предприятия по производству фтористых солей.
Результаты проведенных исследований позволили предложить способ переработки техногенного алюминийсодержащего сырья, включающий приготовление шихты из алюминийф-торуглеродсеросодержащих отходов алюминиевого производства и известняка с молярными отношениями Ca:F2 = 0,8-1,2, Ca:S = 1,0 , спекание при температуре 550-800°С и выщелачивание полученного спека, на который получено положительное решение о выдаче патента.
Этот способ позволяет эффективно переработать и утилизировать до настоящего времени широко не используемых экологически опасных алюминийфторуглеродсеросодержащих отходов алюминиевого производства. При этом упрощается аппаратурно-технологическая схема спекания, снижается температура спекания, повышается качество спека за счет увеличения его пористости и связывания алюминия в нем в легкорастворимые алюминаты щелочных металлов, практически устраняется расход топлива на спекание за счет сгорания углерода отходов (топливо необходимо лишь при розжиге печи), эффективно обезвреживаются отходы алюминиевого производства, а именно детоксифицируются цианиды и связываются растворимый фтор в нерастворимый фторид кальция.
Результаты проведенных исследований с учетом промышленной практики позволили разработать безотходную технологию переработки и утилизации алюминийфторуглерод-серосодержащих отходов алюминиевого производства с получением следующих товарных продуктов: гидроксида алюминия или глинозёма, содопродуктов и флюоритового шлама, пригодного для производства фтористых солей [7]
Литература
1. Экологические аспекты производства алюминия электролизом Аналитический обзор / А.Г. Акшиц, П.В. Поляков, А.В. Кучеренко, В.А. Крюковский, Л.А. Сафарова. — Новосибирск: Изд. ГПНТБ СО АН СССР, 1991. - 92 с.
2. Истомин С.П. Проблемы использования фторсодержащих отходов криолитовых и алюминиевых заводов // Цветные металлы, 2002. — №1. — с. 63-67.
3. Петров С.И., Утков В.А., Тесля В.Г. Переработка углеродфторсодержащих отходов производства алюминия // Материалы межвузовской конференции "Металлургия легких металлов на рубеже веков. Состояние и стратегия развития". — Санкт-Петербург, 2001. — с. 100.
4. Переработка и повторное использование отработанной подины: Практика использования в Китае // Light Metals, 1994. - с. 269-273.
5. Современные способы переработки, обезвреживания и утилизации отработанной футеровки алюминиевых электролизёров. НТЦ "Сибирский алюминий". — Санкт-Петербург, 1999. - 21 с.
6. Лайнер А.И., Еремин Pi.И., Лайнер Ю.А., Певзнер И.З. Производства глинозёма. - М.: Металлургия, 1978. — 344 с.
7. Беляев А.И. Металлургия легких металлов. — М.: Металлургия, 1970
Похожие работы
... и щелочи служат, главным образом, растворы поваренной соли, получаемые растворением твердой соли, или же природные рассолы. Растворы поваренной соли независимо от пути их получения содержат примеси солей кальция и магния и до того, как они передаются в цеха электролиза, подвергаются очистке от этих солей. Очистка необходима потому, что в процессе электролиза могут образовываться плохо растворимые ...
... 11,9 11,5 16,6 медь 9,8 15,5 16,4 Выпуск алюминия высокой чистоты, % марок: А995 47,8** 3,5 2,1 А99 30,4 67,1 54,2 А97 8,3 21,5 43,7 А95 10,4 7,9 — ниже А95 3,1 — — * Показатели производства алюминия высокой чистоты. ** Сортность по электролизерам без расшихтовки. Основным фактором, снижающим выход по току, помимо прямых потерь тока ...
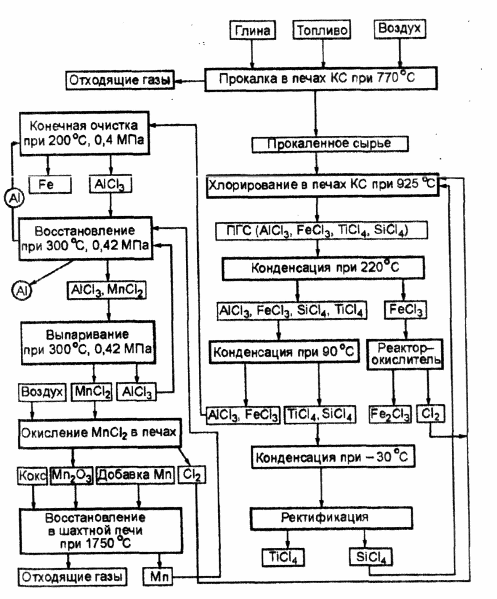
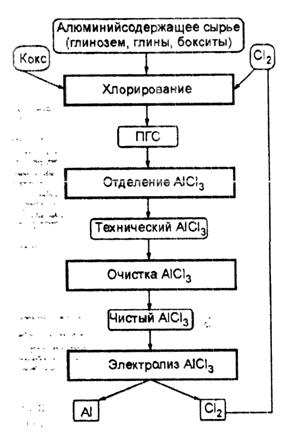
... , обусловлено значительными трудностями по технической реализации этого сложного многоэтапного процесса. 3.4. Электролиз хлоридных расплавов В январе 1973 г. фирма "Alcoa" заявила о разработке нового способа получения алюминия. Фирма работала над процессом 15 лет и затратила 23 млн. долларов. Данный способ предусматривает получение хлорида алюминия и последующий его электролиз. В 1976 г. ...
... а в анодное—ионы SO42- . Таким образом, раствор во всех его частях будет оставаться электронейтральным. Однако в катодном пространстве будет накапливаться щелочь, а в анодном—кислота. Схема электролиза раствора сульфата калия: 2K2SO4 Катод ← 4K+ 2SO42- → Анод 4K+ 2SO42- 4Н2О + 4е- =4ОН- + 4Н 2Н2О=4Н+ + 2О + 4e- KОН ...




0 комментариев