Навигация
Лабораторные способы получения оснований
3.1 Лабораторные способы получения оснований.
В лабораторних условиях основания получают в небольших количествах, не более чем сто – двести грамм. Иногда больше, в зависимости от потребности конкретной лаборатории в веществе. Но эти количества незначительны. В больших количествах основания в химико-технологических лабораториях могут добывать лишь в тех случаях, когда отрабатывают методику получения этого вещества для промышленности.
Рассмотрим основные способы получения гидроокисей в лаборатории.
В лаборатории для получения гидроокисей щелочных металлов применяют два способа. Первый и наиболее дорогой, это прямое взаимодействие щелочных металлов с водой, в результате которого получаются щелочи. Этот метод можно использовать для получения NaOH, KOH, LiOH, Ca(OH)2 .
![]()
![]()
![]()
Эти реакции достаточно опасны из–за использования активных металлов: натрия, калия, лития. Нельзя использовать в этих реакциях большие количества щелочных металлов, они могут вспыхнуть и даже взорваться.
В лабораторных условиях нашли свое применение и упрощенные промышленные способы получения гидроксида натрия. Почему именно гидроксида натрия ? потому что он наиболее широко используется из всех гидроксидов в химии и промышленности. Для его получения используют электролизный метод. Схема проточной электролизной установки наведена на рисунке 2.
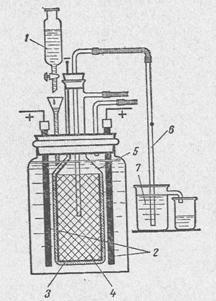 1 – делительная воронка с раствором поваренной соли;
1 – делительная воронка с раствором поваренной соли;
2 – аноды из графита;
3 – диафрагма из асбестового картона;
4 – катод в виде цилиндра с дном из железной или стальной сетки;
5 – стеклянный колокол;
6 – сифон для вытеснения раствора из катодного пространства;
7 – стакан для приема щелочи.
Рис. 2.
Концы графитовых анодов, выступающие над раствором, необходимо предварительно пропитать расплавленным парафином, чтобы электролит не поднимался по капиллярам и не разрушал контакт с медью. Контакт медного провода с графитовым анодом осуществляют с помощью медного колпачка, плотно одетого на анод, или тугой намоткой зачищенного медного провода на конец электрода. Катодом служит железная или стальная сетка. Она должна своей верхней частью плотно входить в стеклянный колокол так, чтобы водород не попадал в анодное пространство. Асбест, предварительно смоченный водой, с добавкой очень небольшого количества силикатного клея наносят в виде кашицы на наружную сторону железной сетки (толщина слоя 5 – 10мм). После того как асбест высохнет, его можно слегка прокалить для того, чтобы диафрагма оставалась прочной и в электролите. Необходимая скорость подачи и перетекания электролита достигается с помощью делительной воронки с краном, как показано на рисунке 1.
Хлор и водород можно использовать для получения синтетической соляной кислоты. С этой целью их подают в горелку, представляющую собой стеклянный тройник, заполненный силикагелем.
Вытекающий из электролизера раствор выпаривают в фарфоровой чашке. Время от времени сливая с осадка поваренной соли жидкую часть, к концу выпаривания температуру доводят до 500° С. Затем расплав щелочи охлаждают, дробят и хранят в закрытой стеклянной посуде. Совершенно чистую щелочь получают охлаждением 35-процентного раствора технического едкого натра до 5° С. При этом выпадают кристаллы NaОН × 2Н2О и NaOH × 4Н2О, которые отделяют от раствора и прокаливают.
С помощью этой же установки можно получать и гидроксид калия и гидроксид лития. При получении щелочей на данной установке нужно соблюдать особые меры осторожности, ведь одним из продуктов электролиза будет хлор.
Для получения гидроокиси натрия иногда еще применяют более старый метод - кипячение раствора соды с гашеной известью:
![]()
По окончании реакции раствор сливают с осадка карбоната кальция и, выпарив воду, сплавляют полученный гидроксид натрия.
Довольно часто для проведения химических реакций в лабораториях нужно получать нерастворимые в воде гидроксиды, такие как гидроксиды меди, цинка, кобальта, кадмия, никеля. Для их получения применяют реакцию взаимодействия растворимых солей этих металлов с гидроксидом натрия. По характеру взаимодействия эта реакция относится к реакциям обмена.
![]()
![]()
Гидроксид меди ( синего цвета ) и гидроксид никеля (зелено – синего цвета) выпадут в осадок. После фильтрования раствора и промывания осадка, его можно использовать в химических процессах. Таким образом, получают гидроксиды меди ( ІІ ), цинка, кобальта, кадмия, ртути (ІІ ), олова, свинца, марганца, титана, хрома и многих других металлов.
Похожие работы
... в Нидерландах, куда обе страны сбывали шерсть, и где англичане помогали гёзам, которые восстали против испанского ига. В этих условиях при тогдашнем быстром развитии в Англии буржуазных отношений Новый Свет — тыл Испании, богатейшая сокровищница и широчайший рынок — стал мишенью и приманкой для английских искателей приключений, для оборотистых английских купцов и джентльменов. Пиратство в водах ...
... дерева. Нет смысла искусственно раздувать противоречия между эко- и биоцентризмом. Гораздо целесообразнее говорить о том, что их объединяет, что у них общего, что может послужить основанием для общей платформы экологической этики. Это – следующие важные моменты: 1) все, и индивиды, и виды живых существ, и экосистемы обладают собственным благом, правами, своей внутренней ценностью, ибо ценны ...
... , на свои 1,5% населения. Поэтому я от вопроса о том, что такое сильное и что такое слабое гражданское общество, органически перехожу к четвертому вопросу в моем распорядке – про гражданское общество и экономический рост. Тот же, уже упоминавшийся мною, автор теории коллективных действий Мансур Олсон задал очень интересный вопрос – про нашу страну, между прочим. Лицом к лицу лица не увидать. Нам ...
... изучения геологии и почвоведения, то приходится принять, что задачей геоморфологии является изучение только геометрических, но не вещественных свойств земной поверхности. В математической формулировке это означает, что объектом изучения геоморфологии следует считать не саму границу множества L, а ее отображение в пространство P, т.е. поверхность в трехмерном евклидовом пространстве, прообразом ...
0 комментариев