Навигация
2.2.2.3 Ход анализа
Навеску 1 г растертого в агатовой ступке металла (или 0,2 – 0,5 г при содержании мышьяка выше 0,0005%) помещают в стакан емкостью 100 мл, добавляют 5 мл азотной кислоты (пл. 1,4), накрывают стеклом и нагревают на плитке, осторожно покачивая стакан, избегая бурного кипения и излишнего испарения кислоты. Нагревают до превращения металла в белую массу. Охлаждают, снимают стекло, дают улетучиться окислам азота, насыпают 6 г тартрата аммония (при навеске 0,5 г сурьмы достаточно 5 г тартрата), приливают воды до 80 мл и нагревают при помешивании до растворения сурьмяной кислоты. Раствор переливают в стакан емкостью 300 мл и разбавляют водой до 150 мл. Охлаждают, добавляют 10 мл раствора однозамещенного фосфата калия, 10 мл магнезиальной смеси и при помешивании – раствор аммиака до слабого запаха и начала образования осадка. Затем приливают еще 10 мл раствора аммиака, перемешивают и оставляют на 7 – 12 ч. Осадок отфильтровывают через бумажный фильтр (7 см) и 15 – 16 раз промывают малыми порциями 1%-ного раствора аммиака. Осадок на фильтре и стенках стакана растворяют в горячей серной кислоте, разбавленной (1: 10), собирая раствор в колбу прибора для отгонки хлорида мышьяка(III) (рис.2.2), прибавляют 0,3 г сернокислого гидразина (если необходимо, берут больше) и 10 мл концентрированной хлористоводородной кислоты.
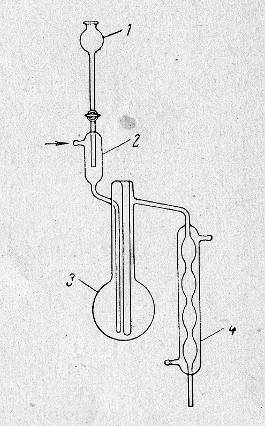
Рисунок 2.2 Прибор для отгонки хлорида мышьяка(III): 1 – капельная воронка; 2 – предохранительная склянка; 3 – реакционная колба; 4 – холодильник.
В маленький стакан наливают 10 мл холодной воды и погружают в него конец холодильника. Раствор в колбе медленно нагревают до 107 °С [7]. Собирают 100 – 110 мл отгона и определяют мышьяк с помощью спектрофотометра КФК-3.
2.3 Анализ полученных результатов
Расшифровка результатов предварительных испытаний и качественного анализа:
Таблица 1 Предварительное испытание вещества нагреванием в тугоплавкой пробирке
| Видимые изменения | Причини | Возможный состав |
| Вещество частично улетучивается. При этом есть возгон белого цвета | NH4Г HgCl2, HgBr2 As2O3, As2O5 | Галогениды аммония Соединения ртути Окислы мышьяка |
Таблица 2 Предварительное испытание вещества с перлом буры
| Цвет перла | Элементы, вызывающие окраску при перлах из Na2B4O7 | |||
| в окислительном пламени | в восстановительном пламени | |||
| в горячем состоянии | в холодном состоянии | в горячем состоянии | в холодном состоянии | |
| Бесцветный | Pb, Bi, Sb, Cd | Pb, Bi, Sb, Cd, Fe | Mn, Cu | Mn, Cu |
| Серый | Ag, Pb, Bi, Sb, Cd, Zn, Ni | Ag, Pb, Bi, Sb, Cd, Zn, Ni | ||
Таблица 3 Предварительное испытание вещества действием кислоты
| Кислота | Видимые изменения | Причини | Возможный состав |
| 3 М H2SO4 на холоду Последующее кипячение с 3 М H2SO4 | Выделяется газ с запахом тухлых яиц | H2S | Сульфиды |
| Отличий не зафиксировано | |||
| Последующее кипячение с 18 М H2SO4 | Выделяется бесцветный газ: с резким запахом, дымит на воздухе | HCl | Хлориди |
Таблиця 4 Перевод вещества в раствор
| № опыта | Растворитель | Видимые изменения растворения | |
| на холоду | при нагревании | ||
| 1 | H2O | – | – |
| 2 | 3 М HCl | – | – |
| 3 | 12 М HCl | – | частично (остался белый с желтым оттенком осадок) |
| 4 | 3 М HNO3 | – | – |
| 5 | 15 М HNO3 | – | частично (остался белый с желтым оттенком осадок) |
| 6 | 3 HCl: 1 HNO3 | – | частично (остался белый с желтым оттенком осадок) |
Белый с желтым оттенком осадок может быть:
некоторые соли серебра – AgCl, AgBr, AgI;
некоторые сульфаты – BaSO4, PbSO4, CaSO4.
Таблица 5 Отчетная карточка для катионов1-2 групп
| № | Объект | Реактив | Результат | Вывод | Возможный состав | |
| Осадка | Раствора | |||||
| 1 | pF0 | индикатор | окрашенный | рН5 | – | – |
| 2 | pР0+ pF0 | 3 моль/л HCl, 3 моль/л H2SO4 | Р белый | Есть 1-2 группа | AgCl, PbSO4, BaSO4, SrSO4 | H+, HSO4-, Ca(II) |
| 3 | P2 | 15 моль/л NH3 | Р остался | PbSO4, BaSO4, SrSO4, CaSO4 | Ag(NH3)+, Сl- | |
| 4 | F3 | 3 моль/л HNO3, | Р | Есть Ag+ | AgCl | NH4+, NO3- |
| 5 | Р3 | 6 моль/л NaOH | Р остался | BaSO4, SrSO4, CaSO4 | Pb(OH)3-, SO42-, Na+ | |
| 6 | F5 | HAc | – | рН45 | – | Pb2+, SO42-, Na+, Ac- |
| 7 | pF6 | KI | Р желтый | Есть Рb2+ | PbI2 | Na+, SO42-, Ac-, К+, I- |
| K2CrO4 | Р желтый | PbCrO4 | Na+ , SO42-, К+, CrO42-, Ac- | |||
| 8 | P5 | Насыщенный Na2CO3, to | Р остался | BaCO3, SrCO3, CaCO3, BaSO4 | Na+, CO32-, SO42- | |
| 9 | P6 | HAc | P | часть BaSO4 | Ca2+, Sr2+, Ba2+, CО22-, Ac- | |
| 10 | F7 | K2CrO4 | Р желтый | Есть Ва2+ | BaCrO4 | Ca2+, Sr2+, Ac-, K+, CrO42- |
| 11 | F8 | Насыщенный Na2CO3 | – | Нет Sr2+, Са2+ | – | – |
Таблица 6 Отчетная карточка для катионов 3 группы
| № | Объект | Реактив | Результат | Вывод | Возможный состав | |
| Осадка | Раствора | |||||
| 1 | F9 | 6 моль/л NaOH | Р | щелочная среда | 3-5 группа катионов | 3-5 группа катионов |
| 2 | pР10 + pF10 | H2O2, 6 моль/л NaOH, to | Р | – | гидроокиси 4-5 группы катионов, SnO(OH)2 | AsO43-,CrO42-, Zn2+, Al3+, Sn(IV), Cu2+, Cd2+, Ca2+, OH-, щелочные металлы |
| 33 | F11 | индикатор | – | рН1 | – | AsO43-,CrO42-, Zn2+, Al3+, Sn(IV), Cu2+, Cd2+, Ca2+, OH-, щелочные металлы |
| 14 | F12 | дитиол | – | Нет Sn | – | AsO43-,CrO42-, Zn2+, Al3+, Cu2+, Cd2+, Ca2+, OH-, щелочные металлы |
| 5 | F13 | NaAc, | – | рН4 | – | AsO43-,CrO42-, Zn2+, Al3+, Sn(IV), Cu2+, Cd2+, Ca2+, Ac-, лужні метали |
| 6 | F14 | фильтр бумажный, морин, 2 моль/л HCl | – | Нет Al | – | AsO43-,CrO42-, Zn2+, Cu2+, Cd2+, Ca2+, Ac-, щелочные металлы |
| 7 | pF14 | HAc | рН5–7 | |||
| 8 | F15 | Co(NO3)2, (NH4)2Hg(SCN)4 +2 хв. | Р голубой | Есть Zn2+ | ZnHg(SCN)4 + CoHg(SCN)4 | AsO43-, CrO42-, Cu2+, Cd2+, Ca2+, Ac-, щелочные металлы |
| 9 | F16 | бензидин | – | Нет CrO42- | – | AsO43-, Cu2+, Cd2+, Ca2+, Ac-, щелочные металлы |
| 10 | F17 | AgNO3 | Р шоколадный | Есть As | Ag3AsO4 | Cu2+, Cd2+, Ca2+, Ac-, щелочные металлы |
Таблица 7 Отчетная карточка для катионов 4 – 5групп
| № | Объект | Реактив | Результат | Вывод | Возможный состав | |
| Осадка | Раствора | |||||
| 1 | pP11 | H2O2, 3 моль/л HNO3, to | P белый | Есть Sb? | SbO(OH)3 | все остальные катионы 4-5 групп |
| 2 | P17 | 12 моль/л HCl | F | – | – | все остальные катионы 4-5 групп |
| 3 | F18 | родамин Б | P фиолетовый | Есть Sb | соединение сурьмы с родамином Б | – |
Таблица 8 Отчетная карточка для анионов
| № | Объект | Реактив | Результат | Вывод | Возможный состав | ||
| Осадка | Раствора | ||||||
| 1 | F0 | CdAc2 | Р желтый | Есть 3-тя группа | CdS, Cd(BO2)2 | 4-5 группы | |
| 2 | F1 | CuSO4 | Р желтый → Р Чорный | Есть S2- | CuS | – | |
| 3 | F2 | AgNO3 | Р белый | AgCl | |||
| 4 | F3 | раствор Фаургольта | Р → F | Есть Cl-? | – | Ag(NH3)2+, Сl- | |
| 5 | F4 | 3 моль/л HNO3 | Р, белая каламуть | Есть Cl- | AgCl | ||
На основании макроскопических наблюдений (рис. 2.3) и качественного анализа (таблици 5 – 8) неизвестного минерала, делаем вывод (основываясь на литературных данных [10]), что это антимонит (Sb2S3).

Рисунок 2.3 Минерал антимонит
Полученные результаты измерений обрабатываем математически.
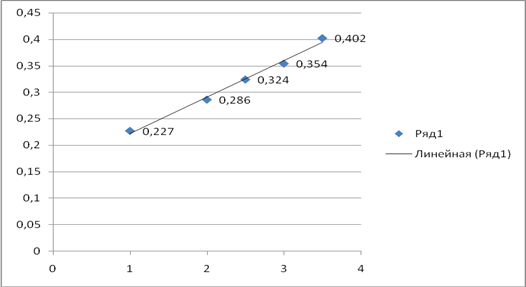
Рисунок 2.4 Зависимость оптической плотности A (ось ординат) от концентрации c∙10-5 (ось абсцисс) для стандартных растворов арсената
Масса навески антимонита 1,0565 г.
Оптическая плотность у 5 раз разбавленного раствора равна 0,258.
Формула для вычислений:
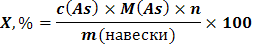
где n – разбавление (например, в 5 раз).
После вычислений получаем результат 0,57% As в антимоните (Sb2S3).
Похожие работы
... у поверхности Tmax(K) 270 Tmin(K) 200 Среднее давление у поверхности P (атм.) 6*10-3 Средняя плотность у поверхности r (г/см3) 1,2*10-5 Для атмосферы Марса характерно низкое относительное содержание водяного пара, на уровне сотых и тысячных долей процента. Около 80% количества H2O сосредоточено в ...
... философии - особенно с методологических позиций материалистического понимания истории и материалистической диалектики с учетом социокультурной обусловленности этого процесса. Однако в западной философии и методологии науки XX в. фактически - особенно в годы «триумфального шествия» логического позитивизма (а у него действительно были немалые успехи) - научное знание исследовалось без учета его ...
0 комментариев