Навигация
Жінок) віком 42-65 років (середній вік 56,2±1,1 років). У дослідження не включались пацієнти на гострий ІМ із супутнім ЦД 1 типу
5 жінок) віком 42-65 років (середній вік 56,2±1,1 років). У дослідження не включались пацієнти на гострий ІМ із супутнім ЦД 1 типу.
Діагноз Q-ІМ встановлювали на основі клінічних, електрокардіографічних і біохімічних критеріїв у відповідності до вимог Європейського Товариства кардіологів (2003) щодо визначення і лікування гострого ІМ із підйомом сегмента ST; діагноз не Q-IM – відповідно до вимог Керівництва Європейського Товариства кардіологів (2002), діагноз ЦД 2 типу – на основі анамнестичних даних та у випадках неодноразового виявлення рівня глюкози в плазмі крові натще 7,0 ммоль/л і вище (ВООЗ, 1999).
Програма дослідження включала збір паспортних, антропометричних даних, з’ясування факторів ризику, особливостей розвитку та клінічного перебігу захворювання, проведення лабораторних та інструментальних обстежень, вивчення стану ліпідного, вуглеводного, жирового, пуринового обміну, системного імунного запалення, метаболізму оксиду азоту, ПОЛ та антиоксидантного захисту, ЕКГ, ЕхоКГ. Забір венозної крові проводився у пацієнтів натще в 1-у та 21-у доби ІМ та через 3 місяці. Дослідження здійснювали на біохімічному аналізаторі ФП-901 (Фінляндія), спектрофотометрі СФ-46 та апараті для електрофорезу ЭПАУ-20-50.
Оцінку стану вуглеводного обміну здійснювали шляхом визначення рівня глюкози у капілярній крові за допомогою глюкозооксидантного методу натще й декілька разів впродовж доби (глікемічний профіль), а також рівня глюкози у плазмі крові. У хворих визначали вміст у крові НbА1С за Gabbay K.H. et al. (1979, реактиви фірми Lachema) та іонообмінної спектрофотометрії за методикою набору реактивів фірми «DAC-SpectroMed S.R.L» (Moldova). У підгострий період ІМ серед хворих із проміжним рівнем НbА1С (6,8-8,0%) проводили тест із 75 г глюкози. За його результатами констатували ПТГ при рівні глюкози у плазмі ≥7,8 ммоль/л і <11,1 ммоль/л через 2 години після навантаження, достовірний ЦД 2 типу – при її концентрації понад 11,1 ммоль/л (ВООЗ,1999). Рівень С-пептиду (нг/мл) визначали за допомогою набору реактивів фірми «DRG Instruments GmbH» (Німеччина).
Для встановлення інсулінорезистентності (ІР) визначали рівень імунореактивного інсуліну в сироватці крові натще з використанням реактивів фірми «DRG Instruments GmbH» (Німеччина) та обчислювали загальноприйняті індекси, що характеризують ІР: а) індекс HOMA (інсулін сироватки натще (мклОД/мл)×глюкоза крові натще (ммоль/л)/22,5; б) індекс QUICKI (1/log інсуліну (мклОД/мл)+log глюкози (мг/дл); в) індекс McAuley(EXP (2,63–0,28×LN (інсуліну натще [мклОд/мл]))–0,31×LN (тригліцериди[ммоль/л]); г) індекс Caro (глюкоза (ммоль/л )/інсулін (мклОд/мл));д) індекс Bennetta 1/LN (глюкоза (ммоль/л)×інсулін (мклОд/мл).
Стан ліпідного обміну досліджували шляхом визначення рівнів загального холестерину (ЗХС) за C.C. Allain et al. (1974, в модифікації Labsystems, Finland), холестерину ліпопротеїдів високої густини (ХС ЛПВГ) – в б-ліпопротеїдах, тригліцеридів (ТГ) – методом Fletcher (1968, в модифікації Lachema), холестерину ліпопротеїдів низької густини (ХС ЛПНГ) та дуже низької густини (ХС ЛПДНГ), коефіцієнту атерогенності (КА), ХС не-(ЛПВГ) – шляхом розрахунку: рівень ХС ЛПНГ – за формулою Фрідвальда (ХС ЛПНГ=ЗХС–(ХС ЛПВГ+ТГ/2,2) (ммоль/л)), КА – за формулою Клімова (КА=(ЗХС–ХС ЛПВГ)/(ХС ЛПВГ)), ХС не-(ЛПВГ)=ЗХС–ХС ЛПВГ (ммоль/л). Вміст аполіпопротеїнів А1 (апо-А) та В (апо-В) визначали імунотурбідиметричним методом (Orion Diagnostica (Фінляндія)).
Стан пуринового обміну оцінювали шляхом визначення вмісту у крові сечової кислоти за Marimont (1965) у модифікації А.М. Горячковского (1998). При вивченні жирового обміну в сироватці крові методом ELISA твердофазного імуноферментного аналізу визначали рівень лептину «DRG Instruments GmbH» (Німеччина).
Перекисне окислення ліпідів досліджували шляхом визначення рівня в крові малонового діальдегіду (МДА) за методом Е.Н. Коробейнікової (1989), дієнових кон’югат плазми (ДКп) та еритроцитів (ДКе) – методом І.Д. Стальної зі змінами за В.П. Верболовичем (1989). Стан системи антиоксидантного захисту – шляхом визначення вмісту церулоплазміну (ЦП) методом Ревина в модифікації С.В. Бестужева і В.Г. Колб (1982), глутатіону відновленого (ГВ) в еритроцитах крові – методом Э. Батлер, О. Дюбон, Б. Келли, антиоксидантної активності плазми (АОАп) та еритроцитів (АОАе) – тіобарбітуровим методом на спектрофотометрі СФ-46.
Активність системного запалення оцінювали методом ELISA – твердофазного імуноферментного аналізу, яким визначали вміст у крові інтерлейкіну–4 (ІЛ-4) та фактору некрозу пухлин-б (ФНП-б) за допомогою моноклональних антитіл реактивів фірми «Diaclone» (Франція); С-реактивний білок (СРБ) «Diagnostic Automation Inc» (США) та загальний фібриноген (ЗФ) – методом Р.А. Рутберга (1961). Оцінку метаболізму оксиду азоту (NO) здійснювали шляхом визначення рівня в крові загального оксиду азоту (Total NO) з допомогою реактивів фірми «R&D Systems Inc» (США).
Для встановлення розладів функції печінки у хворих на ІМ та супутній ЦД 2 типу визначали активність g-глютамілтранспептидази (g-ГТП) (В.Г. Колб, В.С. Камышников, 1982).
В обстежених осіб вимірювали ріст, масу тіла, об’єм живота та стегон. Розраховували індекс маси тіла (ІМТ) за формулою: маса тіла/ріст2 (кг/м2) та індекс абдомінального ожиріння (ІАО) (см) шляхом визначення відношення об’єму живота на рівні пупка до об’єму стегон на рівні великих вертлюгів стегнових кісток.
Ехокардіографічне дослідження проводили на ультразвуковому діагностичному апараті SIEMENS SONOLINE SL-1. Визначали кінцево-діастолічний та систолічний розмір (КДР, КСР) лівого шлуночка (ЛШ), товщину міжшлуночкової перегородки і задньої стінки ЛШ, розмір лівого передсердя і правого шлуночка, розраховували кінцево-діастолічний та кінцево-систолічний об'єми (КДО, КСО) ЛШ. Фракцію викиду обчислювали за методом Simрson.
Таблиця 1
Перелік проведених спеціальних методів дослідження хворих
на ІМ з і без ЦД 2 типу
| Дослідження | Кон-троль | Хворі на ІМ і ЦД | Хворі на ІМ без ЦД |
| Ліпідний спектр крові : а) ЗХС, ХС ЛПНГ, ХС ЛПВГ, ТГ, ХС ЛПДНГ; б) апо-А, апо-В | 25 11 | 173 78 | 90 70 |
| Вуглеводний обмін: а) НbА1С б) Інсулін, С-пептид | 25 11 | 171 84 | 122 27 |
| Пуриновий обмін (сечова кислота) | 15 | 104 | 50 |
| Показники ПОЛ а) МДА б) ЦП | 15 | 120 74 | 90 70 |
| Показники запалення та метаболізму оксиду азоту (Total NO, ФНП-б, ІЛ-4) | 11 | 63 | 50 |
| Визначення СРБ | 11 | 90 | 48 |
| Жировий обмін (лептин) | 12 | 64 | 15 |
| Визначення г-ГТП | 25 | 171 | 90 |
| Ехокардіографія | 25 | 196 | 90 |
Отримані результати обробляли за допомогою статистичних пакетів «Excel» і «STATISTICA 5.5». Параметричні дані подано у вигляді M±m (середніх значень показників та їх похибок) після перевірки на нормальність розподілу за допомогою критерію Колмогорова-Смірнова. Для оцінки міжгрупових відмінностей застосовували непарний t-критерій Стьюдента для неперервних величин і непараметричний критерій Манна-Уітні для рангових характеристик. При визначенні зв’язків між показниками використовували лінійний кореляційний аналіз із визначенням коефіцієнту кореляції Пірсона (r), при порівнянні таблиць частот – точний критерій Фішера для таблиць 2х2 і х2 для більших. Достовірними вважали відмінності при р<0,05. У ході прогнозування ускладнень ІМ (досягнення кінцевої точки) було проведено послідовний аналіз Вальда з виведенням кількісної характеристики у балах. Для тих ознак, які мали значущий зв’язок із досягненням комбінованої кінцевої точки принаймні в одній із груп порівняння, визначали міру інформативності Кульбака та виведенням відносного ризику (Relative risk, RR) події з 95% довірчим інтервалом. Для виявлення незалежних предикторів досягнення кінцевої точки і створення прогностичної моделі було проведено багатофакторний покроковий дискримінантний аналіз.
Результати дослідження.
У результаті ретроспективного аналізу даних 1593 карт стаціонарних хворих на гострий ІМ (611 (38,4%) жінок та 982 (61,6%) чоловіки) за трирічний період встановлено, що частка осіб із ЦД 2 типу становить 15,1%. При цьому у жінок із гострим ІМ супутній ЦД 2 типу виявляється майже у двічі частіше, ніж у чоловіків (відповідно у 20,1% і 12,1%). Істотне зростання частоти виникнення ІМ на фоні ЦД 2 типу зафіксовано у пацієнтів віком 45-60 років, незалежно від статі, найчастіше – серед осіб старших 50 років. У цьому віці ІМ і супутній ЦД 2 типу виявлено у 44 (26,2%) жінок, що у 1,3 рази більше ніж серед пацієнтів без ЦД (19,8%) (p>0,05), а у чоловіків – у 87 (46,2%) і 316 (36,5%) відповідно (р>0,05). Питома вага чоловіків віком 45-60 років з ІМ і ЦД 2 типу майже у 2 рази більша, ніж жінок (p<0,001). У подальшому частота хворих на ІМ і ЦД 2 типу зростає і при цьому суттєво збільшується частка жінок. Зокрема, у віковому періоді 61-75 років ІМ і ЦД 2 типу виявлено у 95 (56,5%) жінок і 78 (41,5%) чоловіків (p<0,01). У старечому віці (від 75 років) питома вага жінок із поєднаною патологією перевищує вдвічі таку у чоловіків (р<0,05).
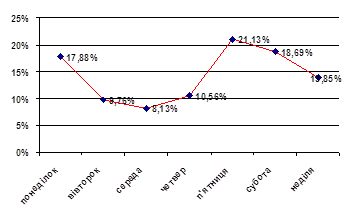
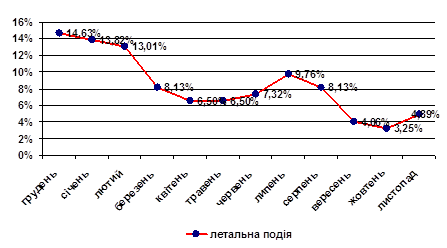
Госпітальна летальність серед хворих на ІМ і ЦД 2 типу вдвічі вища, ніж без ЦД (відповідно 23,2% і 12,1%). Серед жінок вона становила 24,4%, у чоловіків досягала 22,0%, що майже вдвічі більше ніж у групах пацієнтів відповідної статі без ЦД (відповідно 14,1% і 10,8%; р<0,01). Найпоширенішою безпосередньою причиною смерті пацієнтів із ЦД 2 типу був кардіогенний шок (33,3% жінок і 34,6% чоловіків), який у більшості випадків ускладнював перебіг первинного трансмурального або циркулярного ІМ. Другою за частотою причиною смерті виявилась застійна СН (26,7% жінок і 23,1% чоловіків), яка виникала переважно у хворих із повторним ІМ та частими рецидивами лівошлуночкової недостатності при первинному ІМ.
Аналіз клінічних проявів у період маніфестації ІМ засвідчив, що у значної частини хворих виникала передінфарктна стенокардія та інші продромальні симптоми. У жінок, порівняно із чоловіками, фон, на якому розвинувся ІМ, був значно важчим. Зокрема, стенокардія напруження в анамнезі зазначалась у 61,3% жінок і 50,5% чоловіків (р<0,05), АГ – 91,1% і 73,4 % відповідно (р<0,001). Більше ніж у 30% хворих на ЦД 2 типу ІМ розвивався повторно. Повторний ІМ встановлено у 36,7% чоловіків та у 39,9% жінок, що достовірно перевищувало аналогічні показники у хворих без ЦД (26,8% та 31,5% відповідно; р<0,05). Саме в осіб із ЦД 2 типу зазначено високу ймовірність розвитку повторного ІМ впродовж першого року. У жінок вона була вищою, ніж у чоловіків (41,7% та 36,2% відповідно; р>0,05). За даними проведеного дослідження, частка пацієнтів з ожирінням (ІМТ більше 30,0 кг/м2) серед хворих на ІМ і ЦД 2 типу становить 47,5%. Окрім того, у 40,0% осіб з ІМ і супутнім ЦД 2 типу виявлено надлишкову вагу. Серед жінок надлишкова вага й ожиріння спостерігались у 95,1% осіб, серед чоловіків – у 81,6% (p<0,001).
За даними клінічного спостереження у групі хворих із ЦД 2 типу ІМ вперше розвинувся у 60,1% жінок і 63,3% чоловіків. З них QS-ІМ спостерігався в 48,2% жінок і 44,7% чоловіків. Більше ніж у третини всіх хворих відмічали розвиток Q-ІМ, приблизно у кожного восьмого – ІМ без зубця Q (13,7% жінок і 13,3% чоловіків). Водночас, дуже складно, а іноді неможливо, визначити глибину ураження ІМ у хворих із супутнім ЦД через значну частку повторних ІМ. Аналіз локалізації вогнищ некрозу в міокарді загалом засвідчив відсутність істотної відмінності щодо розвитку ІМ по передній чи задній стінках ЛШ у чоловіків та жінок. Характерним було те, що у більшості хворих, незалежно від статі, зазначали одночасне ураження декількох стінок ЛШ. Виявлена особливість є свідченням поширеного, множинного ураження артерій у осіб із ЦД 2 типу, які тривалий час зазнають впливу гіперглікемії. Додатковим підтвердженням цього є частіший розвиток у них тромбоішемічного інсульту, як наслідку втягнення у процес інших судинних басейнів. Перенесений інсульт, переважно за ішемічним типом, встановлено у 11,9% чоловіків, що значно перевищувало відповідний показник у жінок 5,9% (p<0,05).
У 27,9% жінок і 19,1% чоловіків початок ІМ на фоні ЦД 2 типу був атиповим. Атипові прояви на початку ІМ відзначались частіше у жінок, ніж у чоловіків (p<0,05). Серед атипових форм переважав астматичний, малосимптомний, безбольовий варіанти дебюту ІМ. У більшості хворих на ЦД 2 типу було встановлено поєднання класичного ангінозного нападу і вираженого астматичного варіантів – 64,3% жінок та 52,1% чоловіків, p<0,05. Відсутність типового болю за грудиною у хворих на ІМ із супутнім ЦД 2 типу зумовила те, що лише 72,0% жінок та 77,1% чоловіків були госпіталізовані у перший день розвитку хвороби.
Ризик розвитку ускладнень у хворих з ІМ значно підвищувався за умови наявності у них супутнього ЦД 2 типу. У хворих з ІМ і ЦД 2 типу частіше ніж у пацієнтів на ІМ без ЦД у дебюті захворювання виникала гостра лівошлуночкова недостатність – відповідно 57,9% і 40,9% осіб (р<0,01), переважно ІІ ступеня за Killip. Вона розвивалась у 1,9 рази частіше у пацієнтів із ІМ і ЦД 2 типу, ніж у недіабетичних хворих (р<0,002). У переважній більшості випадків гостра СН у подальшому трансформувалася у застійну СН, яка спостерігалась у кожного третього пацієнта з ІМ і ЦД 2 типу та лише у кожного шостого – без ЦД 2 типу (p<0,05). У частини пацієнтів прогресування застійної СН призводило до появи плеврального випоту, який частіше виявляли у хворих із ЦД 2 типу, ніж без діабету (11,8 % і 2,2 % відповідно; р<0,05), та виникнення гідроперикарду (4,2 % і 1,1 % відповідно; р<0,05). Аналіз виявлення низки ускладнень ІМ: загрозливих для життя аритмій – фібриляції шлуночків, шлуночкової тахікардії, пароксизмів надшлуночкової тахікардії, блокад ніжок пучка Гіса, рецидивів ІМ, постінфарктної стенокардії тощо, засвідчив відсутність значних відмінностей між цими показниками у хворих обох груп.
Оцінка стану вуглеводного обміну показала, що тривалість ЦД 2 типу у хворих на ІМ становила в середньому 7,5 років (від 1 до 30 років). Частка пацієнтів із тривалістю ЦД 2 типу до 5-ти років була високою і складала 53,4%, що є ще одним аргументом прискорення розвитку ІМ за наявності ЦД. Значно менше було пацієнтів, які мали в анамнезі ЦД 2 типу від 5-ти до 10-ти років та більше 10-ти років. Зокрема, тривалість ЦД 2 типу від 5-ти до 10-ти років констатовано у 47 (22,8%), а більше 10-ти років – у 49 (23,8%) осіб. За рівнем НbА1С компенсація ЦД 2 типу у жінок була істотно нижчою, порівняно із чоловіками: у жінок середній рівень НbА1С становив 9,62±0,31%, у чоловіків – 8,79±0,24%, р<0,01.
У 43,6% хворих на ІМ вперше виявлено підвищений рівень глюкози. У ході дослідження був розроблений і апробований спосіб визначення рівня НbА1С, з метою диференціації «стресової» гіперглікемії та недіагностованого раніше вперше виявленого ЦД 2 типу. Запропоновані критерії: при рівні НbА1С нижче 7,0% діагноз ЦД заперечується, підвищення рівня понад 7,0% свідчить про наявність ЦД або ПТГ, що розвинулися ще задовго до виникнення ІМ (принаймні до 3-х місяців).
Вперше виявлений ЦД 2 типу або ПТГ діагностовано у 26,0% обстежених (рис. 1).
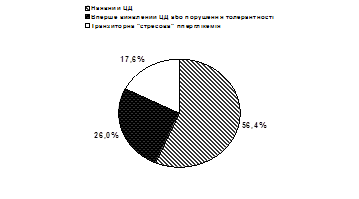
Як засіб діагностики вперше виявленого ЦД 2 типу, визначення вмісту НbА1С найбільш інформативне у випадках, коли його рівень значно перевищує норму. Зокрема, за відсутності даних щодо ЦД в анамнезі в обстежених хворих цієї групи він становив 8,1–17,9% (в середньому – 9,9±0,48%). При регулярному контролі глікемії під час лікування в стаціонарі також стабільно фіксували високий рівень глюкози крові (в середньому – 8,6±1,0 ммоль/л). На нашу думку, це свідчить про наявність у цих пацієнтів ЦД 2 типу. У 17,6% хворих констатовано гіперглікемію, зумовлену стресовою реакцією на розвиток ІМ. У цих хворих НbА1С був у межах норми (до 7,0%). Незважаючи на наявність гіперглікемії протягом перших діб, діагноз ЦД не підтверджувався і потреби у призначенні гіпоглікемізуючої терапії не було. Така інтерпретація результату тесту на НbА1С надалі повністю себе виправдала. Рівень глікемії в цих хворих протягом найближчого тижня нормалізувався.
Результати проведеного дослідження засвідчили, що більш ніж у 80% пацієнтів з ІМ і ЦД 2 типу виявлено значне відхилення від цільових значень показників ліпідного обміну, рекомендованих ESC і EASD (2007). У понад 75% хворих відзначено підвищення ЗХС і ХС ЛПНГ, у кожного третього – виражена гіперхолестеринемія (ЗХС>6,2 ммоль/л, ХС ЛПНГ>4,1 ммоль/л), і майже у кожного другого – гіпертригліцеридемія (ТГ>2,0 ммоль/л). Більш ніж у половини пацієнтів виявлялася гіпо-альфа-холестеринемія (ХС ЛПВГ<1,2 ммоль/л у жінок і <1,0 чоловіків).
Встановлено, що абсолютний рівень ЗХС, ХС ЛПНГ, ТГ достовірно вищий у пацієнтів на ІМ і ЦД 2 типу, порівняно із хворими на ІМ без ЦД. Лише у 8,3% пацієнтів із гострим ІМ і ЦД 2 типу рівень основного атерогенного показника ХС ЛПНГ відповідав цільовому (<2,5 ммоль/л), а ТГ були в межах норми (<1,7 ммоль/л), що достовірно рідше ніж у пацієнтів без ЦД 2 типу (17,7%). Надмірне патологічне підвищення ЗХС понад 6,2 ммоль/л, ХС ЛПНГ – вище 4,1 ммоль/л, ТГ – вище 2,0 ммоль/л виявлялось у значно більшої кількості хворих із ЦД, ніж в осіб без ЦД (p<0,01). Гіпертригліцеридемію (рівень ТГ>2,0 ммоль/л) відмічали в половини з усіх хворих зі ЦД і майже в третини пацієнтів на ІМ без ЦД (p<0,05). Патологічне зниження антиатерогенного ХС ЛПВГ (нижче 1,0 ммоль/л) і підвищення ТГ (вище 2,0 ммоль/л) виникало у 2,4 рази частіше у хворих на ЦД 2 типу, ніж без ЦД (p<0,05).
Результати аналізу порушень ліпідотранспортної системи залежно від наявності чи відсутності ЦД 2 типу свідчать про значне зростання апо-В в обох групах хворих на ІМ, але в більшій мірі серед хворих з ЦД. Зокрема, рівень апо-В у крові цих пацієнтів був на 27,3% достовірно вищим, ніж у обстежених на ІМ без ЦД (відповідно 2,16±0,16 і 1,57±0,14 г/л, p<0,05). Збільшення рівня апо-В, що перевищує припустимі межі норми, удвічі частіше (1,82 г/л у жінок і 1,86 г/л у чоловіків) спостерігалось серед пацієнтів на ІМ і ЦД, ніж у хворих без ЦД (відповідно у 44,8% і 21,1% осіб, p<0,01). Щодо протиатерогенного захисту, то відмінності у рівнях апо-А залежно від наявності супутнього ЦД не зазначено. Рівень апо-А в однаковій мірі патологічно знижений у пацієнтів на ІМ як із ЦД, так і без нього.
При порівнянні показників ліпідного обміну за приналежністю до певної статі підтверджено більш виражений атерогенно змінений обмін у жінок. Зокрема, якщо серед пацієнток з ІМ та ЦД 2 типу середній рівень ЗХС становив 6,16±0,22 ммоль/л, то в групі чоловіків із таким же діагнозом – 5,32±0,15 ммоль/л, р<0,001; ХС ЛПНГ – відповідно 4,00±0,21 і 3,25±0,13 ммоль/л, р<0,001; КА – 4,55±0,30 та 3,66±0,17 од, р<0,01; ХМ – 2,27±0,11 і 2,02±0,07%, р<0,05; ХС не-(ЛПВГ) – 4,90±0,24 і 4,11±0,15 ммоль/л, р<0,01; апо-В – 2,03±0,12 і 1,72±0,12 г/л, р<0,05. Хоч такі показники, як ХС ЛПДНГ, ТГ, індекс ТГ/ЛПВГ, коефіцієнт апо-В/апо-А були вищими, а ХС ЛПВГ і апо-А – нижчими серед жінок, проте, відмінність за приналежністю до певної статі виявилась статистично недостовірною.
Надмірно підвищений ЗХС понад 6,2 ммоль/л, ХС ЛПНГ – вище 4,1 ммоль/л, ТГ – вище 2,0 ммоль/л виявляли у 2,5 рази частіше у жінок, ніж у чоловіків (p<0,05). Виражену гіперхолестеринемію відзначали в кожної третьої жінки та в кожного п’ятого чоловіка (p<0,05). Характерна ознака діабетичної дисліпідемії (ДЛП) – патологічне зниження антиатерогенного ХС ЛПВГ (нижче 1,0 ммоль/л у чоловіків і 1,2 ммоль/л у жінок) та підвищення ТГ (вище 2,0 ммоль/л), також була більш властива жінкам. В останніх її констатували в п’ять разів частіше, ніж у чоловіків (p<0,001).
Відстежено взаємозв’язок між вираженістю порушень вуглеводного обміну, критерієм якого є патологічно підвищений рівень НbА1С, та змінами ліпідного спектру крові в пацієнтів із гострим ІМ та ЦД 2 типу. У хворих із рівнем НbА1С понад 10%, порівняно із групою пацієнтів з НbА1С у межах 7–8%, рівень ЗХС був вищий на 13,9%, ХС ЛПНГ – на 20,8%, ХС ЛПДНГ – на 20,7%, КА – на 32,4%, ТГ – на 18,6%, ХМ – на 19,1%, ХС не-(ЛПВГ) – на 21,8%, а рівень ХС ЛПВГ був знижений на 10,0% (усі відмінності достовірні, р<0,05).
Проаналізовано ліпідний спектр крові залежно від наявності АГ. Встановлено, що середні рівні основних показників ліпідного спектру крові у пацієнтів з АГ значно перевищують аналогічні в осіб без АГ. Наприклад, якщо в групі пацієнтів без АГ середній рівень ЗХС становить 4,87±0,21 ммоль/л, то в групі хворих з АГ – 5,80±0,22 ммоль/л (р<0,05); ХС ЛПНГ – відповідно, 3,03±0,39 ммоль/л і 3,84±0,21 ммоль/л (р<0,05); ХС ЛПДНГ – 0,78±0,04 і 0,89±0,03 ммоль/л (р<0,05); ТГ – 1,73±0,08 і 1,99±0,07 ммоль/л (р<0,05); ХС не-(ЛПВГ) – 4,11±0,31 і 4,90±0,15 ммоль/л (р<0,05); КА – 3,44±0,35 і 4,33±0,33 од (р<0,05); індекс ЗХС/ХС ЛПВГ – 4,24±0,16 і 5,00±0,16 од (р<0,05); індекс ТГ/ХС ЛПВГ – 1,53±0,06 і 1,76±0,06 од (р<0,05) індекс ХС ЛПНГЧТГ – 7,78±0,56 і 5,89±0,36 од (р<0,05).
У пацієнтів з ІМ і ЦД 2 типу ступінь ожиріння, на відміну від порушення вуглеводного обміну та наявності АГ, суттєво не впливав на вираженість атерогенних змін ліпідного спектру крові.
Результати проведеного дослідження показали, що у пацієнтів на ІМ і ЦД 2 типу існує взаємозв’язок між вираженістю змін показників ліпідного обміну, які належать до різних класів. Зокрема, зростання холестеринвмісних показників спричиняло погіршення тригліцеридвмісних, і навпаки. У цих хворих зазначено помірну кореляційну залежність між ЛПНГ і ТГ (r=0,4). Враховуючи встановлені закономірності, для проведення оцінки ліпідного обміну впродовж виконання дослідження також розроблено і запропоновано індекс ХС ЛПНГЧТГ, який одночасно характеризує холестериновий і тригліцеридний обмін. Рівень індексу ХС ЛПНГЧТГ нижче 4,3 одможе свідчити про ефективність медикаментозної корекції ДЛП у хворих на ІМ із ЦД 2 типу.
Серед обстежених хворих на ІМ із супутнім ЦД 2 типу інсулінорезистентність за індексом HOMA більше 2,9 ум од діагностували у 48,8% осіб. Проведене дослідження засвідчило значно гірший стан вуглеводного обміну у хворих на ІМ і ЦД 2 типу з ІР. Зокрема, у групі з ІР, порівняно без ІР, рівень глікемії був вищим на 34,8% (р<0,05), НbА1С – на 11,1% (р<0,05), індексу НОМА – у 4,5 рази, інсуліну – у 3 рази. Індекс QUICKI, відповідно, виявився нижчим на 26,8%, індекс McAuley – на 40,7%, індекс Caro – у 5,2 рази (рис. 2). Достовірної різниці щодо тривалості ЦД 2 типу між групами встановлено не було (відповідно 4,83±1,24 та 5,96±1,33 роки).
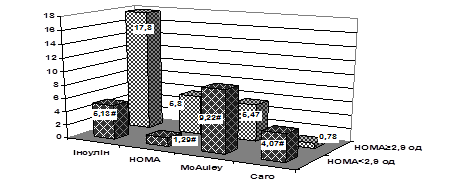
Рис. 2. Показники інсулінорезистентності у хворих на ІМ і ЦД 2 типу залежно від рівня індексу HOMA.
Виявилось, що найсуттєвіші зміни ліпідного спектру крові спостерігали в осіб, у яких діагностовано ІР. І навпаки, найменш виражені прояви ДЛП відзначались у пацієнтів, у яких рівень імунореактивного інсуліну, індекси HOMA, QUICKI, McAuley та Caro не вказували на наявність ІР. У порівнянні з пацієнтами без ІР, рівень ЗХС у групі з ІР був вищий на 19,0% (р<0,05), ХС ЛПНГ – на 24,3% (р<0,05), ХС ЛПДНГ – на 21,7% (р<0,05), КА – на 30,2% (р<0,05), ТГ – на 24,8 % (р<0,05), ХС не-(ЛПВГ) – на 25,9% (р<0,05), ХМ – на 28,2% (р<0,05), апо-В – на 25,7% (р<0,05). При цьому рівень ХС ЛПВГ, апо-А та індекс апо-В/апо-А змінювалися недостовірно.
На думку K.A. McAuley та співавторів (2001), найкращим способом виявлення ІР у загальній популяції населення є розрахунок індексу, що базується на визначенні рівнів ТГ та інсуліну натще. Результати проведеного дослідження вказують, що існує достовірний зворотний зв’язок між індексом McAuley та концентрацією СРБ (r= –0,44; p<0,01), ФНП-б (r= –0,28; p<0,05), а також прямий – із ІЛ-4 (r=0,23; p<0,05). Щодо ЗФ, то між останнім та індексом McAuley достовірного зв’язку не спостерігалось. Результати дослідження також вказують, що існує достовірний зворотний зв’язок між індексом McAuley та концентрацією в крові таких ліпідних показників, як ЗХС (r= –0,51; p<0,01), ХС ЛПНГ (r= –0,47; p<0,01), ХС ЛПДНГ(r= –0,64; p<0,01), КА (r= –0,51; p<0,01), ТГ (r= –0,64; p<0,01), ХС не-(ЛПВГ) (r= –0,52; p<0,01), ХМ (r= –0,65; p<0,01), Aпо-В (r= –0,37; p<0,01), індексом ЗХС/ХС ЛПВГ (r= –0,51; p<0,01), індексом ТГ/ХС ЛПВГ (r= –0,61; p<0,01). Щодо ХС ЛПВГ, апо-А, то між останніми та індексом McAuley достовірного зв’язку не спостерігалось. Таким чином, ІР взаємопов’язана з порушеннями ліпідного обміну та активацією системного запалення.
Частота виявлення ІР була у 1,8 рази більша у жінок ніж у чоловіків (67,5% і 37,3% відповідно, р<0,05) та у 2 рази більша в осіб з АГ ніж у пацієнтів без АГ (58,6 % і 27,2 % відповідно, р<0,05).
Результати проведеного дослідження показали, що у хворих на ІМ і ЦД 2 типу при виявленні ІР значно гірший перебіг ІМ на тлі ЦД 2 типу. Зокрема, лише у 17,5% пацієнтів на ІМ з ІР (2-а група) спостерігався неускладнений перебіг ІМ, що значно рідше, ніж серед хворих на ІМ без ІР (1-а група) – 36,5% (р<0,05). Порівняно з пацієнтами 1-ї групи, у хворих з ІР (2-а група) частіше виникали постінфарктна стенокардія (відповідно 27,5% і 7,3%). Достовірно встановлено, що у пацієнтів з ІР частіше виявлялась супутня АГ. Інфаркт міокарда супроводжувався суттєвим зростанням артеріального тиску при госпіталізації, а також періодичним підвищенням впродовж стаціонарного етапу лікування.
Дослідження лептину у хворих на ІМ із супутнім ЦД 2 типу засвідчило, що у частини пацієнтів його рівень у сироватці крові перевищував контрольні показники. Інша частина пацієнтів, навпаки, мала знижений рівень лептину. Залежно від зростання чи зниження вмісту лептину відносно контрольних показників хворі на ІМ і ЦД 2 типу були розділені на групи: 1-а група – середній рівень лептину становив 6,91±0,56 нг/мл і був значно нижчий від контролю 9,97±0,77 нг/мл; 2-а група – пацієнти з вищим рівнем лептину 14,41±0,98 (нг/мл), ніж у контролі. Ознаки ДЛП були найбільш вираженими в осіб 1-ї групи, у яких виявлено нижчий рівень лептину, ніж у контролі. Зокрема, порівняно з 2-ю групою, рівень ЗХС у 1-й групі був вищий на 30% (p<0,05); ХС ЛПНГ – на 38,2% (p<0,05); ХС ЛПДНГ – на 37,9% (p<0,05); КА – на 51,6% (p<0,05); ТГ – на 37,4% (p<0,05); ХС не-(ЛПВГ) – на 41,7% (p<0,05); ХМ – на 32,5% (p<0,05); індекс ЗХС/ХС ЛПВГ – на 37,8% (p<0,05); індекс ТГ/ХС ЛПВГ – на 45,9% (p<0,05); апо-В – на 24,2% (p<0,05). Рівень ХС ЛПВГ та апо-А змінювався недостовірно.
У групі хворих із зниженим рівнем лептину (1-а група), порівняно з особами з підвищеним його вмістом (2-а група), показники метаболізму NO та системного запалення змінювались більш суттєво. Зокрема, у хворих 1-ї групи рівень Total NO становив 100,49±9,41 мкмоль/л, у той час як у пацієнтів 2-ї групи – 81,17±9,50 мкмоль/л (р<0,05); рівень ФНП-б – відповідно 102,66±11,89 пг/мл та 68,87±9,22 пг/мл (р<0,05); рівень ІЛ-4, відповідно – 12,28±0,89 пг/мл і 8,20±0,55 пг/мл (р<0,05); рівень СРБ, відповідно – 9,56±0,56 мг/л і 6,87±0,62 мг/л (р<0,05).
Хоч рівень НbА1С достовірно не відрізнявся між групами порівняння, проте серед пацієнтів на ІМ і ЦД 2 типу гірший стан показників ІР виявлено в 1-й групі. І навпаки, найменш виражені прояви погіршення обміну інсуліну спостерігались у пацієнтів 2-ї групи із гіперлептинемією. У 1-й групі, порівняно з 2-ю групою, були вищими рівні індексів HOMA, Bennetta та імунореактивного інсуліну, і нижчими – рівні індексів QUICKI, McAuley. Зокрема, у 1-й групі, порівняно з 2-ю групою, рівень інсуліну та індекс НОМА були вищими у 2 рази (р<0,05), а індекс Bennetta – на 63% (р<0,05). У цій же групі індекс QUICKI був нижчим на 15,2% (р<0,05), індекс McAuley – на 37,0% (р<0,05).
Хворі на ІМ і ЦД 2 типу з ожирінням достовірно частіше реєструвались у 1-й групі (61,2%), порівняно з особами 2-ї групи (33,3%). Крім того, у даній роботі виявлено достовірний зворотний кореляційний зв’язок між лептином та ІМТ (r= –0,27; р<0,05).
Результати дослідження метаболізму NO показали, що незалежно від наявності чи відсутності ЦД 2 типу, у обстежених пацієнтів у першу добу гострого ІМ відзначали зростання рівня Total NO. Середній вміст цього показника достовірно (р<0,001) перевищив його рівень у контрольній групі. Крім того, встановлено, що у хворих з ІМ та ЦД 2 типу, а також – з ІР, порівняно із хворими на ІМ без ЦД, цей показник зростав ще в більшій мірі. Зокрема, у хворих на ІМ і ЦД 2 типу рівень Total NO становив 89,66±5,07 мкмоль/л, у пацієнтів на ІМ і ЦД з ІР (HOMA>2,9 ум. од) – 105,15±10,75 мкмоль/л, у хворих на ІМ без ЦД – 58,81±6,44 мкмоль/л (р<0,05) (табл. 2).
Таблиця 2
Показники системного запалення та метаболізму оксиду азоту у пацієнтівз ІМ залежно від наявності ЦД 2 типу та інсулінорезистентності
| Показники | Контроль (n=11) | ІМ без ЦД 1-а група (n=27) | ІМ із ЦД 2-а група (n=62) | ІМ з ІР, 3-я група (n=28) |
| Total NO (мкмоль/л) | 21,62±1,23 | 58,81±6,44 | 89,66±5,07* | 105,15±10,7 * # |
| СРБ (мг/л) | 2,92±0,28 | 6,52±0,58 | 6,83±0,66 | 10,04±0,76 * # |
| ФНП-б (пг/мл) | 2,36±0,16 | 43,23±6,59 | 85,79±5,07* | 100,15±10,75 * # |
| ІЛ-4 (пг/мл) | 4,69±0,38 | 8,85±1,19 | 10,62±0,67 | 9,58±1,08 |
| ЗФ (г/л) | 2,37±0,12 | 3,13±0,19 | 3,83±0,13 * | 4,18±0,16 *# |
Примітки:
1. * p<0,05 – достовірність різниці, у порівнянні з показниками 1-ї групи;
2. # p<0,05 – достовірність різниці, у порівнянні з показниками 2-ї групи.
Рівень Total NO був достовірно вищий при передній локалізації ІМ, порівняно із задньою (відповідно 92,62±6,6 мкмоль/л і 74,56±5,69 мкмоль/л, р<0,05); у жінок, порівняно із чоловіками (відповідно 98,31±7,41 мкмоль/л і 80,09±5,63 мкмоль/л, р<0,05), у хворих віком понад 60 років, порівняно з молодшими 60 років (відповідно 109,51±7,78 мкмоль/л і 80,16±6,10 мкмоль/л, р<0,05), при концентрації НbА1С>8%, порівняно з НbА1С<8%, (відповідно 103,10±6,37 мкмоль/л і 71,32±6,60 мкмоль/л, р<0,05).
Встановлено прямий достовірний зв’язок між Total NO та показниками системного запалення: концентрацією СРБ (r=0,48; p<0,01), ФНП-б (r=0,64; p<0,01), ЗФ (r=0,34; p<0,05). Щодо показника системного запалення ІЛ-4 – цитокіну, який має одночасно про- та протизапальні властивості, то між ним та Total NO достовірного зв’язку не відзначали. Аналіз кореляцій Total NO та МДА (r=0,78; p<0,01) підтвердив його тісний зв’язок із процесами ПОЛ. У роботі продемонстровано достовірний прямий зв’язок між Total NO та концентрацією у крові ЗХС (r=0,23; p<0,05), ХС ЛПНГ (r=0,24; p<0,05), КА (r=0,27; p<0,05), індексом ЗХС/ХС ЛПВГ (r=0,27; p<0,05), апо-В (r=0,37; p<0,05). Виявлено достовірний зворотний зв’язок між Total NO та показником ліпідного спектру крові – ХС ЛПВГ (r= –0,33; p<0,05). Проте, не всі показники ліпідного спектру крові достовірно корелювали із рівнем Total NO. Достовірного зв’язку між ним та рівнями ТГ, апо-А не встановлено.
В обстежених хворих на гострий ІМ із ЦД 2 типу із погіршенням вуглеводного обміну та наростанням ІР підвищується рівень Total NO, про що свідчить позитивна кореляція між ним та концентрацією у крові основних показників вуглеводного обміну – глюкозою (r=0,47; p<0,01), НbА1С (r=0,39; p<0,01), індексом HOMA (r=0,21; p<0,05), C-пептидом (r=0,33; p<0,01).
В обстежених пацієнтів у першу добу гострого ІМ відзначали зростання показників системного запалення – ФНП-б, ІЛ-4, СРБ, ЗФ (табл.2). Середній вміст усіх цих показників достовірно (р<0,001) перевищив аналогічні у контрольній групі. Однак, у хворих з ІМ та ЦД 2 типу (2-а група), а також з ІР (3-я група), порівняно з особами без ЦД (1-а група), показники системного запалення змінювались більш суттєво. Зокрема, у хворих 2-ї групи рівень ФНП-б становив 85,79±5,07 пг/мл, у пацієнтів 3-ї групи – 100,15±10,75 пг/мл, у той час, як у пацієнтів 1-ї групи – 43,23±6,59 пг/мл (р<0,001); концентрація ЗФ, відповідно – 3,83±0,13 г/л, 4,18±0,16 г/л і 3,13±0,19 г/л (р<0,05). У хворих 2-ї та 3-ї груп, порівняно із 1-ю групою, спостерігався вищий рівень ІЛ-4 – відповідно 10,62±0,67 пг/мл, 9,58±1,08 пг/мл і 8,85±1,19 пг/мл, та СРБ, відповідно – 6,83±0,66 мг/л, 10,04±0,76 мг/л і 6,52±0,58 мг/л. Проте, достовірної різниці між хворими із ІМ і ЦД (2-а й 3-тя група) та пацієнтами із ІМ без ЦД виявлено не було. Однак, найсуттєвіше достовірне зростання показників системного запалення (ФНП-б на 16,7% (р<0,05), СРБ на 46,9% (р<0,001), ЗФ на 9,1% (р<0,05), порівняно з пацієнтами 2-ї групи), відзначали насамперед у хворих на ІМ та ЦД 2 типу з ІР (HOMA>2,9 ум. од) (3-я група). Ймовірно, що наявність ІР поглиблює системне запалення.
Результати аналізу показників ПОЛ та антиоксидантного захисту засвідчили, що у пацієнтів із ЦД 2 типу ІМ виникає на фоні важкого оксидативного стресу. Встановлено, що у хворих на ІМ із супутнім ЦД 2 типу середньогрупові рівні основних показників ліпопероксидації зростають помітніше, ніж у пацієнтів на ІМ без ЦД 2 типу. Зокрема, якщо в групі хворих на ІМ і ЦД 2 типу рівень МДА становив 4,95±0,07, то в групі без ЦД – 4,63±0,09 нмоль/мл, р<0,02; ДКп відповідно – 4,58±0,11 та 3,86±0,17 нмоль/мл, р<0,01.
Зниження показників антиоксидантної системи в осіб із ЦД 2 типу досягло достовірності, порівняно з пацієнтами без ЦД. Зокрема, у пацієнтів на ІМ і ЦД 2 типу АОАп досягала 7,57±0,24%, а пацієнтів на ІМ без ЦД – 8,37±0,34%, що виявилось на 9,6% нижче (р<0,05); АОАе, відповідно – 30,72±0,67% та 34,55±1,12% (на 11,1%, р<0,02). Достовірно нижчим ніж в осіб без ЦД 2 типу (на 6,3%) виявився також рівень ГВ (1,34±0,02 ммоль/мл і 1,45±0,05 ммоль/мл відповідно, р<0,05). Щодо ЦП, то його рівень навпаки не знижувався, а більш істотно зростав у хворих на ІМ із ЦД 2 типу, ніж в осіб без ЦД. Зокрема, у пацієнтів із гострим коронарним синдромом і ЦД 2 типу рівень ЦП досягав 568,7±15,9 мг/л, а у хворих на ІМ без ЦД – 518,2±16,5 мг/л, р<0,05.
У пацієнтів на ІМ і ЦД 2 типу в дебюті захворювання при виникненні у них гострої лівошлуночкової недостатності ІІ-ІІІ класу за Killip середній рівень МДА і ЦП був достовірно вищий, ніж у хворих на ІМ і ЦД 2 типу без вираженої гострої СН (І клас за Killip) (МДА відповідно 5,48±0,17 нмоль/мл і 4,83±0,08 нмоль/мл (p<0,01), а ЦП – 614,9±19,9 мг/л і 492,3±27,4 мг/л (p<0,001)). Також зазначено, що у жінок прояви оксидативного стресу важчі, порівняно із чоловіками. Зокрема, якщо у жінок середній рівень МДА становив 5,46±0,14 нмоль/мл, то в групі хворих чоловіків – 5,02±0,08 нмоль/мл (р<0,01), рівень ЦП відповідно 619,7±29,1 мг/л і 494,1±20,9 мг/л (р<0,001). Вміст показників оксидативного стресу – МДА та ЦП у крові хворих на ІМ і ЦД 2 типу суттєво підвищувався в залежності від погіршення вуглеводного обміну. Тобто зі наростанням рівня НbА1С вміст МДА збільшується: у крові хворих із концентрацією НbА1С >8% він достовірно вищий (5,40±0,10 нмоль/мл), ніж у хворих із НbА1С <8% (4,92±0,10 нмоль/мл), р<0,01). Проте, щодо ЦП відмінність у залежності від умісту НbА1С виявилась статистично недостовірною. Проаналізовано рівень показників оксидативного стресу в залежності від вираженості ІР. Виявилось, що у хворих із ЦД 2 типу концентрація АДА у крові значно вища при рівні індекс HOMA більше 2.9 ум.од. При цьому, якщо із ІР середній рівень МДА становить 5,47±0,12 нмоль/мл, то в групі пацієнтів без ІР – 4,93±0,06 нмоль/мл (p<0,01). Аналіз середнього значення ЦП залежно від наявності ІР, загалом не виявив достовірної міжгрупової різниці, хоч його підвищення відзначали у групі хворих із ІР.
Встановлено прямий достовірний зв’язок між МДА та показниками системного запалення: концентрацією СРБ (r=0,23; p<0,05), ФНП-б (r=0,37; p<0,05), ЗФ (r=0,34; p<0,05). Щодо показника системного запалення ІЛ-4, то між ним та МДА зазначили достовірний обернений кореляційний зв’язок (r= –0,24; p<0,05). Проте найвищий рівень взаємозв’язку спостерігався між МДА і Total NO (r=0,78; p<0,01).
У результаті дослідження виявлено достовірний прямий зв’язок між МДА та концентрацією в крові холестеринзв’язаних та тригліцеридзв’язаних показників: із ЗХС (r=0,50; p<0,01), ХС ЛПНГ (r=0,49; p<0,01), КА (r=0,52; p<0,01), ТГ (r=0,39; p<0,01), ХМ (r=0,46; p<0,01), ХС не-(ЛПВГ) (r=0,51; p<0,01), індексом ЗХС/ХС ЛПВГ (r=0,52; p<0,01), індексом ТГ/ХС ЛПВГ (r=0,41; p<0,01), апо-В (r=0,54; p<0,01), відношенням апо-В/апо-А (r=0,47; p<0,01). Крім того, відзначали достовірний зворотний зв’язок між МДА та антиатерогенним показником ліпідного спектру крові – ХС ЛПВГ (r= –0,31; p<0,05).
В обстежених хворих на гострий ІМ із ЦД 2 типу активація системи ПОЛ та пригнічення антиоксидантного захисту відповідає істотному погіршенню вуглеводного обміну та наростанню ІР, про що свідчить позитивна або негативна кореляція між показником вільнорадикального окислення ліпідів – МДА та концентрацією у крові основних показників вуглеводного обміну: глюкозою (r=0,42; p<0,01), НbА1С (r=0,31; p<0,01), інсуліном (r=0,23; p<0,05), індексами HOMA (r=0,29; p<0,05), QUICKI (r= –0,22; p<0,05) та McAuley (r=– 0,23; p<0,05). Важливим для усвідомлення ролі процесів ПОЛ у патогенетичних механізмах пришвидшеного розвитку атеросклерозу у хворих на ЦД 2 типу є встановлення прямої достовірної кореляції між МДА у 1-шу добу госпіталізації та вмістом у крові сечової кислоти (r=0,48, р<0,01). Водночас, на відміну від показників ліпідного, вуглеводного обміну та системного запалення, не виявлено достовірного взаємозв’язку між рівнем МДА та показниками жирового обміну – лептином (r=0,08, р>0,05) та ІМТ (r=0,16, р>0,05). Таким чином, у хворих на ІМ і ЦД 2 типу прояви оксидативного стресу пов’язані із вираженістю порушення метаболізму NO, системного запалення, ліпідного та вуглеводного обміну. Тому в клінічній практиці для покращання прогнозу у пацієнтів на ІМ і ЦД 2 типу слід оцінювати й корегувати весь цей комплекс патологічних змін.
Корекція вуглеводного обміну у хворих на ІМ і ЦД 2 типу із ІР.
На сьогодні немає однозначного підходу до корекції гіперглікемії у хворих із ЦД 2 типу при виникненні гострого ІМ (P. Deedwania et al., 2008),. Переважно у більшості спеціалізованих установ із лікування ІМ хворих із ЦД переводять на дробне три-чотиразове введення невеликих доз інсуліну короткої дії. Такий підхід зумовлений тим, що інсулін при ІМ не тільки знижує рівень глікемії, а й проявляє метаболічну, фібринолітичну, антиоксидантну, протизапальну, вазодилатуючу дію (F. Gao et al., 2002; V.W. Wong et al., 2004; R. Lautamдki et al., 2006). Однак у деякої частини хворих, а саме – при ожирінні, метаболічному синдромі, традиційне призначення інсуліну у відповідності до рівня глікемії не завжди дозволяє ефективно її корегувати через наявність у пацієнтів ІР.
Для вивчення ефективності корекції гіперглікемії та ІР обстежені пацієнти були розподілені на дві групи. Основну (1-шу) групу (19 пацієнтів) склали хворі на ІМ і ЦД 2 типу, яким з 9–10-го дня разом із інсуліном короткої дії (у середньому 34,0±2,2 Од на добу) призначали метформін у початковій дозі 500 мг 2 рази на добу (в обід і ввечір). Надалі поступово впродовж 2–3-х днів підвищували дозу до підтримуючої – 2000 мг на добу у 2 приймання. До контрольної (2-ї) групи увійшли 22 пацієнти з ІМ і ЦД 2 типу, які продовжували отримувати монотерапію інсуліном. Оцінка показників вуглеводного обміну та ІР, ліпідного спектру крові, маркерів системного запалення, метаболізму NO, лептину, оксидативного стресу, антропометричних вимірів (ІМТ, ІАО), функціонального стану печінки достовірної різниці між групами не зазначила.
Вивчення впливу різних схем фармакотерапії на показники гіперглікемії та ІР у пацієнтів на ІМ і ЦД 2 типу засвідчило істотні переваги комбінованої терапії. У групі пацієнтів, яким призначали інсулін у поєднанні з метформіном (1-а група), через три тижні від початку лікування спостерігалось достовірне зниження концентрації глюкози в крові – на 17,0% (p<0,05), а у 2-й групі – на 12,6% (p<0,05), інсуліну – на 45,7% (p<0,05) і 43,3% (p>0,05), індексу HOMA – на 61,2% (p<0,05) і 39,1% (p<0,05), індексу Bennetta – на 34,0% (p<0,05) і 8,5% (p>0,05). Інший показник ІР – індекс McAuley у 1-й групі достовірно покращився на 30,3% (p<0,05), у 2-й групі – на 9,7% (p>0,05), вміст С-пептиду – на 42,9% (р<0,05) і 29,0% (р<0,05). Отже, кількісне значення індексів HOMA McAuley вказувало на збереження проявів ІР у пацієнтів 2-ї групи на кінець стаціонарного етапу лікування. Рівень С-пептиду в цій групі хворих зріс теж несуттєво і перед випискою зі стаціонару залишався у двічі нижчим від контролю.
Отримані у даному дослідженні результати показали, що в кінці стаціонарного етапу лікування на фоні комбінованої фармакотерапії відбулось достовірне покращення процесів, пов’язаних із ПОЛ. Зокрема, рівень МДА у пацієнтів 1-ї групи достовірно знизився на 9,2% (з 5,53±0,20 ммоль/л до 5,02±0,12 ммоль/л, р<0,05), тоді як у хворих 2-ї групи змінювався недостовірно.
На фоні комбінованої терапії інсуліном і метформіном, на відміну від монотерапії інсуліном, у хворих на ІМ і ЦД 2 типу із ІР істотно знижувався рівень показників обміну тригліцеридів. Показники обміну тригліцеридів до і після лікування інсуліном у комплексі з метформіном (1-а група) змінювались наступним чином: концентрація ТГ знизилась на 21,4% (р<0,05); ХС ЛПДНГ, які містять значну кількість ТГ, – на 20,6% (p<0,05); ХМ – на 20,0% (p<0,05); індекс ТГ/ХС ЛПВГ – на 22,5% (p<0,05). У пацієнтів 2-ї групи, які протягом 3-х тижнів отримували монотерапію інсуліном, зазначалась тенденція лише до поліпшення тригліцеридного ліпідного обміну: середній рівень ТГ знизився на 10,3 %, ХС ЛПДНГ – на 10,3 %,ХМ – на 13,0 %, індекс ТГ/ ХС ЛПВГ – на 13,0 %.
Призначення метформіну не викликало погіршення функції печінки. Навпаки, рівень г-ГТП, що є найбільш чутливим її показником, у хворих 1-ї групи, які додатково вживали метформін, в середньому знизився вдвічі (з 68,75±16,29 од/л до 35,73±3,7 од/л, р<0,05). Лише в одного пацієнта (5,3%) у кінці дослідження відмічалось збільшення г-ГТП з 18,1 од/л до 32,4 од/л, що суттєво не відрізнялось від контрольного значення (28,35±5,11 од/л).
Поєднання інсуліну з метформіном у більшості хворих переноситься задовільно. На початку лікування лише у трьох хворих виникли побічні реакції з боку травного тракту: нудота, дискомфорт у ділянці шлунку, діарея. Через кілька днів без корекції доз ЛЗ всі ці явища зникли. Позитивним ефектом запропонованої комбінованої терапії є зменшення дози інсуліну вдвічі та покращання клінічного перебігу у хворих 1-ї групи.
Вивчення впливу поєднаної терапії інсуліном із метформіном на вуглеводний, жировий, ліпідний обмін та системне запалення, метаболізм NO, оксидативний стрес дало можливість розробити диференційований підхід до призначення цих ЛЗ. Комбіновану терапію інсуліном із метформіном перш за все слід призначати хворим на ІМ і ЦД 2 типу при виявленні у них вираженої ІР. Інформативними маркерами ІР і ступеня її вираженості є розрахункові індекси HOMA (більше 2,9 ум. од.), McAuley (нижче 6 ум. од.), QUICKI (нижче 0,33 ум. од), рівень імунореактивного інсуліну (більше 10-12 мкОД/мл), індекс ІАО (відношення об’єму талії до об’єму стегон – ОТ/ОС більше 1,0), ІМТ більше 30 кг/м2, а також високий вміст ТГ у крові (вище 2-2,3 ммоль/л) (схема 1).
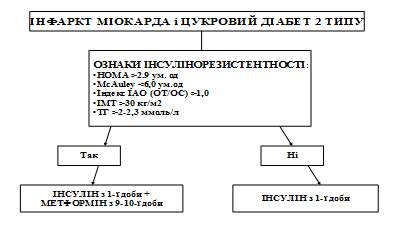
Схема 1. Алгоритм ведення хворих на ІМ і ЦД 2 типу із ІР.
При призначенні метформіну слід врахувати прямі протипоказання до його застосування. Через загрозу виникнення молочнокислого ацидозу метформін з 1-ї доби гострого ІМ не використовувався. В середньому на 9-10-й день виникнення ІМ стан хворих стає стабільним і небезпека розвитку молочнокислого ацидозу зникає. Саме із цього часу є всі підстави додавати до інсуліну ЛЗ із групи бігуанідів – метформін із метою корекції не лише гіперглікемії, але й ІР.
Корекція порушень обміну тригліцеридів у хворих на ІМ і ЦД 2 типу. Одним із завдань дослідження було шляхом поєднаного застосування із симвастатином препаратів щ3-ПНЖК у хворих на ІМ і ЦД 2 типу з помірно порушеною функцією печінки (г-ГТП – 69,78±7,56 од/л), досягти бажаного гіполіпідемічного ефекту у зниженні показників обміну ТГ при використанні нижчих доз симвастатину, запобігти погіршенню її функції. Методом випадкової виборки сформовані дві групи хворих. Основна (1-а група) складалась із 21 особи, які отримували комбіновану фармакотерапію препаратами щ3-ПНЖК (1500 мг на добу) та симвастатином (у середньому 15,2±2,1 мг на добу). Група порівняння (2-а група) – із 22 особи, які приймали лише симвастатин (у середньому 15,6±2,2 мг на добу).
Через три місяці лікування у пацієнтів 1-ї групи спостерігалось достовірне зниження рівня ТГ, порівняно з 2-ю групою. Вкінці терміну фармакотерапії практично однаковий у двох групах початковий рівень ХС ЛПДНГ знизився у 1-й групі на 21,0%, а в 2-й групі – на 12,5% (р<0,05); ТГ – на 25,5% і 14,2% (р<0,05); індекс ТГ/ХС ЛПВГ – 31,8 % і 19,6 % (р<0,05); ХС не-(ЛПВГ) – на 32,3 % і 19,1% (р<0,05); ХМ – на 29,7 % і 16,6 % (р<0,05). Рівень ХС ЛПНГ знизився достовірно у 1-й групі на 24,6 %, у 2-й спостерігалась лише чітка тенденція до його зниження (на 13,7%). Загалом за цим показником через три місяці фармакотерапії не встановлено статистично достовірної міжгрупової відмінності. Ймовірно ліпідознижуюча терапія у пацієнтів з ІМ і ЦД 2 типу повинна бути більш тривалою. Нормальні рівні показників тригліцеридного ліпідного обміну були досягнуті у третини хворих, які приймали симвастатин (2-а група), та в половини пацієнтів, які отримували комбіновану гіполіпідемічну терапію (1-а група). У решти хворих обох груп показники ліпідного спектру крові мали чітку тенденцію до покращення.
У результаті трьохмісячного курсу фармакотерапії симвастатином у поєднанні з щ3-ПНЖК у хворих після перенесеного ІМ з помірним порушенням функції печінки (1-а група) відбулось достовірне зниження вмісту г-ГТП у крові з 69,46±10,24 од/л до 36,27±4,09 од/л, р<0,05. У хворих 2-ї групи, які впродовж трьох місяців отримували симвастатин, показник функціонального стану печінки – г-ГТП в середньому зменшився незначно, лише на 9% (з 70,64±10,16 од/л до 64,27±4,09 од/л), і практично не відрізнявся від початкового рівня.
У групі хворих, які крім симвастатину одержували препарати щ3-ПНЖК значно покращились результати тримісячної реабілітації у порівнянні з монотерапією статином, істотніше покращилось загальне самопочуття та толерантність до навантаження.
Для з’ясування предикторів підвищеного ризику виникнення ускладнень на стаціонарному етапі лікування хворих на гострий ІМ із супутнім ЦД 2 типу проведено аналіз бази даних у вибірці із 223 пацієнтів. Монофакторний аналіз якісних, рангових і параметричних характеристик дав можливість виділити низку предикторів, які достовірно (р<0,05) пов’язані із погіршенням прогнозу і розвитком ускладненого перебігу ІМ. Визначали міру інформативності Кульбака – показник, який дає змогу кількісно оцінити інформативність кожного критерію. Для кількісних характеристик було визначено порогові точки, при поділі за якими інформативність була найвища. Для виявлених предикторів виникнення ускладнень ІМ було також визначено відносний ризик (ВР – RR).
На основі проведеного однофакторного аналізу (рис. 3) з використанням міри інформативності Кульбака і показника ВР виникнення подій встановлено, що у хворих на ІМ і ЦД 2 типу важливим прогностичним фактором виникнення ускладнення, були: індекси ІР – MсAuley (<7 ум.од) і HOMA (≥3 ум.од), рівень ЦП у крові (≥500 мг/л), креатинін (>0,14 ммоль/л), сечовина (≥8 ммоль/л), дилатація лівого передсердя (>4 см), ФВ (<45%). Дещо менший, але також статистично достовірний вплив на прогноз мали вік (>55 років), важкість АГ (2-3 ступінь), тривалість АГ (>6 років), рівень інсуліну (>9 мклОД/мл ), а-, дискінезія ЛШ, приналежність до жіночої статі.
ВР(95% ДІ)
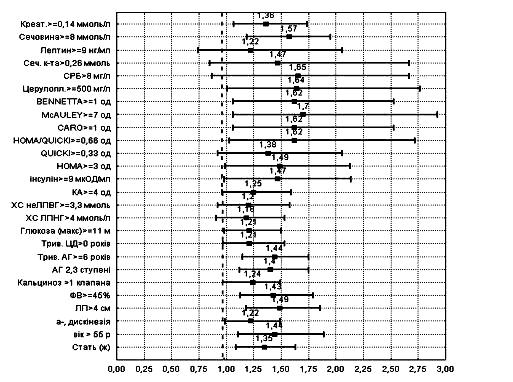
краще гірше
Рис. 3. Відносний ризик виникнення ускладнень ІМ, поєднаного із ЦД 2 типу.
Характеристики, які при монофакторному аналізі засвідчили статистично значущий зв’язок із виникненням ускладнень ІМ у хворих на ЦД 2 типу, було включено у багатофакторний покроковий дискримінантний аналіз. У результаті створено модель, яка включала 5 незалежних значущих предикторів щодо передбачення ускладненого перебігу ІМ. До цих факторів належали: рівень креатиніну (порогове значення >0,14 ммоль/л), вміст ЦП (>500 мг/л), індекс MсAuley (<7,0 ум.од), ФВ (<45%), вік більше 55 років. Чутливість цієї моделі сягає 83,3%, специфічність – 85,7%, загальна точність – 84,4%. Важливо, що 4 із 5-ти наведених предикторів можна цілеспрямовано корегувати і, тим самим, профілактично попереджувати виникнення ускладнень ІМ.
Результати проведеного однофакторного аналізу і показника ВР виникнення подій (рис. 4) засвідчили, що найбільш значущими прогностичними факторами розвитку застійної СН у хворих на ІМ із супутнім ЦД 2 типу є: креатинін(>0,13 ммоль/л); СРБ (>8 мг/л); г-ГТП (>50 од/л); ФВ (<40%); максимальний рівень глюкози (>15,0 ммоль/л); ФНП-б (>60 пг/мл); вік понад 55 років. Крім того, дещо менший, але також достовірний вплив на прогноз мають НвА1С, тривалість ЦД, Total NO, дискінезія ЛШ та приналежність до жіночої статі.
ВР(95% ДІ)
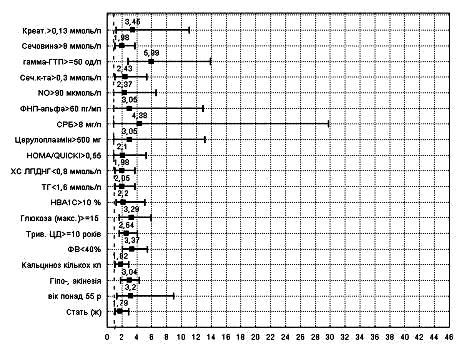
Рис. 4. Відносний ризик виникнення застійної СН у хворих на ІМ і ЦД 2 типу.
Проведений багатофакторний аналіз дозволив створити модель розвитку застійної СН, що включає 5 предикторів (вік понад 55 років, максимальний рівень глюкози понад 15 ммоль/л, тривалість ЦД понад 10 років, ФВ менша 40% та рівень креатиніну понад 0,13 ммоль/л) із передбачуваною точністю моделі 90,2%.
Предиктори розвитку постінфарктної стенокардії були іншими, ніж у загальній моделі прогнозування ускладнень ІМ та у моделі прогнозування застійної СН. Міра інформативності Кульбака прогностичних предикторів для постінфарктної стенокардії, подібно до моделі прогнозування застійної СН, була значно вищою від загальної моделі прогнозу ускладнень.
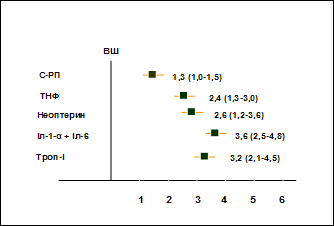
Найвагомішим предиктором виникнення ранньої постінфарктної стенокардії виявилась ІР, а саме показники, що її характеризують: індекс HOMA більше 4 ум.од (міра інформативності (МІ) Кульбака 2,5, р<0,001); індекс McAuley нижче 6 ум. од (МІ 2,06, р<0,05); рівень інсуліну у крові більше 10 мкОД/мл (МІ 1,32, р<0,0001). У модель також були вибрані наступні критерії: наявність АГ (МІ 0,42, p<0,05) та її тривалість більше 5 років (МІ 0,58, р<0,01), основні показники оксидативного стресу – МДА більше 5 нмоль/мл (МІ 1,68, р<0,0001), ЦП вище 500 мг/л (МІ 1,41, p<0,05) та холестеринвмісні показники – (ХС не-(ЛПВГ) більше 6 ммоль/л (МІ 1,33, р<0,001), ХС ЛПНГ більше 3 ммоль/л (МІ 0,57, р<0,01), ЗХС більше 5 ммоль/л (МІ 0,57, р<0,05)).
На основі проведеного нами одновимірного аналізу з використанням міри інформативності Кульбака і показника ВР (рис. 5) встановлено, що найбільш значущими предикторами ризику виникнення ранньої постінфарктної стенокардії у хворих на ІМ і ЦД 2 типу є 4 предиктори (рівень інсуліну більше 10 мкОД/мл, індекс HOMA більше 4 ум.од, вміст МДА більше 5,0 нмоль/мл та ХС ЛПНГ більше 3 ммоль/л).
ВР(95% ДІ)
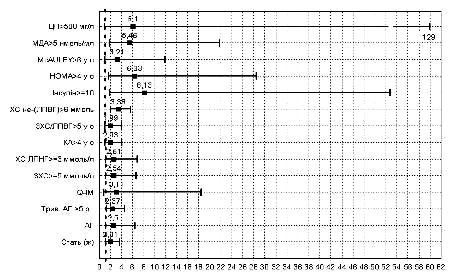
Рис. 5. Відносний ризик виникнення ранньої постінфарктної стенокардії у хворих на ІМ і ЦД 2 типу.
ВИСНОВКИ
На основі комплексного клінічного дослідження вирішено актуальну наукову проблему кардіології – з’ясовано особливості патогенезу (порушення ліпідного, вуглеводного, жирового, пуринового обміну, оксидативного стресу, системного запалення, метаболізму оксиду азоту), клінічного перебігу ІМ у хворих на ЦД 2 типу, і на цій підставі вдосконалено методи діагностики, лікування та прогнозування ускладнень.
1. У 43,6% хворих на ІМ вперше виявляється підвищений рівень глюкози у крові. Тест на вміст у крові глікозильованого гемоглобіну у першу добу ІМ дозволяє віддиференціювати «стресову» гіперглікемію від вперше виявлених ЦД 2 типу або порушення толерантності до глюкози за наступними критеріями: при рівні глікозильованого гемоглобіну нижче 7,0% діагноз ЦД 2 типу відсутній; підвищення рівня глікозильованого гемоглобіну понад 7,0% свідчить про наявність ЦД 2 типу або порушення толерантності до глюкози.
2. У 80% пацієнтів на гострий ІМ із супутнім ЦД 2 типу реєструються проатерогенні зміни показників ліпідного обміну: підвищений вміст у крові ЗХС, ЛПНГ, ТГ, ХС не-(ЛПВГ), апо-В та зниження – ХС ЛПВГ, апо-А, що достовірно частіше, ніж в осіб без ЦД. Виявлені зміни ліпідного спектру крові більш характерні для хворих середнього й похилого віку, а також вираженіші у жінок. Передінфарктна гіперглікемія та артеріальна гіпертензія асоціюються з вираженими атерогенними змінами ліпідного обміну.
3. Інсулінорезистентність (індекс HOMA більше 2,9 ум.од) констатована у 48,8% хворих на ІМ із супутнім ЦД 2 типу, пов’язана з більшою ймовірністю ускладненого перебігу ІМ, що проявляється післяінфарктною стенокардією та резистентною до корекції артеріальною гіпертензією. У всіх хворих інсулінорезистентність корелює з показниками системного запалення, метаболізму оксиду азоту, атерогенними змінами ліпідного спектру крові, оксидативного стресу та лептинового обміну, артеріальною гіпертензію.
4. У хворих із низьким рівнем лептину вираженість діабетичної дисліпідемії, системного запалення, метаболізму оксиду азоту, інсулінорезистентності достовірно вища, порівняно з особами з високим рівнем лептинемії.
5. Підвищення загального NO в плазмі крові (вище 90 мкмоль/л) у першу добу ІМ із супутнім ЦД 2 типу є маркером ризику розвитку застійної серцевої недостатності. Рівень NO прямо корелює з порушеннями вуглеводного обміну (рівнем глікемії, глікозильованого гемоглобіну, індексом інсулінорезистентності HOMA), ліпідного спектру крові (показниками ЗХС, ХС ЛПНГ, апо-В), перекисного окислення ліпідів (концентрацією МДА), системного запалення (СРБ, ФНП-б), що свідчить про тісний взаємозв’язок системи генерації NO із метаболічними порушеннями, активністю системного запалення та оксидативним стресом. Встановлено більш інтенсивні зміни порушення метаболізму NO в осіб старше 60 років, а також у пацієнтів із переднім ІМ, передінфарктною гіперглікемією (рівень глікозильованого гемоглобіну понад 8,0%).
6. У всіх пацієнтів на ІМ, поєднаний із ЦД 2 типу, показники системного запалення в сироватці крові значно підвищені, зокрема, СРБ – у 2,3 рази, ФНП-б – у 36,4 рази, ІЛ-4 – у 2,2 рази, ЗФ – у 1,6 разів. Рівні СРБ та ФНП-б були достовірно вищі у групі хворих на ІМ і ЦД 2 типу, порівняно з особами без ЦД, але найбільші – у пацієнтів із інсулінорезистентністю.
7. У всіх хворих на ІМ та ЦД 2 типу виявлено високі рівні показників оксидативного стресу. Більш виражена активація процесів ліпопероксидації відзначена у пацієнтів із супутньою артеріальною гіпертензією, інсулінорезистентністю, порушеннями вуглеводного обміну (рівень глікозильованого гемоглобіну понад 8%) та гострою серцевою недостатністю (ІІ-ІII клас за Killip). Встановлено, що збільшення рівня церулоплазміну понад 500 мг/л у крові є маркером ускладненого перебігу ІМ (застійної серцевої недостатності, аритмій, повної атріовентрикулярної блокади тощо), вмісту МДА крові понад 5 нмоль/мл – ранньої постінфарктної стенокардії.
8. У хворих на ІМ супутній ЦД 2 типу виявляється у 15,1 % випадків, причому у жінок – у 1,7 рази частіше, ніж у чоловіків (відповідно у 20,1% і 12,1%). У віці 45-60 років частка чоловіків з ІМ і ЦД 2 типу у 2 рази більша, ніж жінок. У 61 – 75 років – навпаки, жінок більше ніж чоловіків у 1,4 рази, в старечому – вдвічі. У жінок із ЦД, порівняно із чоловіками, ІМ частіше виникає на тлі постінфарктного кардіофіброзу, стенокардії напруги, артеріальної гіпертензії та абдомінального ожиріння.
9. У 56,7% пацієнтів із ЦД 2 типу в період маніфестації ІМ спостерігається поєднання класичного ангінозного і вираженого астматичного приступів. У 23,3% – початок захворювання атиповий із переважанням астматичного, малосимтомного, безбольового варіанту, що є причиною часто запізнілої госпіталізації та збільшення маси ураженого міокарда. За наявності ЦД частота розвитку повторних ІМ значно вища, а перебіг – гірший. Достовірно частіше, ніж у пацієнтів без ЦД, розвиваються: гостра та прогресуюча серцева недостатність, гостра аневризма та тромби у лівому шлуночку, плевральний випіт та гідроперикард.
10. Інсулін у комбінації із метформіном у хворих на ІМ і ЦД 2 типу із інсулінорезистентністю доцільно призначати з 9-10 доби їх перебування в стаціонарі, що сприяє ефективнішій корекції порушень вуглеводного, ліпідного обміну та оксидативного стресу, ніж застосування лише інсуліну.
11. Поєднане застосування симвастатину у дозі 10-20 мг із препаратом щ3-ПНЖК (1500 мг/добу) протягом трьох місяців, порівняно з монотерапією симвастатину, інтенсивніше знижує рівні основних показників обміну тригліцеридів у хворих на ІМ і ЦД 2 типу із підвищеним рівнем останніх або гіпертригліцеридемією, значно покращує результати постінфарктної реабілітації хворих при збереженні функціонального стану печінки.
12. Ризик ускладненого перебігу ІМ, поєднаного із ЦД 2 типу, з точністю до 85% (чутливість – 83,3%, специфічність – 85,7%) визначають рівень креатиніну >0,14 ммоль/л, церулоплазміну >500 мг/л, індекс інсулінорезистентності MсAuley <7,0 ум.од., ФВ <45%, вік >55 років; застійної СН – вік понад 55 років, глюкоземія понад 15 ммоль/л, гіперкреатинемія понад 0,13 ммоль/л, тривалість ЦД більше 10 років, ФВ менше 40%; постінфарктної стенокардії – рівень інсуліну >10 мкОД/мл, індекс HOMA >4 ум.од, вміст МДА >5,0 нмоль/мл та ХС ЛПНГ >3 ммоль/л.
ПРАКТИЧНІ РЕКОМЕНДАЦІЇ
1. У першу добу ІМ при наявності гіперглікемії доцільно визначати вміст НвА1С – тест ретроспективної оцінки середнього рівня глікемії протягом останніх 2–3-х місяців. При рівні НвА1С вище 7,0% у хворого констатують ЦД 2 типу або ПТГ, нижче 7,0% – «стресову» гіперглікемію. В осіб із ЦД 2 типу рівень НвА1С дозволяє оцінити ступінь його передінфарктної компенсації та ефективність попередньої терапії.
2. Хворим на ІМ із супутнім ЦД 2 типу рекомендовано визначати індекс ХС ЛПНГЧТГ, що є критерієм порушень одночасно і холестеринового, і тригліцеридного обміну. Величина індексу менше 4,3 од свідчить про ефективність медикаментозної корекції дисліпідемії.
3. Для прогнозування та запобігання ускладненого перебігу ІМ у пацієнтів із супутнім ЦД пропонується використовувати багатофакторну статистичну модель із врахуванням п’яти основних чинників (рівень креатиніну понад 0,14 ммоль/л, вміст ЦП більше 500 мг/л, індекс інсулінорезистентності McAuley нижче 7,0 ум од, ФВ менше 45%, вік понад 55 років); застійної СН – п’яти чинників (вік понад 55 років, максимальний рівень глюкози більше 15 ммоль/л та креатиніну більше 0,13 ммоль/л, тривалість ЦД понад 10 років, ФВ менше 40%,); постінфарктної стенокардії – чотирьох чинників (рівень інсуліну більше 10 мкОД/мл, індекс HOMA більше 4 ум од, вміст МДА більше 5,0 нмоль/мл , ХС ЛПНГ більше 3 ммоль/л).
4. Для корекції вуглеводного обміну хворим на ІМ і ЦД 2 типу із інсулінорезистентністю рекомендовано призначати комбіновану терапію інсуліном короткої дії підшкірно (3–4 рази на добу з 1-ї доби) із метформіном (з 9–10 дня у початковій дозі 500 мг 2 рази на добу (в обід і ввечір), у подальшому дозу останнього слід поступово впродовж 2–3 днів підвищувати до підтримуючої 2000 мг на добу у 2 приймання). Показання до такої фармакотерапії є рівень одного із наступних індексів інсулінорезистентності: HOMA – більше 2,9 ум од, MсAuley – менше 6,0 ум од; вміст ТГ у крові – вище 2-2,3 ммоль/л, а також індекс ІАО (відношення об’єму талії до об’єму стегон ) – більше 1,0 од та ожиріння – ІМТ більше 30 кг/м2.
5. Для корекції підвищеного рівня ТГ (понад >1,7 ммоль/л) у хворих на ІМ і ЦД 2 типу з нормальною і порушеною функцією печінки рекомендовано застосовувати препарати щ3-ПНЖК (епадол 1500 мг – 1 капсула (500 мг) 3 рази на добу) у поєднанні зі статинами (симвастатин 10-20 мг) з 1-ї доби впродовж не менше 3-х місяців. Порівняно з монотерапією симвастатином, комбінована фармакотерапія більш суттєво покращує показники тригліцеридного обміну, результати постінфарктної реабілітації та не погіршує функціональний стан печінки.
СПИСОК ОПУБЛІКОВАНИХ ПРАЦЬ ЗА ТЕМОЮ ДИСЕРТАЦІЇ
1. Вітенко І.С., Заремба Є.Х., Соломенчук Т.М., Скибчик В.А., Зачик Л.М. Сімейна медицина та її роль у профілактиці ішемічної хвороби серця / Лікарська справа. – 2002. – №2. – С. 126-130 (Здобувач взяв участь у формулюванні основних положень роботи та підготовці до друку).
2. Зербіно Д.Д., Соломенчук Т.М., Скибчик В.А. Коронарна хвороба серця та інфаркт міокарда у хворих молодого віку: роль ксенобіотиків (факти, гіпотези, коментарі) // Український кардіологічний журнал. – 2003. – №1. – С. 14-21 (Здобувач провів аналіз й узагальнення даних літератури).
3. Заремба Є.Х., Соломенчук Т.М., Кияк Ю.Г., Скибчик В.А., Топілко О.Ю. Основні напрямки профілактики серцево-судинних захворювань у роботі сімейного лікаря // Сімейна медицина. – 2003. – № 1-2 (6). – С.122-128 (Здобувач – співавтор ідеї статті, опрацював її основні положення).
4. Нетяженко В., Скибчик В., Соломенчук Т., Барна О. Проблеми атеросклерозу: роль діабетичної дисліпідемії // Ліки України. – 2003. – № 9. – С. 4-8 (Здобувач – співавтор ідеї статті, опрацював її основні положення cформулював висновки).
5. Нетяженко В., Барна О., Скибчик В., Соломенчук Т. Атеросклероз при цукровому діабеті ІІ типу: стратегія лікування дисліпідемій // Ліки України. – 2003. – № 10. – С. 4-10 (Здобувач – співавтор ідеї статті, опрацював її основні положення, провів клінічні дослідження, узагальнення отриманих результатів, сформулював висновки).
6. Скибчик В.А., Соломенчук Т.М. Інфаркт міокарда із супутнім цукровим діабетом 2 типу: статеві особливості предикторів виникнення, клінічного перебігу та причин смерті // Клінічна ендокринологія та ендокринна хірургія. – 2004. – № 1. – С. 45-51 (Здобувач провів клінічні дослідження, узагальнення отриманих результатів, сформулював висновки).
7. Скибчик В.А., Соломенчук Т.М. Особливості перебігу інфаркту міокарда у хворих на цукровий діабет ІІ типу залежно від статі та віку // Український медичний часопис. – 2004. – № 2. – С. 115-118 (Здобувач провів клінічні дослідження, узагальнення отриманих результатів, сформулював висновки).
8. Скибчик В.А., Соломенчук Т.М. Діагностична цінність тесту на глюкозильований гемоглобін у хворих з гіперглікемією в гострий період інфаркту міокарда // Практична медицина. – 2004. – № 2. – С. 34-37 (Здобувач провів клінічні дослідження, узагальнення отриманих результатів, сформулював висновки).
9. Соломенчук Т.М., Скибчик В.А. Динаміка розподілу стаціонарних хворих на гострий інфаркт міокарда за віком, статтю і професійною належністю за період з 1985 до 1999 р. // Серце і судини. – 2004. – № 2. – С. 84-88 (Здобувач взяв участь в аналізі даних літератури, формулюванні висновків).
10. Скибчик В.А. Соломенчук Т.М. Корекція дисліпідемії симвастатином та омега-3 у хворих на гострий інфаркт міокарда з порушеннями функції печінки // Кровообіг та гемостаз. – 2004. – № 2-3. – С. 91-95 (Здобувач здійснив збір первинного матеріалу, аналіз та узагальнення результатів).
11. Скибчик В.А. Соломенчук Т.М. Бета-адреноблокатори в лікуванні серцево-судинної патології у хворих на цукровий діабет: більше «за», ніж «проти»// Серце і судини.– 2004.– № 4.– С. 79-86 (Здобувач провів огляд даних літератури, клінічні дослідження, узагальнення отриманих результатів, сформулював висновки).
12. Зербіно Д.Д., Соломенчук Т.М., Скибчик В.А. Інфаркт міокарда у хворих молодого віку: предиктори і особливості перебігу // Український кардіологічний журнал. – 2004. – № 4. – С. 89-94 (Здобувач взяв участь в аналізі даних літератури, формулюванні висновків).
13. Скибчик В.А., Соломенчук Т.М. Поєднане застосування препарату поліненасичених жирних кислот щ–3 та симвастатину – засіб ефективної корекції дисліпідемії у хворих на гострий інфаркт міокарда з помірно порушеною функцією печінки // Ліки України. – 2004. – № 11. – С. 104-106 (Здобувач і співавтор в рівних частках є учасниками досліджень, та узагальненні їх результатів).
14. Заремба Є.Х., Соломенчук Т.М., Топілко О.Ю., Скибчик В.А., Заремба-Федчишин О.В. Організація і оцінка ефективності диспансерного спостереження мешканців дільниці сімейного лікаря при патології серцево-судинної системи // Науковий вісник Ужгородського університету, серія «Медицина». – 2004. – Вип. 23. – С. 206-208 (Здобувач взяв участь в аналізі даних літератури, формулюванні висновків).
15. Скибчик В.А., Соломенчук Т.М. Діабетична дисліпідемія: критерії діагностики і сучасна стратегія лікування // Український медичний часопис. – 2005. – № 1. – С. 26-33 (Здобувач провів огляд, аналіз та узагальнення даних літератури, представив власні результати, сформулював висновки).
16. Скибчик В.А., Соломенчук Т.М. Вперше виявлений цукровий діабет ІІ типу у хворих в гострий період інфаркту міокарда: діагностична цінність тесту на глікозильований гемоглобін // Український медичний часопис. – 2005. – № 2. – С. 41-44 (Здобувач провів клінічні дослідження, узагальнення отриманих результатів, сформулював висновки).
17. Скибчик В.А., Соломенчук Т.М. Омега-3 як засіб корекції помірної гіперліпідемії у хворих, які перенесли гострий інфаркт міокарда // Сімейна медицина. – 2005. – № 2. – С. 83-85 (Здобувач і співавтор в рівних частках є співавторами ідеї, учасниками досліджень та узагальненні їх результатів).
18. Скибчик В.А., Соломенчук Т.М. Побічні ефекти бета-адреноблокаторів у хворих на цукровий діабет: міфи і реальність // Серце і судини.– 2005. – № 2. – С. 97-101 (Здобувач провів огляд, аналіз та узагальнення даних літератури, сформулював висновки).
19. Скибчик В.А., Соломенчук Т.М. Глікозильований гемоглобін – маркер прогресування діабетичної дисліпідемії та ускладнень у пацієнтів із гострим інфарктом міокарда та цукровим діабетом 2-го типу // Український медичний часопис. – 2005. – № 4. – С. 66-69 (Здобувач провів клінічні дослідження, узагальнення отриманих результатів, сформулював висновки).
Похожие работы
... та експериментальна патологія. – 2007. – Т.VІ, №1. – С. 106-108. (Дисертант брала участь в клінічних дослідженнях, аналізі та узагальненні результатів). 13. Ілащук Т.О. Корвітин у лікуванні пацієнтів із гострим інфарктом міокарда, ускладненим гострою лівошлуночковою недостатністю // Буковинський медичний вісник. – 2007. – Т. 11, №2. – С. 48-50. 14. Патент на корисну модель 25242 А61Р 9/00 Спос ...
... на одній із сторін, в залежності від положення голови, наявності сколіозної дуги і нахилу тазу. Розділ 2 Особливості фізичної реабілітації при захворюванні невриту лицьового нерва 2.1 Адаптаційні можливості організму людини до занять фізичною культурою Фізична культура - єдиний засіб для оздоровлення організму і позбавитись хронічних захворювань. ЛФК– складова частина медичної реабілітації ...
... і працівники. Дослідження проводилося в невеликих групах по 5 – 10 осіб, в 5 етапів. Кожна наступна методика проводилась в усіх групах з інтервалом у 5 днів. 3.2 Психологічні характерситики досліджених хворих соматичного профілю: гіпертонічнa хворобa, виразковa хворобa шлунку і 12-палої кишки, ішемічнa хворобa серця Андрій Сергійович. Чоловік 32 років із середньою фаховою освітою. Одружений ...
0 комментариев