Навигация
2 Гонорея
Гонорея – венерическое заболевание, передаваемое в основном при интимных контактах, вызываемое гонококком.
Морфология, устойчивость и культуральные свойства гонококковВозбудитель грамотрицательный диплококк, адсорбирующийся на поверхности эпителиальных клеток, способный проникать в межклеточные щели с образованием микроколоний, защищенных от воздействия антител и клеточных факторов иммунитета. Характерно внутриклеточное расположение возбудителей в сегментоядерных лейкоцитах на всех стадиях процесса, особенно при обильном гнойном отделяемом. Эндоцитобиоз – внутриклеточная персистенция гонококков позволяет оставаться недоступными действию антибиотиков. В организме больных гонококки претерпевают L‑трансформацию после применения химиотерапевтических средств или при хроническом течении заболевания.
На ультратонких срезах у гонококков выявляются клеточная стенка, цитоплазматическая мембрана, цитоплазма с множественными рибосомами, многочисленными полирибосомами, лизосомами и нуклеоид с нитями ДНК. На поверхности гонококков выявляются тонкие трубчатые нити – пили. Им приписывают способность гонококков передавать генетические свойства, в частности, устойчивость к антибиотикам, способность прилипать к клеткам эпителия хозяина и ряд других биологических особенностей. С пилями, по-видимому, связан механизм передачи генетической информации к способности переноса плазмид и β-лактамазопродуцирующих штаммов гонококков. Устойчивость β-лактамазопродуцирующих гонококков к антибиотикам обусловлена полиантибиотикорезистентностью, и такими адаптационными механизмами как L-трансформация, образование спороподобных форм и др.. Помимо штаммов, образующих β-лактамазопродуцируюших клонов гонококков, существуют штаммы трансформирующиеся в L-формы. Для начальной стадии L-трансформации характерен множественный нуклеоид с последующим истончением наружной стенки, потерей ее структуры и фестончатости. L-трансформация может происходить спонтанно или при действии антибиотиков. После прекращения действия препарата, вызвавшего образование L-форм, наступает реверсия. При L‑трансформации между наружной стенкой и цитоплазматической мембраной образуются элементарные тельца – округлые образования разной величины, из которых образуются типичные гонококки. Именно биологическое свойство образовывать нестабильные варианты L-форм рассматривается как одна из наиболее частых причин рецидивов болезни. Отдельные штаммы гонококков вырабатывают фермент пенициллиназу, что объясняет их устойчивость к пенициллину и его дериватам.
2.2 Формы гонорейной инфекцииПатологический процесс чаще ограничивается местом первоначального внедрения возбудителя. В связи с этим принято различать гонорею:
· мочеполовых органов (генитальная),
· экстрагенитальную (гонорея прямой кишки, глотки, рта, миндалин, глаз)
· метастатическую (диссеминированная), являющуюся осложнением двух первых.
2.3 Диагностика гонококковой инфекцииВ диагностике гонореи решающее значение имеют лабораторные данные. Этиологическая диагностика проводится с использованием бактериоскопических и бактериологических методов. Если в препарате при бактериоскопии обнаружены типичные гонококки, то культуральное исследование не проводится. Топическая диагностика применяется обязательно для точного определения локализации воспалительного процесса в уретре с помощью двухстаканной пробы. Более точная топическая диагностика осуществляется методом уретроскопии, но этот способ исследования рекомендуется применять только при хронической форме процесса, так как при острой форме данная процедура может способствовать распространению инфекции в вышележащие отделы мочеполовой системы.
Методы лабораторной диагностики гонококковой инфекции:
· микроскопические (бактериоскопические),
· культуральные (бактериологические).
· молекулярно-биологические.
2.3.1 Микроскопические методы исследованияВ случае если нефиксированный препарат доставляется в лабораторию: препарат фиксируют 960 спиртом или трехкратным проведением стекла через пламя горелки.
Хранение мазков:
Фиксированные препараты можно хранить при комнатной температуре в течение нескольких дней.
A.Окраска метиленовым синим:Окраска метиленовым синим является ориентировочной и позволяет оценить морфологию и расположение микроорганизмов в мазке. Можно использовать водный или спиртовой растворы метиленового синего. Использование спиртового раствора позволяет сократить время фиксации препарата, не снижал качества окраски.
B. Окраска по методу Грама:При окраске по методу Грама в препарате выявляются тинкториальные свойства бактерий. В зависимости от химической структуры клеточной стенки (наличие или отсутствие тейхоевых кислот) бактерии либо обладают способностью удерживать комплекс кристаллического фиолетового с йодом и устойчивы к обесцвечиванию спиртом (грамположительные), либо нет (грамотрицательные).
C. Микроскопия окрашенных препаратов.При проведении микроскопического исследования последовательно оцениваются препараты, окрашенные двумя способами: метиленовым синим и по Граму. Нельзя выносить заключение по результатам просмотра лишь одного препарата.
Окраска метиленовым синим позволяет сделать заключение о наличии воспаления и выявлении морфотипа бактерий. При окраске по Граму возможно выявление грамотрицательных диплококков. При микроскопии препаратов врачом-лаборантом оценивается наличие эпителия, количество лейкоцитов, эритроцитов, морфотип бактерий (лактобациллы, кокки, коккобациллы), наличие вне- и внутриклеточно расположенных диплококков.
Мазки, окрашенные метиленовым синим или по Граму, оцениваются при двух увеличениях (с применением объективов xl0, х100, т.е. при увеличении соответственно в 100 и 1000 раз). Микроскопическое исследование следует начинать с малого увеличения (х100), позволяющего обнаружить клинический материал на стекле, оценить адекватность взятия из соответствующего анатомического участка, определить наличие «загрязнений» из других анатомических участков, выбрать участок препарата для дальнейшего исследования при большом увеличении (х1000). Микроскопия при большом увеличении позволяет выявить и оценить воспалительную реакцию и наличие микроорганизмов. При увеличении xl000 с иммерсией подсчет лейкоцитов следует проводить в пяти полях зрения. При этом особое внимание следует уделить поиску внутриклеточных диплококков в лейкоцитах.
Диагноз уретрита у мужчин устанавливается на основании обнаружения 4 и более лейкоцитов в поле зрения микроскопа при увеличении xl000. При наличии цервицита количество полиморфно ядерных лейкоцитов повышено (более 10 при увеличении х1000). При клиническом исследовании следует принимать во внимание наличие или отсутствие слизисто-гнойных цервикальных выделений (зеленовато-желтый гной со слизью на белом ватном тампоне).
При исследовании вагинального мазка у женщин нужно помнить о том, что число лейкоцитов зависит от индивидуальных особенностей организма - от дня менструального цикла, наличия внутриматочной спирали и т.д. Поэтому для диагностикки слизисто-гнойного цервицита рекомендуется использовать оба критерия, т.е. наличие клинических проявлений и воспалительный характер цервикального мазка.
Диагноз уретрита у женщин подтверждается нахождением более 10 лейкоцитов в поле зрения при увеличении микроскопах 1000, Следует помнить, что если во влагалище и/или шейке матки имеется патологический воспалительный процесс и при этом наблюдаются выделения из влагалища, уретральный мазок всегда загрязнён материалом этих выделений (клетки плоского эпителия, лейкоциты, вагинальная микрофлора) и не годится для дальнейшей оценки, поскольку он не имеет ничего общего с уретрой.
D.Оценка результатов микроскопии окрашенных мазков.На основании микроскопического исследования диагноз гонореи устанавливается по трем признакам гонококка:
· его форме;
· расположению;
· окраске.
Если же отсутствует хотя бы один из них, требуется культуральное исследование.
Решающее значение при микроскопической диагностике гонореи имеет учет расположения диплококков. Гонококки в основном располагаются внутри лейкоцитов и эпителиальных клеток. На основании обнаружения диплококков, расположенных вне клеток, микроскопический диагноз гонореи не ставится, требуется культуральное исследование.
Окраска гонококков (по методу Грама) - красно розовая (грамотрицательный диплококк). При этом ядра лейкоцитов и эпителиальных клеток окрашиваются т фиолетовый цвет.
Оценка мазков, окрашенных метиленовым синим
При микроскопии препарата видны:
· ядра клеток, окрашенные в синий цвет;
· цитоплазма, окрашенная в голубой цвет разной интенсивности;
· бактериальная микрофлора, окрашенная в синий цвет разной интенсивности.
Окраска метиленовым синим является ориентировочной и позволяет оценить морфологию (форму) и расположение микроорганизмов в мазке (внутри лейкоцита и на эпителиальных клетках).
Оценка мазков, окрашенных по Граму
Методика оценки мазка, окрашенного по Граму, принципиально не отличается от методики оценки мазка, окрашенного метиленовым синим. Окраска по Граму позволяет выделять в картине мазка красно-розовые (грамотрицателъные) или сине-фиолетовые (грамположительиые) элементы. Основной целью исследования является выявление грамотрицательных диплококков со специфической морфологией, а также степени выраженности лейкоцитарной реакции.
2.3.2 Культуральное (бактериологическое) исследованиеДополнительно к микроскопии окрашенных мазков бактериологическое исследование на гонорею должно всегда проводиться при обследовании:
· детей, так как у них встречается большое количество непатогенных нейссерий. особенно в полости рта, глотки и гениталиях;
· женщин, так как диагностическая чувствительность микроскопии генитальных мазков женщин низкая;
· пациентов с бессимптомной и экстрагекитальной гонореей (глотки, прямой кишки, конъюнктивы и др.);
· сексуальных контактов пациентов с доказанной гонореей (где при микроскопии не удалось выявить возбудителя);
· пациентов с гонореей после окончания лечения(не раньше 10 дней) и при снятии их с учета;
· с целью окончательной идентификации нейссерий;
· для определения чувствительности нейссерий к антибиотикам;
· в случае если будет проводиться фенотипическая и/или генотипическая диагностика N. gonorrhoeae;
· в случае сексуального насилия, при запросе следственных органов и/или судебно-медицинских экспертов.
Ответ по результатам посева при выделении чистой культуры и её идентификации выдаётся через 5 дней после взятия пробы.
A.Проведение бактериологического анализаПодученный биологический материал необходимо сразу же поместить одновременно на селективную и неселективную питательную среду, поскольку некоторые штаммы гонококков чувствительны к концентрациям ванкомицина и триметоприма, входящих в состав селективной среды.
Культивирование гонококков следует проводить на чашках Петри диаметром 90 мм с количеством среды не менее 20 мл на чашку или 100 мм с количеством среды 26 мл. После приготовления чашек со средой они ставятся в термостат при 36±1°С на 1 час для удаления конденсата (излишней влажности). Пересушивание среды недопустимо, т.к. это отразится на качестве роста гонококков. Перед проведением посева чашки необходимо прогреть в термостате при температуре +36±1°С в течение 30 минут.
Клинический материал от каждого пациента должен засеваться на отдельную чашку Петри. При использовании больших чашек (90 или 100 мм) материал из уретры и цервикального канала у женщин может засеваться на одну чашку Петри в разные ее секторы с соответствующей маркировкой. Материал из уретры мужчин должен засеваться на отдельную чашку.
Взятый материал тампоном наносится на поверхность. Затем стерильной бактериологической петлей материал распределяется по площади поверхности питательной среды штриховыми движениями в 3 - 4 разных на правлениях с целью создания условий для роста отдельно расположенных колоний гонококков. Чашки немедленно помещаются в анаэростат с содержанием СО2 5±2%. влажностью 70%, который ставится в термостат с контролируемой температурой 36±10С. Допускается использование эксикатора, который ставится в термостат с контролируемой температурой 36±10С, в эксикаторе создаются условия повышенного содержания СО2 при помощи свечении газогенерирующих пакетов и влажности. Чашки просматриваются через 18 - 24 часа инкубации, в случае отсутствия роста - через 48 часов:
· При отсутствии признаков роста через 72 часа инкубации наблюдение прекращают.
· При выявлении характерных колоний проводится первичная и видовая идентификация.
B. Идентификация нейссерииПервичная идентификация нейссерии проводится путем:
· визуальной оценки вида колоний,
· окраски материала подозрительных колоний по Граму;
· оксидазного теста.
· Оценка вида колонийТипичные колонии гонококков через 18 - 24 часа инкубации выпуклые прозрачные серо-белого цвета, имеют диаметр 0,5 - 1,0 мм. При дальнейшей инкубации колонии могут увеличиваться в размерах до 3,0 мм и уплощаться. Нередко на одной чашке можно встретить колонии разного вида.
Большие трудности возникают при идеитификации колоний гонококка в посевах из ротоглотки, т.к. при этом часто вырастают менингококки и непатогенные нейссерии, колонии которых сходны с колониями гонококков. Колонии менингококка выглядят голубоватыми, колонии непатогенных нейссерии - беловатыми, а гонококков - бесцветными, слизистыми. Размер, цвет, морфология и консистенция колоний могут варьировать в зависимости от применяемой питательной среды. Идентифицировать возбудителя можно только при определении сахаролитических свойств культур или другими тестами, подтверждающими видовую принадлежность микроорганизма.
· Применение оксидазного тестаОбнаружение оксидазоположительных грамотрицательных диплококков считается достаточным для их идентификации как N. gonorrhoeae при рутинной диагностике. Для определения цитохром-с оксидазы можно использовать один из рекомендованных методов:
· На подозрительную колонию наносится капля оксидазного реагента {тетраметилфенилендиамина, 1%-ный водный раствор). Быстрое изменение цвета реагента, в течение 5 - 10 секунд, на сине-фиолетовый и его сохранение дольше 30 секунд позволяет считать тест положительным. Реагент, используемый в оксидазном тесте, убивает гонококки, поэтому дальнейшая работа с этими колониями будет невозможна.
· Полоска фильтровальной бумаги смачивается несколькими каплями реагента, затем на нее помещается бактериологической петлей материал из подозрительной колонии. Этот способ позволяет сохранить материал на чашке для проведения дальнейших исследований. Высокая чувствительность оксидазного теста не согласуется с его специфичностыо. Оксидазоположительными могут быть и другие бактерии, выделяющие цитохромную оксидазу, поэтому оксидазоположнтельные колонии микроорганизмов обязательно нужно исследовать микроскопически с окраской по Граму.
· Имеются коммерческие диски и полоски, содержащие диметил-р-фенилендиамина гидрохлорид. Платиновой петлей или стерильной стеклянной палочкой испытуемую культуру наносят на диск, предварительно слегка смоченный дистиллированной водой.
Учет результата
Темно-лиловое или синее окрашивание, появляющееся через 10 - 30 секунд, свидетельствует о положительной оксидазной реакции. Отсутствие изменения цвета - об отсутствии данного фермента.
При исследовании мазков, окрашенных по Граму, из культур учитываются морфология, расположение и окраска гонококков. После 18 - 24 часов культивирования гонококки представляют собой скопления грамотрицательных кокков и диплококков, имеющих более компактное расположение микроорганизмов в центре и разреженное и неравномерное распределение по периферии.
Наряду с интенсивно окрашенными в розово-красный цвет кокками встречаются и бледно-окрашенные формы. Более старые культуры (48 часов и более) трудно интерпретировать, т.к. отмечается большое количество полностью лизированных клеток. По мере старения культуры увеличивается полиморфность гонококков.
Для подтверждающей идентификации нейссерий используются тесты:
· изучение ферментативной активности;
· иммунологические тесты (прямая иммунофлюоресценция, коагглютинация);
· молекулярно-биологические методы (ПЦР).
C. Изучение ферментативной активностиФерментативная активность Neis. gonorrеае изучается в реакции окисления сахаров. Реакция может быть ложноположительной из-за контаминации исследуемых культур гонококков другими бактериями и ложноотрицательной при использовании гонококков, культивируемых более 24 часов (вследствие аутолиза микроорганизмов). Для предупреждения этих возможных факторов необходимо выделить чистую культуру гонококков путем пересева типичных колоний на чашки Петри с неселективной средой (шоколадный агар). Инкубация проводится в течение 18 - 24 часов.
Изучение ферментативной активности Neis. gonorrhoeae может проводиться в ростозависимых и ростонезависимых тестах. При проведении ростозависимых тестов сахара и другие субстраты (например, феноловый красный) вводятся непосредственно в питательную среду, на которой осуществляется рост гонококка. Однако в настоящее время эти тесты не могут быть рекомендованы, т.к. широко используемые ростонезависимые тесты дают возможность получить более быстрый (в течение нескольких часов) и специфический результат, позволяя идентифицировать исключительно Neis. gonorrhoeae и исключить другие непатогенные нейссерий. Существуют коммерческие наборы для изучения ферментативной активности Neis. gonorrhoeae.
Оценка проводится по изменению цвета среды: при ферментации сахаров - от красного к желтому (результат положительный). Энзимсубстратные тесты с использованием ферментов (орто-нитрофенил-бета-галактозидаза (ONPG), гамма-глютамил аминопептидаза (GLU-AMP), гидроксипролил аминосинтидаза (PIP), гидроксипролин аминопептидаза (НРА), пролин аминопептидаза (Рго-АР)) предназначены для быстрой дифференциации между N. gonorrhoeae, N. meningitidis, N. tacarnica и некоторыми штаммами N. cinerea и N. Catarrhalis. Результаты теста считаются положительными, если происходит изменение цвета среды - от бесцветного к желтому для ОФГ и от светло-желтого к интенсивно оранжевому для Глю-АП и Про-АЛ. Однако чувствительность и специфичиость этих быстрых энзимсубстратных тестов оказались неоптимальными.
Проведение видовой идентификации возможно также с использованием бактериологических анализаторов и коммерческих наборов реагентов.
D. Иммунологические/антигенные подтверждающие тестыИммунологические тесты рекомендуется использовать только в референс-лабораториях для окончательного подтверждения N. gonorrhoeae.
Иммунологические тесты с использованием моноклональных антител для прямой иммунофлюоресценции (ПИФ), коагглютинации и иммуноферментного анализа являются высокочувствительными и специфичными для точной идентификации N. gonorrhoeae. Эти тесты могут проводиться с культурой нейссерий, выделенных при первичном посеве. При этом не требуется выделение чистой культуры гонококков, и изоляты могут быть идентифицированы на18 - 24 часа раньше, чем при изучении ферментативной активности N. gonorrhoea. Однако эти тесты дороже, чем ферментативные, коммерческие тест системы имеют меньший срок годности.
E. Прямая иммунофлюоресценцияТест основан на использовании флюоресцирующих моноклональных антител против очищенного РroВ белка наружной мембраны гонококка, ранее называвшегося 1 или главный белок наружной мембраны гонококка. Очень важно строгое следование инструкции производителя каждого отдельного теста.
Молекулярно-биологические методыДля выявления N. gonorrhoeae могут быть использованы ДНК/РНК методы, такие как полимеразно цепная реакция (ПЦР), а также методы, основанные на гибридизации. Однако результаты, полученные при использовании этих методов, должны оцениваться в связи с клинической ситуацией, т.к. после проведенного лечения гонореи в некоторых случаях ДНК может определяться в образцах до 2 - 3 недель после лечения.
Однако с целью получения живого микроорганизма и для определения чувствительности к антибиотикам проведение бактериологического исследования является необходимым у пациентов с клинической симптоматикой. В некоторых ситуациях молекулярно-биологические методы являются более чувствительными, чем культурадьный метод. Чувствительность культурального метода во многом определяется качеством питательной среды и условий транспортирования образца в лабораторию. При соблюдении условий транспортировки клинического материала в лабораторию, использовании качественных питательных сред, строгого проведения условий лабораторного исследования бактериаюгнческое исследование является методом выбора, и наоборот. Следовательно, выбор молекулярно-биологического или культурального метода зависит от организационных условий и качества проведения лабораторного исследования, а также от зпидемиологической ситуации в популяции. В популяции с повышенным риском распространения заболевания бактериологическое исследование является методом выбора. В популяции низкого риска, для скрининга и для исследования неинвазивных образцов, молекулярно-биологические методы подходят больше (к примеру, исследование мочи у мужчин и вагинальных образцов у женщин). Однако если метод используется для исследования популяции низкого риска и он не является высоко специфичным, возможно получение большого количества ложноположительных результатов. Молекулярно-биологические методы являются оптимальными для исследования образцов, полученных неинвазивным способом, но их чувствительность и специфичность вариабельны. Чувствительность молекулярно-биологических методов выше при исследовании образцов мочи у мужчин, по сравнению с женскими образцами. Оптимальным для женщин является исследование вагинальных материалов.
При исследовании пациентов без клинических симптомов заболевания молекулярно-биологические методы обязательно должны подтверждаться бактериологическим методом. Пока еще нет лицензированных молекулярно-биологических методов для исследования ректальных или фарингеальных образцов. ДНК/РНК-методы могут быть использованы для видового подтверждения N.gonorrhoeae из культур. Для этой цели материал, собранный петлей из специфической колонки, может быть перенесен в пробирку типа Эппендорф или любую другую пробирку со 100 мкл забуференного физиологического раствора. Однако этот тест не исключает необходимости предварительной идентификации N. gonorrhoeae.
Для проведения молекулярно-биологических методов из клинического образца необходимо выделить ДНК в соответствии с инструкцией изготовителя. Методы предназначаются для обнаружения N. gonorrhoeae в урогенитальных пробах. В большинстве случаев молекулярно-биологические методы имеют высокую чувствительность и специфичность. Однако наличие субстанций ингибиторов в некоторых образцах, а также тот факт, что у некоторых штаммов N. gonorrhoeae может не быть последовательности, являющейся мишенью для молекулярно-биологического метода, может приводить к снижению чувствительности метода. Известна недостаточная специфичность некоторых ДНК/РНК-методов, и получено большое количество ложноположительных результатов из-за перекрестных реакций с комменсальными видами нейссерий. таких как N. lactamlса, N. cinerea. N subjtava. Высокую специфичность показали новые методы ПЦР-анализа. использующие праймеры, направленные на РогА псевдоген N. gonorrhoeae. Этот ген (PorAJ/псевдо-ген подходит для дифференциальной диагностики N. gonorrhoeae и N. meningitides. Для всех экстрагенитальных образцов или для определения антибиотикочувствительности должно проводиться культивирование с последующей идентификацией нейссерий до вида.
A. Проведение анализаВыделение ДНК и проведшие амплификации проводится строго в соответствии с инструкцией производителя диагностических наборов. Необходимо строгое соблюдение инструкций по уборке помещений и обработке поверхностей. После окончания работы рабочие поверхности должны обрабатываться ДНК/РНК деградирующими растворами для удаления ранее амплифицированных нуклеиновых кислот.
B. Интерпретация результатовРазработка и внедрение диагностических методов, основанных на амплификации нуклеиновых кислот, позволяют улучшить диагностику гонореи, так же как и многих других инфекционных болезней. Однако особое внимание следует уделять правильной интерпретации результатов молекулярно-биологических тестов, даже если они имеют хорошие диагностические характеристики. Это особенно важно в случае применения этих методов для скрининга гонореи в популяциях с низкой распространенностью инфекции.
2.3.4 Лабораторные критерии диагноза гонореи;• выделение Neisseria gonorrhoeae из клинического образца;
• выявление антигена или нуклеиновой кисло ты N. gonorrhoeae:
• обнаружение грамотрицательных внутриклеточных диплококков в мазках из уретры мужчин.
3 Лабораторная диагностика урогенитального хламидиоза Морфология, устойчивость и культуральные свойства хламидийХламидии (Chlamydia trachomatis) являются мелкими грамотрицательными микроорганизмами. Хламидии составляют группу облигатных внутриклеточных паразитов, не могут размножаться вне клетки хозяина. Наибольший тропизм хламидии проявляют к клеткам цилиндрического эпителия. Цикл развития хламидии включает две формы существования микроорганизма: элементарные тельца (ЭТ) - мелкие (0,15 – 0,2 мкм) неподвижные сферические организмы и ретикулярные (инициальные) тельца (РТ) - более крупные (около 1 мкм). ЭТ представляет собой высоко инфекционную форму возбудителя, адаптированную к внеклеточному существованию. ЭТ адсорбируется на поверхность эпителиальной клетки при помощи специфического поверхностного термолабильного эффектора, структурно связанного с типоспецифическим хламидийным антигеном и комплементарного клеточному рецептору, содержащему сиаловую кислоту. Последняя разрушается нейраминидазой и ЭТ проникает в клетку. Хламидии не имеют активного механизма проникновения в чувствительную клетку. Проникновение ЭТ осуществляется посредством фагоцитарной активности клеток, при этом происходит ингибирование процесса слияния фагосомы, в которой они находятся, с лизосомами и тем самым “выключают” важнейший защитный клеточный механизм.
В клетке начинается процесс деления ЭТ: увеличивается количество рибосом и полирибосом, визуализируется бактериальный нуклеоид, они увеличиваются в размере, появляются формы бинарного деления, формируется РТ, которое далее распадается на ЭТ. Из одного ЭТ образуется от 200 до 1000 новых “инфекционных единиц”, новых ЭТ. Обычно этот процесс длится 18 - 24 часа. Все это время возбудитель персистирует в фагосоме пораженной клетки. Вновь образовавшиеся ЭТ покидают клетку хозяина при ее разрушении, либо путем экзоцитоза, окруженные тонким ободком цитоплазмы. В последнем случае жизнеспособность клетки сохраняется. Предполагается, что данный механизм высвобождения ЭТ является одним из факторов бессимптомного и латентного течения хламидийной инфекции.
Вновь образовавшиеся ЭТ после выхода из пораженной клетки могут инфицировать новые здоровые клетки, что приводит к прогрессированию инфекционного процесса. Длительность инкубационного периода зависит от состояния организма, инфицирующей дозы, локуса поражения и может составлять в среднем от 14 до 35 дней.
В настоящее время различают по антигенной структуре 15 серотипов патогенных штаммов С. trachomatis. Так называемые “глазные” штаммы по эпидемическим особенностям и клиническим проявлениям хламидийной инфекции отличаются от “генитальных” штаммов. Первые (4 серовара С. trachomatis: А, В, Ва, С) вызывают классическую эндемическую трахому, передаются из глаз больного в глаза здорового контактным путем. Вторые (серовары от D до К) поражают отделы урогенитального тракта и передаются половым путем. Возможно инфицирование глаз “генитальными” штаммами хламидий у взрослых и детей при заносе инфицированного материала руками, полотенцами и другими бытовыми предметами, при купании, особенно в бассейнах, а также у новорожденных во время родов при прохождении через родовые пути инфицированной матери.
С.trachomatis различных серотипов имеют общий групповой, родоспецифический антиген - липополисахаридный комплекс, в состав которого входит 2-кето-3-дезоксиоктановая кислота. Данная антигенная особенность позволяет определять хламидийный антиген группоспецифической сывороткой.
Лабораторная диагностикаДиагноз урогенитального хламидиоза основывается на данных анамнеза, клинической картине и подтверждается результатами лабораторных исследований. Результаты лабораторных исследований в процессе лечения позволяют оценить адекватность проводимой терапии, а по окончанию ее оценить полноту излечения.
Диагностическая значимость результатов лабораторных исследований зависит от следующих факторов:
1. Выбор соответствующего метода лабораторного исследования;
2. Правильная подготовка пациента к исследованию;
3. Правильное взятие врачом-клиницистом биоматериала для исследования из соответствующих очагов поражения;
4. Правильная предварительная подготовка биоматериала и своевременное проведение исследования;
5. Материально-техническое обеспечение лабораторного исследования;
6. Уровень квалификации медицинского персонала, проводящего исследование.
Для диагностики хламидийной инфекции используют 4-е группы методов:
1. Культуральный метод;
2. Цитологический метод;
3. Методы, в основе которых лежат иммунологические реакции;
4. Методы, использующие принципы молекулярной биологии.
3.2.1 Культуральный методКультивирование С. trahomatis на перевиваемых линиях клеток млекопитающих, либо в клетках желточных мешочков куриных эмбрионов с последующей их идентификацией, является самым специфичным и наиболее чувствительным методом лабораторной диагностики хламидиоза. Культуральный метод считается “золотым стандартом”, с которым сравнивают специфичность и чувствительность всех других методов лабораторной диагностики. Для диагностики хламидиоза культуральным методом нужна специальная лаборатория, оборудованная всем необходимым для работы с культурами тканей и перевиваемыми линиями клеток, специально подготовленный высококвалифицированный медперсонал. Метод трудоемкий, требует значительного времени для получения окончательного ответа (от 3 до 14 дней и более при проведении нескольких пассажей). Поэтому до настоящего времени культуральный метод диагностики урогенитального хламидиоза не получил широкого распространения в практической лабораторной диагностике и используется в основном для научных целей, а также для сравнительной оценки специфичности и чувствительности других методов диагностики хламидиоза.
Цитологический методЦитологический метод лабораторной диагностики наиболее простой и доступный. Данный метод дает общее представление о цитологической картине, морфологии клеток из очага поражения, наличии микробного обсеменения, мицелия грибковой флоры и простейших. Специфические морфологические признаки позволяют определить наличие хламидий в препарате.
Препарат фиксируют метиловым спиртом (5 мин), либо 96% этиловым спиртом (5 мин), либо смесью Никифорова (1 часть этилового спирта и 2 части этилового спирта - 5 мин), либо охлажденным безводным ацетоном (3 - 5 мин).
После фиксации высушенные мазки окрашивают по Романовскому-Гимзе или по Маккиавело.
Окраска по Романовскому-Гимзе: краску Романовского-Гимзе разводят в соотношении 1:10 фосфатным буфером с рН 7.2 - 7.6 (1 часть краски и 9 частей фосфатного буфера) и наносят на мазок на 1 - 2 часа, далее препарат промывают под проточной водой, прополаскивают дистиллированной водой, дифференцируют, погружая на 1 - 3 секунды в 96% этиловый спирт, высушивают и микроскопируют с использованием иммерсионной системы при общем увеличении микроскопа в 900 - 1500 раз (ок. 10-15, об. 90-100).
При микроскопии ЭТ хламидий представляют собой мелкие (0.15 - 0.3 мкм) образования округлой формы, окрашенные в розовый или красноватый цвет. Они могут находиться как внеклеточно (преимущественно), так и внутриклеточно. Более крупные РТ (0.5 - 1.5 мкм) окрашиваются в различные оттенки от голубого до темно-синего цвета и находятся внутриклеточно, при микроскопическом исследовании они обнаруживаются в виде скоплений вокруг ядра эпителиальной клетки в форме “шапочки жандарма” или диффузно.
Ядра клеток при данной окраски имеют вишневый оттенок различной интенсивности, а цитоплазма прокрашивается в нежно-голубой цвет.
Окраска по Маккиавелло: мазок-отпечаток на предметном стекле фиксируют над пламенем горелки несколько секунд и далее окрашивают 0.25% раствором основного фуксина в течение 5 минут. Затем краску смывают под проточной водой. Препарат помещают на несколько секунд в 0.5% раствор лимонной кислоты и затем промывают под проточной водой. Последний этап - дополнительное окрашивание 1% раствором метиленового синего в течение 20 - 30 сек, препарат промывают водой, высушивают и микроскопируют с использованием иммерсионной системы при общем увеличении микроскопа в 900 - 1500 раз.
Ядра клеток окрашиваются в бледно-розовый цвет, цитоплазма - в нежно-голубой. РТ (внутриклеточные) окрашиваются в различные оттенки голубого цвета (от светлого до темного), ЭТ имеют красноватый цвет и могут находиться как внутриклеточно, так и внеклеточно (преимущественно).
Цитологические методы просты в выполнении, дешевые, не требуют сложного оборудования, больших временных затрат, специальной подготовки и дополнительных навыков у лаборантов и врачей-лаборантов, владеющих техникой световой микроскопии. Однако их диагностическая значимость очень низкая: у больных мужчин диагностировать хламидийную инфекцию цитологическим методом в соскобах из уретры удается лишь в 10 - 15% случаев, а у женщин - до 30 - 40% случаев (в соскобах из цервикального канала).
В тоже время цитологический метод позволяет выявить неспецифические морфологические изменения эпителиальных клеток, которые могут косвенно свидетельствовать о наличии поражения урогенитального тракта, в том числе и хламидийной этиологии. Нормальные эпителиальные клетки имеют круглое ядро диаметром 10 - 15 мкм, цитоплазма при окраске по Романовскому-Гимзе прокрашивается в голубой цвет, хроматин - в пурпурный. Сама клетка - округлой формы, диаметр ее достигает 20 - 25 мкм. В соскобах у больных с хламидийной урогенитальной инфекцией могут быть следующие морфологические изменения эпителиальных клеток: клетки увеличены в размере, диаметром до 30 мкм и более, цитоплазма их нередко вакуолизирована, может иметь включения различного размера - от 0.3 до 0.5 мкм и более. Иногда можно наблюдать клетки с явлениями фагоцитоза. В клетках происходит изменение морфологии ядра: отмечается полиморфизм, макронуклеоз - увеличение ядра до 15 мкм и более, полинуклеоз (2 и более ядер в клетке). В соскобах также могут встречаться лимфоциты, полиморфноядерные лейкоциты, плазмоциты и мононуклеарные клетки. Выраженность морфологических изменений часто коррелирует с выраженностью патологического процесса.
Описанные клеточные изменения могут служить косвенным признаком хламидийной инфекции. Цитологический метод пригоден для проведения массовых и первичных обследований урологических и гинекологических больных с последующим обследованием их более специфическими и диагностически значимыми методами при получении патологических или сомнительных результатов.
Методы, в основе которых лежат иммунологические реакцииДанная группа методов основана на комплементарном взаимодействии специфического антигена (АГ) с антителом (АТ) с последующим проявлением продукта флюорохромом или посредством цветной биохимической реакции.
При диагностике урогенитального хламидиоза можно определять в биологическом материале либо наличие родоспецифического (группового) антигена (в моче, отделяемом половых органов, в материале из соскоба), либо специфические антихламидийные антитела - иммуноглобулины различных классов: А, М, G - в сыворотке крови. Для этого используют два основных метода: иммуноферментный анализ (ИФА) и реакцию иммунофлюоресценции (РИФ).
A. ИФАИФА известен давно и широко применяется для диагностики в инфекционной патологии. В настоящее время на рынке диагностических тест-систем предлагается большое количество наборов как зарубежных, так и отечественных фирм-производителей. Методом ИФА определяют наличие и титр (либо количество) противохламидийных антител - иммуноглобулинов различных классов в сыворотке крови обследуемого. Хламидии обладают слабой антигенной активностью, вследствие чего выработка и накопление антител в организме происходит в малых количествах. Кровь для исследования следует брать в период ярких клинических проявлений преимущественно системного характера. Сыворотку, полученную после центрифугирования, при необходимости можно хранить при +4 - +8°С до 5 дней, либо при -20°С 1 месяц. Рекомендуется исследовать парные сыворотки для выявления динамики титра антител в процессе течения заболевания и проводимого лечения. Наборы ИФА-метода содержат в своем составе положительный и отрицательный контроли, по соотношению с которыми судят о наличии или отсутствии специфических антител и их количестве в сыворотке крови обследуемого. Методика постановки ИФА приводится в инструкции к каждому конкретному набору и включает этапы:
1. Инкубация соответствующего разведения сыворотки крови обследуемого на планшете (или с шариком в пробирке) сенсибилизированным родоспецифическим хламидийным антигеном для взаимодействия с ним специфических противохламидийных антител (иммуноглобулинов) - образование комплекса антиген-антитело (АГ - АТ);
Похожие работы
... ); - санитарно-просветительская и воспитательная работа среди населения. 2. ГАРДНЕРЕЛЛЕЗ Заболевание относится к группе негоноккоковых поражений урогенитального тракта, передающихся преимущественно половым путём. Заболевание вызывается Gardnella vaginalis. Она представляет собой мелкие грамотрицательные или гамвариабельные палочки, нередко коккобацилы, неподвижные, длиной 1 – 2 мкм, ...
... оболочках пятен, узелков, язвочек, пузырьков и т.д., выпадении волос, изменении цвета кожи. Все это признаки заболеваний, передаваемых половым путем. С течением времени они без лечения могут ослабевать. Однако кажущееся улучшение ни в коей мере не означает, что болезнь прошла, подходящее же время для эффективного лечения оказывается упущенным. Чтобы этого не случилось, нужно придерживаться ...
... 1981 года, когда он был впервые описан, зарегистрировано свыше 10 000 случаев заболевания, и число заболевших быстро возрастает. Заболевание, развившееся до определенной стадии, по-видимому, является фатальным. Возбудитель СПИДа называют вирусом иммунодефицита человека (ВИЧ). Примерно 90 % больных СПИДом в США составляют гомосексуалы или бисексуалы (мужчины), наркоманы, использующие внутривенные ...
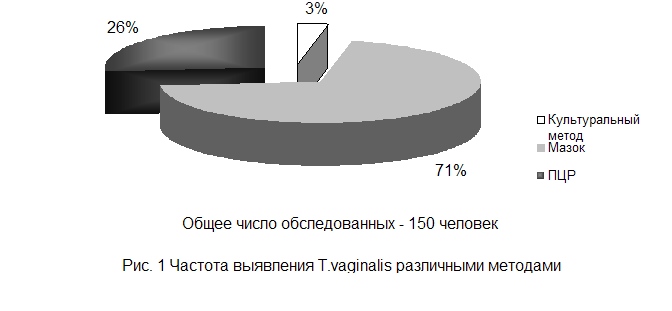
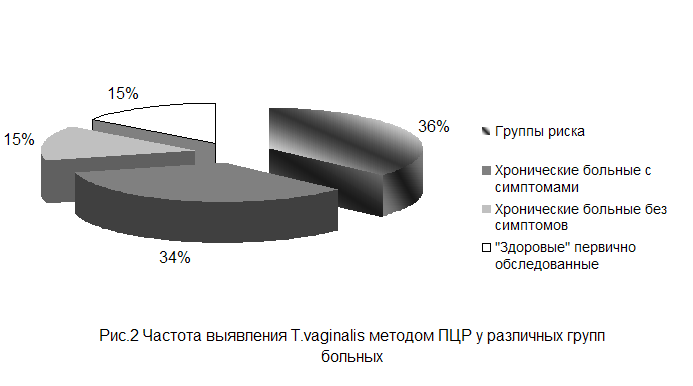
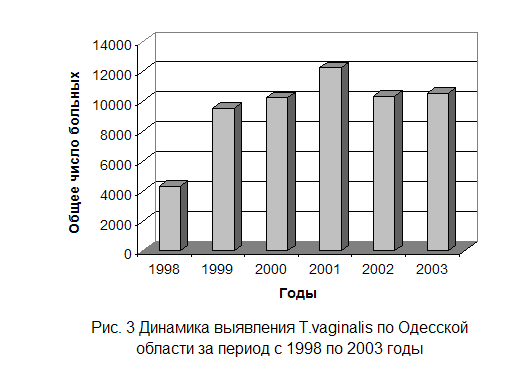
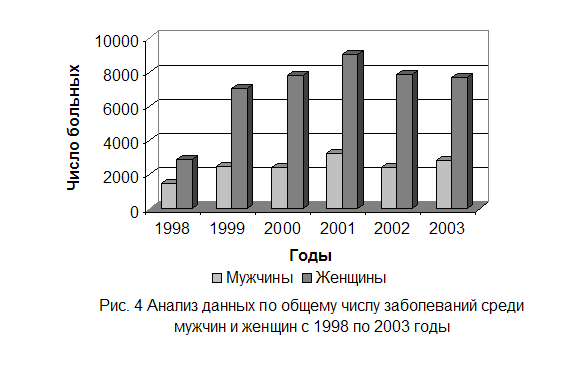
... простатитом, тогда как при острых уретритах обнаруживают мало паразитов - в основном атипичные амебоидные формы[7,10,14,15,19]. 1.4.2 Культуральное исследование Служит важным звеном лабораторной диагностики трихомоноза у мужчин и женщин, особенно при распознавании атипичных форм паразитов и выявлении их у лиц, получавших противотрихомонадные препараты при трихомонадоносительстве. ...
0 комментариев