Навигация
Ліпофільні глікозиди мурамоїлдипептиду: синтез і антиінфекційна протективна дія
НацIональна академія наук України
Фiзико-хiмiчний iнститут iм. О.В. Богатського
Цикалова Вікторія Миколаївна
УДК 547.963.1
Ліпофільні глікозиди мурамоїлдипептиду: синтез і антиінфекційна протективна дія
02.00.10 - біоорганічна хімія
Автореферат
дисертації на здобуття наукового ступеня
кандидата хімічних наук
Одеса – 2008
Дисертацією є рукопис.
Робота виконана на кафедрі органічної і біологічної хімії Таврійського національного університету ім. В.І. Вернадського Міністерства освіти та науки України.
Науковий керівник: доктор хімічних наук, професор
ЗЕМЛЯКОВ Олександр Євгенович,
Таврійський національний університет
ім. В.І. Вернадського, професор
кафедри органічної і біологічної хімії
Офіційні опоненти: доктор хімічних наук, професор
ЯРМОЛЮК Сергій Миколайович,
Інститут молекулярної біології і
генетики НАН України,
завідувач відділу комбінаторної хімії
кандидат хімічних наук, доцент
ІЩЕНКО Валентина Василівна,
Київський національний університет
ім. Тараса Шевченка,
доцент кафедри органічної хімії
Захист відбудеться « 22 » травня 2008 р. о 10.00 годині на засіданні спеціалізованої вченої ради Д 41.219.02 у Фiзико-хiмiчному інституті iм. О.В. Богатського НАН України за адресою: 65080, Одеса, Люстдорфська дорога, 86.
З дисертацією можна ознайомитись у бібліотеці Фiзико-хiмiчного інституту iм. О.В. Богатського НАН України.
Автореферат розісланий « 11 » квітня 2008 р.
Вчений секретар спеціалізованої
вченої ради, кандидат хімічних наук,
старший науковий співробітник Л.О. Литвинова
Загальна характеристика роботи
Актуальність теми. Похідні N-ацетилмурамоїл-L-аланіл-D-ізоглутаміну (мурамоїлдипептид, MDP) мають широкий діапазон імуномоделюючої дії. З декількох сотень синтезованих модифікацій мурамоїлдипептиду дотепер чотири препарати дозволено до медичного застосування і ще декілька знаходяться на завершенні клінічних випробувань. До високоактивних похідних MDP належать багато ліпофільних модифікацій мурамоїлдипептиду, зокрема, e-октадециламід MDP-L-лізину (ромуртид) і фосфатидилетаноламід MDP-L-аланіну (МТР-РЕ), які використовують як лікарські засоби для лікування вторинних імунодефіцитів і ряду пухлин.
Співробітниками кафедри органічної і біологічної хімії ТНУ було запропоновано використовувати O-глікозидування MDP для зміни гідрофільно-ліпофільних властивостей. При цьому глікозидний спосіб модифікації дозволяє виключити стадії постановки і видалення тимчасового захисту аномерного гідроксилу, що робить синтез коротшим і економічним; а також закріплює конфігурацію у С1 і, отже, у водних розчинах не утворюється аномерна суміш, яка характерна для мурамоїлдипептидів з вільним глікозидним гідроксилом. В результаті проведених досліджень було встановлено, що в-глікозиди мурамоїлдипептиду, аглікони яких додають глікопептидам амфіфільні властивості, мають порівняну імуностимулюючу дію в різних тестах in vitro та in vivo, що перевищує дію самого мурамоїлдипептиду і відповідних a-аномерів.
Також було встановлено, що на результати досліджень імуностимулюючої дії ліпоглікопептидів в тестах in vitro, значно впливає низька розчинність цих сполук у воді і схильність їх до агрегації. Тому вплив ліпофільних мурамоїлдипептидів на імунну систему коректніше оцінювати in vivo, наприклад, в тесті стимуляції антибактеріальної резистентності у мишей з внутрішньочеревинним введенням як збудника, так і глікопептиду.
Хоча окремі раніше отриманні ліпофільні глікозиди MDP, наприклад, в-гексадецил-, в-холестерил- або в-(адамантил-1-метил)-глікозиди MDP, показали високий імуностимулюючий ефект в деяких тест-системах, але систематичного вивчення цієї групи глікопептидів не було проведено. Тому направлений синтез ліпоглікопептидів, вивчення їх імуностимулюючої дії і встановлення взаємозв'язків між структурою глікозидів MDP та їх біологічною активністю є актуальним науковим завданням.
Зв'язок роботи з науковими програмами, планами, темами. Наукова робота виконувалась відповідно до координаційних планів Міністерства освіти і науки України в рамках кафедральних досліджень за програмою «Вивчення будови і біологічних властивостей вуглеводів і вуглеводовмісних сполук і біополімерів» (№ Держ. реєстрації 0101U005083 - 2001-2005 рр., 0106U003974 - 2006-2010 рр.). Частина досліджень виконана в рамках проекту Ф7/376-2001 «Створення нових імуномодуляторів, що володіють захисною дією проти вірусу імунодефіциту людини і опортуністичних інфекцій» Державного фонду фундаментальних досліджень (№ Держ. реєстрації 0101U005981 - 2003-2005 рр.).
Мета і завдання дослідження. Метою роботи є синтез нових ліпофільних О- і S-глікозидів N-ацетилмурамоїл-L-аланіл-D-ізоглутаміну з різною структурою агліконів і конфігурацією глікозидного зв'язку, а також встановлення впливу структури глікозидів MDP і їх ліпофільності на протективну антиінфекційну активність.
Для досягнення поставленої мети необхідно було вирішити ряд завдань:
- здійснити синтез двох груп нових ліпофільних О-в-глікозидів MDP з первинними і симетричними вторинними аліфатичними агліконами;
- синтезувати нові ліпофільні О-в-глікозиди MDP з агліконами аліциклічної, арилаліфатичної і алкілароматичної будови;
- отримати нові ліпофільні О-a-глікозиди MDP з агліконами аліфатичної і аліциклічної будови, ізомерні відповідним в-глікозидам;
- розробити схему і провести синтези нових S-в-арилглікозидів MDP;
- вивчити протективну дію синтезованих сполук при поразці мишей грампозитивними і грамнегативними бактеріями, а також вірусом грипу.
Об'єкт дослідження - O- і S-глікозиди N-ацетилмурамоїл-L-аланіл-D-ізоглутаміну.
Предмет дослідження - реакції глюкозамідування спиртів, фенолів і тіофенолів; розробка методик синтезу ліпоглікопептидів; скринінг біологічної активності отриманих сполук.
Методи дослідження - органічний синтез, тонкошарова хроматографія, 1Н ЯМР спектроскопія (одновимірна, двовимірні COSY и NOESY), біологічні випробування in vivo.
Наукова новизна.
- Здійснено синтез нових ліпофільних в-алкілглікозидів MDP з різною довжиною вуглецевого ланцюга.
- Запропоновано новий тип ліпофільних похідних мурамоїлдипептиду - діалкілметилглікозиди MDP. Отримано ряд глікопептидів цього типу, що відрізняються ліпофільністю.
- Синтезовано алкілфенільні і арилетильні глікозиди мурамоїлдипептиду: в-п-толіл-, в-п-трет-бутилфеніл- і в-п-ди-трет-бутилфеніл-, в-2,2-дифенілетил- і в-2-п-біфенілетил-MDP.
- Отримані в-глікозиди мурамоїлдипептиду з агліконами, що містять аліциклічни компоненти: в-2-(адамантил-1)етил-, в-циклододецил- і 4-трет-бутилциклогексил-MDP.
- Здійснено синтез нових ліпофільних б-глікозидів мурамоїлдипептиду: a-додецил-, a-(ундецил-6) - і a-циклододецил-MDP.
- Вперше здійснено синтез в-арилтіоглікозидів MDP.
- Встановлено, що на відміну від глікозидів MDP, які мають переважно амфіфільні властивості, у ліпофільних глікозидів MDP з різною конфігурацією аномерного центру не спостерігається достовірних відмінностей в стимуляції протективної дії проти бактерійних інфекцій.
Практичне значення отриманих результатів.
- Результати роботи можуть знайти застосування в синтезі вуглеводів і вуглеводовмісних комплексів. Відпрацьовано методики синтезу глікозидів N-ацетилглюкозаміну з агліконами різноманітної будови.
- Виявлені ліпофільні глікозиди MDP, які стимулюють стійкість мишей до поразки грампозитивними і грамнегативними бактеріями.
- Встановлено, що в-децил-MDP має протективний ефект відносно заражених грипом мишей.
Особистий внесок дисертанта. Особистий внесок автора в роботи, які виконані в співавторстві, полягає у виконанні синтетичного експерименту, аналізу і трактуванні отриманих результатів, формулюванні висновків. Співавторами робіт є Земляков О.Є., Чирва В.Я., Цикалов В.В.(визначення напряму дослідження, вибір об'єктів синтезу, керівництво експериментом і участь в узагальненні результатів). Дослідження біологічної активності проводили спільно з Малигіною В.Ю., Кацевим А.М., Криворутченко Ю.Л. (Кримський державний медичний університет ім. С.І. Георгієвського), Мулик Є.Л., Кузовлевим Ф.М., Калюжиним О.В. (Інститут морфології людини РАМН, м. Москва), Киселевським М.В. (НДІ експериментальної діагностики і терапії пухлин Російського онкологічного наукового центру ім. М.М. Блохіна РАМН, м. Москва).
1Н ЯМР дослідження виконані спільно з к.х.н., с.н.с. Пироженко В.В. (Інститут органічної хімії НАН України, м. Київ), експерименти COSY і NOESY - спільно з д.х.н., с.н.с. Туровим O.В. і д.х.н., проф. Брусиловцем А.I. (Київський національний університет ім. Тараса Шевченка).
Апробація результатів дисертації. Основні результати роботи були представлені на XX і XXI Українських конференціях з органічної хімії (Одеса, 2004 р., Чернігів, 2007 р.); на Міжнародному симпозіумі “Advanced science in organic chemistry” (Судак, 2006 р.); на XVIII Менделєєвському з'їзді з загальної і прикладної хімії (Москва, 2007); а також на науково-практичних семінарах Координаційної ради відділення хімії НАН України з проблеми «Наукові основи створення лікарських засобів» (Гурзуф, 2003-2005 рр.) і професорсько-викладацьких наукових конференціях ТНУ (2003-2006 рр.).
Публікації. За темою дисертації опубліковано 5 статей і тези 4 доповідей.
Обсяг і структура роботи. Дисертація складається зі вступу, огляду літератури, обговорення результатів, експериментальної частини, висновків і списку цитованої літератури (165 найменувань). Робота викладена на 148 стор. і включає 24 рисунка, 13 таблиць і 8 схем.
Зміст роботи
Стартовими сполуками в синтезі глікозидів MDP 9a-i,k-s, 16b,f,l, 23r,s (рис. 1) служили відповідні перацетильовані глікозиди N-ацетилглюкозаміну. Подальша схема включала послідовне дезацетилювання сполук 3a-i,k-s, 10b,f,l, 17r,s за Земпленом і введення 4,6-О-ізопропіліденового захисту в триоли 4a‑i,k‑s, 11b,f,l, 18r,s дією 2,2-диметоксипропану.
Алкілювання С3-ОН групи в ацеталях 5a-i,k-s, 12b,f,l, 19r,s проводили L-2-бромопропіоновою кислотою у діоксані у присутності гідриду натрію в умовах, сприяючих зверненню конфігурації асиметричного центру в похідному пропіонової кислоти. Отримані захищені мурамові кислоти 6a-i,k-s, 13b,f,l, 20r,s активували дією дициклогексилкарбодііміду (DCC) і N-гідроксисукциніміду (HOSu) і конденсували з бензиловим естером дипептиду. У глікопептидах 7a-i,k-s, 14b,f,l, 21r,s ацетальний захист віддаляли нагріванням з 70% оцтовою кислотою, а бензилові естери в похідних 8a-i,k-s, 15b,f,l – каталітичним гідрогенолізом. У разі тіоглікозидів 21r,s проводили омилення естерного захисту.

Рис. 1. Загальна схема синтезу глікозидів MDP.
Синтез в-глікозидів MDP з агліконами аліфатичної, аліциклічної і арилаліфатичної природи
На імуностимулюючу дію ліпофільних похідних MDP значно впливає структура ліпофільної компоненти. Тому разом з синтезом в-глікозидів MDP 9а-е з лінійними ліпофільними агліконами з різною довжиною вуглецевого ланцюга нами отримано нові ліпоглікопептиди 9f-i, для яких агліконами використані симетричні вторинні аліфатичні спирти (діалкілметаноли).
Глікозиди 9f-i подібно до таких високоактивних ліпоглікопептидів, як фосфатидилетаноламід MDP-L-аланіну і 6-О-(2-тетрадецилгексадеканоїл)-MDP, здатні за рахунок вуглецевих ланцюгів, що зближуються в просторі, утворювати в розчинах відносно жорсткі гідрофобні стрижнеподібні структури. Присутність такого «ліпідного якоря» сприяє вбудовуванню цих глікопептидів в аналогічним чином організовані фосфоліпідні мембрани імунних клітин.
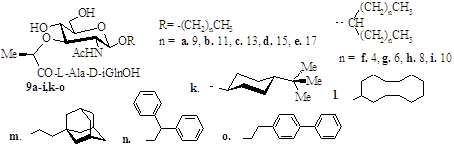
У третю групу синтезованих нами глікопептидів увійшли в-4-трет-бутилциклогексил-, в-циклододецил-, в-2-(адамантил-1)етил-, в-2,2-дифенілетил- і в-2-п-бифенілетилглікозиди MDP (9k-o), що містять у якості аглікону аліциклічні і ароматичні спирти з числом атомів Карбону від 10 до 14. Не дивлячись на невеликі відмінності в числі атомів Карбону, ліпофільність цих агліконів значно відрізняється: значення СlogP* змінюється від 2,77 у 2,2-дифенілетанолу до 4,52 у циклододеканолу.
Для вибору методу глікозилювання первинних і вторинних спиртів було проведено порівняльне вивчення реакцій глікозилювання додеканолу-1, ундеканолу-6 і циклододеканолу найбільш простими і доступними глікозил-донорами - a-D-глюкопіранозилхлоридом 1 в умовах реакції Кенігса-Кнорра у присутності промоторів меркурій(II) ціаніду або іодиду і оксазоліном 2.
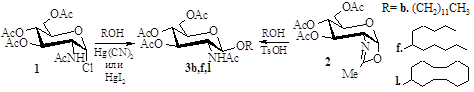
Глікозил-донор і глікозил-акцептор бралися в еквімольних кількостях. На підставі результатів цих експериментів (табл. 1) був вибраний оксазоліновий метод. Він разом з більш високими виходами глікозидів відрізняється отриманням виключно 1,2-транс-глікозидів, тоді як при використанні Hg(CN)2 спостерігалося додаткове утворення оксазоліну 2, а у разі HgI2. - відповідних a-аномерів.
Препаративну кількість перацетильованих в-глікозидів N-ацетилглюкозаміну 3а-i,k-o отримали дією на спирти надлишку оксазоліну 2. Виходи склали 62-88% для первинних спиртів, 26-68% для вторинних аліфатичних спиртів і 45-81% для циклододеканолу і заміщених етанолів.
Таблиця 1
Глікозилювання спиртів хлоридом 1 і оксазоліном 2
| Умови реакції | Тривалість реакції, г* | Глікозид; вихід, %** | |||
| Глікозил-донор | Розчинник | Промотор (каталізатор) | Температура | ||
| 1 | С2Н4Сl2 | Hg(CN)2 | 20 °C | 24 | 3b; 48,9±9,4 |
| 1 | С2Н4Сl2 | HgI2 | 20 °C | 24 | 3b; 39,8±0,8 |
| 2 | С2Н4Сl2 | TsOH | 90 °C | 1,5 | 3b; 42,7±7,5 |
| 1 | С2Н4Сl2 | Hg(CN)2 | 20 °C | 84 | 3f; 15,6±1,2 |
| 1 | С2Н4Сl2 | HgI2 | 20 °C | 108 | 3f; 15,6±4,8 |
| 2 | С2Н4Сl2 | TsOH | 90 °C | 2 | 3f; 30,3±0,5 |
| 1 | С2Н4Сl2 | Hg(CN)2 | 20 °C | 28 | 3l; 29,4±1,3 |
| 1 | С2Н4Сl2 | HgI2 | 20 °C | 72 | 3l; 15,6±0,9 |
| 2 | С2Н4Сl2 | TsOH | 90 °C | 2 | 3l; 23,9±2,1 |
* До зникнення за даними ТШХ глікозил-донорів 1 і 2.
** Середнє значення з трьох експериментів.
Будова глікозидів 3а-i,k-o підтверджена даними 1Н ЯМР спектрів. . Проведено повне віднесення сигналів протонів глікозидного залишку і агліконів. Наявність дублетів аномерних протонів з хім. зсувом 4,67-4,85 м.ч. і КССВ 8,0-8,5 Гц підтверджує утворення в-D-глюкозамінідів.
У разі цис-,транс-4-трет-бутилциклогексанолу глікозилювання проводили недостатністю оксазоліну 2. У реакційній суміші за даними ТШХ знаходяться два продукти глікозилювання: більш рухомий мінорний глікозид 3j і основний компонент – глікозид 3k, які були виділені колонковою хроматографією. Виходячи з більшої реакційної здатності транс-4-трет-бутилциклогексанолу з екваторіальним розташуванням гідроксильної групи для сполуки 3k запропонована транс-конфігурація циклогексанового циклу, а для його ізомеру 3j - цис-конфігурація.
Протони сполук 3k,j мають близькі значення хімічних зсувів і КССВ (рис. 2), що підтверджує їх ізомерну будову. Основні відмінності пов'язані із зсувом в слабкіше поле сигналів Н2 в глікозидному залишку і метинового протона аглікону для глікозиду 3j.
Попередньо запропоновані конфігурації замісників в циклогексановому фрагменті агліконів сполук 3j,k підтверджуються даними спектрів COSY і 2D NOESY. Зокрема, в спектрі 2D NOESY (рис. 3) глікозиду 3k присутні крос-піки між аксіальними протонами Н1’ і Н3’, Н5’, що є просторово зближуючими.
Будова глікопептидних похідних 8а-i,k-o і 9а-i,k-o підтверджувалася 1Н ЯМР спектроскопією. Ідентифіковані характеристичні сигнали, що відносяться до протонів аглікону, вуглеводного залишку і лактилдипептидного фрагмента (наприклад, рис. 4). Спектр COSY (рис. 5) сполуки 8b дозволив точніше віднести ряд сигналів протонів глікопептидів, зокрема аномерного протона і метинових протонів лактилпептидного залишку.
Синтез ліпофільних a-глікозидів мурамоїлдипептиду
З метою вивчення впливу конфігурації аномерного центру, а також структури і природи агліконів глікозидів мурамоїлдипептиду на їх імуностимулюючу дію нами на додаток до в-додецил-, в-(ундецил-6) - і в-циклододецилглікозидів мурамоїлдипептиду 9b,f,l були синтезовані відповідні a-аномери 16b,f,l, які містять аліфатичні лінійний первинний і симетричний вторинний, а також циклоаліфатичний аглікони.
Ці аглікони, з одного боку, мають близьку ліпофільність – СlogP для відповідних спиртів 4,95, 4,20 і 4,52, а з іншого, в цьому ряду агліконів зменшується конформаційна рухливість вуглеводневих ланцюгів і ефективна поверхня, що може впливати на взаємодію з біомембранами.
Вихідні перацетильовані a-N-ацетилглюкозамініди 10b,f,l синтезували взаємодією відповідних спиртів з a-глюкозамінілхлоридом 1 в нітрометані при температурі ~90°С у присутності меркурій(II) іодиду. Структура глікозидів 10b,f,l підтверджується даними 1Н ЯМР спектрів (рис. 6).
Рис. 6. Фрагменти 1Н ЯМР спектрів a- і b-(ундецил-6)глікозидів 10f (А) і 3f (В).
Для a-D-глюкозамінідів дублети аномерного протона зміщені в слабкіше поле (d 4,75-4,87 м.ч.) в порівнянні з відповідними сигналами b-D-аномерів 3b,f,l (d 4,68-4,77 м.ч.) і мають КССВ 3,5 Гц, властиву 1,2-цис-глікозидам, на відміну від КССВ 8,5 Гц, характерної для 1,2-транс-глікозидного зв'язку. Крім того, для a-ізомерів спостерігається характерний зсув в слабке поле сигналу протона у С2 (d 4,25-4,27 м.ч. в порівнянні з 3,64-3,80 м.ч. у відповідних в-аномерів) і амідного протона (d 5,56-5,59 і 5,45-5,50 м.ч. відповідно).
Далі за розглянутою вище схемою (див. рис. 1) синтезували a-глікозиди MDP 16b,f,l. Будова глікопептидів 15b,f,l і 16b,f,l підтверджувалася 1Н ЯМР спектроскопією.
Синтез О- і S-в-п-алкілфенілглікозидів мурамоїлдипептиду
Раніше (Земляков А.Е. и др. // Биоорган. химия. - 2001.- С .439) було встановлено, що в-фенілмурамоїлдипептид має високу імуностимулюючу дію в тестах in vitro та in vivo. У розвитку цих робіт, а також для визначення впливу природи аглікону на імуностимулюючу дію глікозідних похідних мурамоїлдипептиду, нами виконаний синтез в-п-толіл-, в-п-трет-бутилфеніл- і в-п-(1,1,3,3-тетраметилбутил)фенілглікозидів MDP 9p-s - нових алкілфенілглікозидів мурамоїлдипептиду з агліконами різної ліпофільності.
На відміну від широко досліджуваних О-глікозидів мурамоїлдипептиду дотепер було отримано тільки три S-в-алкілтіоглікозиди MDP (Hasegawa A., et al // J. Carbohydr. Chem.-1982-1983.- P.317), ад'ювантна активність яких поступалася MDP. Нами з метою вивчення впливу природи гетероатома біля глікозидного центру на біологічну активність здійснено синтез раніше не описаних в-п-толілтіо- і в-п-трет-бутилфенілтіоглікозидів MDP 23p,r.
У попередньому експерименті оцінювалися найбільш прості і доступні методи отримання перацетильованих О- і S-в-арилглюкозамінідів (табл. 2). п-трет-Бутилфенол і п-тіокрезол глікозилювали еквімолярною кількістю a-хлориду 1 в умовах міжфазного каталізу (МФК) четвертинними амонієвими солями в системі «рідина - рідина», а також каталізу краун-етером в системі «рідина - тверде тіло». Для п-тіокрезолу глікозилювання також проводили у присутності надлишку триетиламіну.
Зважаючи на те, що у всіх вивчених методах глікозилювання виходи продуктів 3r і 17p достатньо великі, в препаративних цілях використовували надлишок фенолів, які глікозилювали a-хлорідом 1 в більш економічних умовах МФК четвертинними амонієвими солями, а реакцію тіофенолів з a-хлоридом 1 проводили при кімнатній температурі у присутності триетиламіну, а також в умовах МФК з BnEt3NCl. Після кристалізації з ізопропілового спирту отримали арилглікозиди 3p-s з виходами 61-77%, а арилтіоглікозиди 17p,r - з виходами 78 і 52%, відповідно. Будова сполук 3p-s і 17p,r була доведена 1Н ЯМР спектроскопією (рис. 7).
Таблиця 2
Глікозилювання п-трет-бутилфенолу і п-тіокрезолу хлоридом 1
| Умови реакції | Тривалість реакції, г* | Глікозид; вихід %** | ||
| Каталізатор | Основа | Розчинник | ||
| BnEt3NCl | NaOH | Н2О / CHCl3 | 16 | 3r; 34,5±1,4 |
| Bu4NBr | NaOH | Н2О / CHCl3 | 1 | 3r; 37,1±2,4 |
| 15-краун-5 | К2СО3 | MeCN | 4 | 3r; 42,5±8,0 |
| BnEt3NCl | NaOH | Н2О / CHCl3 | 1 | 17p; 65,1±6,8 |
| 15-краун-5 | К2СО3 | MeCN | 4 | 17p; 50,9±3,7 |
| - | Et3N | MeCN | 5 | 17p; 49,4±6,3 |
* До зникнення за даними ТШХ глікозил-донору 1.
** Середнє значення з трьох експериментів.
Сигнали аномерного протона тіоглікозидів (d 4,78-4,82 м.ч.) зміщені в сильне поле в порівнянні з відповідними сигналами О-в-глікозидів (d 5,20-5,24 м.ч.). КССВ складає 10-10,5 Гц, що характерно для S-1,2-транс-D-глюкозамінідів і суттєво відрізняється від J1,2
0 комментариев