Навигация
Мікробіологічне обгрунтування нових підходів до лікування та профілактики стафілококових інфекцій на основі дослідження протимікробних властивостей похідних тіазолідину, фурану, хіноліну, акридину і біологічно активних речовин природного походження
ДЕРЖАВНА УСТАНОВА
"ІНСТИТУТ МІКРОБІОЛОГІЇ ТА ІМУНОЛОГІЇ ім.І.І. МЕЧНИКОВА
АкадеміЇ медичних наук УКРАїНИ"
КУЦИК РОМАН ВОЛОДИМИРОВИЧ
УДК 615.281: [547: 835.012.1+547.789.1+579.861]
Мікробіологічне обгрунтування нових підходів до лікування та профілактики стафілококових інфекцій на основі дослідження протимікробних властивостей похідних тіазолідину, фурану, хіноліну, акридину і біологічно активних речовин природного походження
03.00.07 - мікробіологія
АВТОРЕФЕРАТ
дисертацiї на здобуття наукового ступеня
доктора медичних наук
Харків – 2008
Дисертацією є рукопис.
Робота виконана в Івано-Франківському державному медичному університеті МОЗ України на кафедрі мікробіології, вірусології та імунології.
Науковий консультант: доктор біологічних наук, професор, чл. -кор. НАН України, заслужений діяч науки і техніки України Співак Микола Якович, Інститут мікробіології і вірусології ім. Д.К. Заболотного НАН України, завідувач відділу проблем інтерферону та імуномодуляторів
Офіційні опоненти:
доктор медичних наук, професор Дикий Ігор Леонідович, Національний фармацевтичний університет МОЗ України, завідувач кафедри мікробіології, вірусології та імунології
доктор медичних наук, професор Сидорчук Ігор Йосипович, Буковинський державний медичний університет МОЗ України, професор кафедри пропедевтики внутрішніх хвороб, клінічної імунології, алергології та імунології
доктор медичних наук, професор, заслужений діяч науки і техніки України Палій Гордій Кіндратович, Вінницький національний медичний університет ім. М.І. Пирогова МОЗ України, завідувач кафедри мікробіології, вірусології та імунології
Захист відбудеться " _18_ " ___квітня_________ 2008 р. о __11.00__ годині на засіданні спеціалізованої Вченої ради Д 64.618.01 при ДУ "Інститут мікробіології та імунології ім. І.І. Мечникова АМН України" (61057, м. Харків, вул. Пушкінська, 14-16).
З дисертацією можна ознайомитися у бібліотеці ДУ "Інститут мікробіології та імунології ім. І.І. Мечникова АМН України" (61057, м. Харків, вул. Пушкінська, 14-16).
Автореферат розіслано " _12_ " __березня_________ 2008 р.
Вчений секретар
спеціалізованої Вченої ради Д 64.618.01,
кандидат медичних наук, ст. н. с. С.В. Бруснік
Загальна характеристика роботиАктуальність теми. Локальне і глобальне поширення поліантибіотикорезистентних збудників нозокоміальних і опортуністичних інфекцій, в тому числі метіцилінрезистентних S. aureus (MRSA) і коагулазо-негативних стафілококів (MR-CNS), є серйозною проблемою сучасної медицини (Archibald L. etc., 1997; Ayliffe G. A., 1997; Jesudason M. V. etc., 1997; Johnson A. P. etc., 2005). Цьому явищу сприяють широке неконтрольоване застосування антибіотиків (зокрема напівсинтетичних пеніцилінів та цефалоспоринів ІІ і ІІІ поколінь), інтенсивне використання інвазивних методів діагностики і лікування (ендоскопії, ангіографії, катетеризації судин і сечового міхура, інтубації трахеї, гемодіалізу), значне поширення серед пацієнтів набутих імунодефіцитних станів різноманітної етіології та різного ступеню тяжкості, а також недостатня увага персоналу до дотримання правил протимікробного режиму в лікувальних закладах (McDonald M., 1997; Coello R. etc., 1997). Особливо гостро проблема нозокоміальних інфекцій, спричинених госпітальними штамами мікроорганізмів (передусім MRSA і MR-CNS), відчувається у відділеннях хірургічного профілю та інтенсивної терапії (Сидоренко С.В. і співавт., 1998; Berghmans T. etc., 1997; Haddadin A. S. etc., 2002; Li J. etc., 2001; Parton M. etc., 1997; Schmitz F. J. etc., 1997; Seeberg S. і Larsson L., 1997; Takahashi S. etc., 1997; Wiktorowicz-Belzyt E. і Wojak I., 1997; Yinnon A. M. etc., 1998), в геріартричних та неонатологічних стаціонарах (Bradley S. F., 1997; Fraise A. P. etc., 1997; Honjo N. etc., 1997; Kallman J. etc., 1997; Washio M. etc., 1997). За найскромнішими підрахунками вартість лікування пацієнтів з інфекціями, спричиненими метіцилінрезистентними стафілококами (MRS), обходиться у 293,4$ на добу (Shannon T. etc., 1997).
Досвід провідних клінік розвинутих країн свідчить, що раннє виявлення та попередження епідеміологічних спалахів і раціональне використання антибіотиків обмежують можливість поширення цих нозокоміальних патогенів (Curran E. T. etc., 2002; Bradley S. F., 1997; Humphreys H. і Duckworth G., 1997; Hartstein A.I. etc., 1997). Проте відсутність систем мікробіологічного моніторингу та ефективної епідеміологічнї служби протиінфекційного контролю в більшості вітчизняних клінік не створює умов для дотримання принципів раціональної антибактеріальної терапії. Залишаються не з’ясованими реальні масштаби поширення MRS у вітчизняних лікувальних закладах, що, відповідно, аж ніяк не сприяє впровадженню дієвої системи багаторівневого протиінфекційного контролю.
Значення MRS для медичної практики зумовлене їх перехресною стійкістю до усіх b-лактамних антибіотиків та асоційованою резистентністю до препаратів інших класів, включаючи аміноглікозиди, макроліди, лінкозаміди, тетрацикліни, фторхінолони, що вкрай обмежує можливості етіотропної терапії (Skurray R. A. і Firth N., 1997). Найбільш прогнозованою є чутливість MRS лише до глікопептидних антибіотиків – ванкоміцину і тейкопланіну. Інші сучасні препарати для лікування MRS-інфекцій (лінезолід, дальфопрістін/хінупрістін, арбекацин) в Україні поки що малодоступні. Серйозними лімітуючими факторами широкого використання глікопептидів є наявність у них побічних ефектів – нефротоксичності (Howard C. E. etc., 1997; Saitoh A. etc., 1997), значна вартість (Tambic A., 1997) та загрозливо високі темпи набування мікроорганізмами резистентності (Benquan W. etc., 2002; Woodford N. etc., 1995). Зокрема у 2006 р. зареєстровано появу штамів ванкоміцинрезистентних S. aureus в США (Perichon B. etc., 2006) та Індії (Tiwari H. K. і Sen M. R., 2006), а поширення штамів із зниженою чутливістю до ванкоміцину уже стало глобальною проблемою (Bierbaum G. etc., 1999; Denis O. etc., 2002; Kim M. N. etc., 2002; Ma Y. etc., 2002; Marchese A. etc., 2000; Mlynarczyk G. etc., 2002; Rossney A. S. і Keane C. T., 2002). Тому основними показами до застосування глікопептидів у клініці є тяжкі і генералізовані інфекції, а проблеми лікування легших за перебігом інфекцій, спричинених MRS, надійної ерадикації їх носійства, як і зниження мікробного обсіменіння об’єктів навколишнього (особливо лікарняного) середовища, в основному, залишаються відкритими.
У зв’язку з цим відчувається гостра потреба у розробці нових стратегічних підходів до протимікробної терапії. Актуальним завданням є пошук у стафілококових клітинах нових потенційних мішеней для протимікробних препаратів, виявлення принципово нових класів хімічних сполук з протистафілококовою активністю, яка не знижується у зв’язку з функціонуванням в мікробних клітинах відомих детермінант резистентності (Chopra I. etc., 1997).
Впродовж останніх десятиріч в Україні сформувалися наукові школи мікробіологів і хіміотерапевтів (В.В. Смирнова, В.П. Широбокова, Ю.Л. Волянського, Г.К. Палія, І.Л. Дикого, І.Й. Сидорчука, А.Я. Циганенка, Ю.С. Кривошеїна, А.В. Руденко, М.Я. Співака, В.С. Підгорського, Г.М. Кременчуцького), плідна діяльність яких дала ряд високоефективних лікувальних та профілактичних протимікробних засобів для медичної і ветеринарної практики. В основі їх прикладних розробок лежать досягнення вітчизняних хіміків-синтетиків наукових шкіл М.М. Туркевича, Б.С. Зіменковського, Б.М. Гуцуляка, В.П. Черних, Е.Я. Левітіна та ін.
Нами виконано пошук потенційних кандидатів у лікувальні засоби з активністю відносно MRS серед різних класів синтетичних гетероциклічних сполук – похідних тіазолідину, тіазолу, фурану, хіноліну, хінолінію та акридинію. Правильність вибраних напрямків дослідження підтверджується визнаною протимікробною активністю похідних фурану, хіноліну та акридину, недавнім впровадженням у світову медичну практику оксазолідонів (лінезолід, ранбезолід) як ефективних засобів відносно полірезистентних грам-позитивних бактерій (Буданов С.В. і Смирнова Л.Б., 2002; Kaatz G. W. і Rybak M. J., 2001; Livermore D. M., 2003), а також здатністю четвертинних солей акридинію елімінувати плазмідну резистентність бактерій до антибіотиків (Крестецька С.Л., 2003).
Іншим важливим джерелом сполук з протимікробними властивостями відносно поліантибіотикорезистентних мікроорганізмів, в тому числі стафілококів, є рослинна сировина (Смирнов В.В. і Бондаренко А.С., 1999; Gibbons S., 2004; Silver L. і Bostian K., 1990). Природні багатства екологічно чистих Карпатського і Передкарпатського регіонів України можуть забезпечити потреби фармацевтичної промисловості у рослинній сировині. Проте цілеспрямованого пошуку у флорі України сполук з активністю відносно MRS не виконувалося.
Водночас не можна не відзначити, що природні еволюційні процеси в мікробних популяціях неминуче призводять до неухильного зниження терапевтичного потенціалу будь-якого нового препарату. Тому при створенні нових протистафілококових засобів, поряд із дослідженнями в області класичної хіміотерапії, постає також необхідність пошуку якісно нових альтернативних підходів. Для вирішення проблеми боротьби з антибіотикорезистентністю збудників опортуністичних інфекцій, в тому числі стафілококів, перспективним є подальше вивчення явища мікробного антагонізму (Кременчуцкий Г.М., 2000). В останній час стрімко зростає інтерес до комбінованої хіміотерапії, важливим елементом якої є речовини нового спрямування дії - модифікатори резистентності бактерій (resistance modifying agents), здатні нейтралізувати механізми набутої резистентності мікроорганізмів до антибіотиків (Gibbons S., 2004; Kaatz G. W., 2002, 2005; Marquez B., 2005; Pages J. M., 2005). Про перспективність подібного вирішення проблеми свідчить успішне впровадження в медичну практику комбінацій напівсинтетичних пеніцилінів з інгібіторами b-лактамаз - клавулановою кислотою, сульбактамом, тазобактамом. Проте перелічені інгібітори b-лактамаз не володіють здатністю відміняти метіцилінрезистентність стафілококів, яка пов’язана з продукцією відповідними штамами мутантного пеніцилін-зв’язуючого білка PBP2ў. Мало вивченим є також питання можливості нейтралізації детермінант резистентності стафілококів до антибіотиків інших хімічних груп.
Викладені міркування характеризують актуальність обраного напрямку досліджень і обгрунтовують необхідність створення якісно нових засобів для боротьби з MRS, які не тільки володіють прямою протимікробною активністю, але й здатні потенціювати дію класичних антибіотиків і гальмувати темпи набування резистентності до них. Виконані дослідження дозволяють вважати обрані синтетичні сполуки і біологічно активні речовини рослинного походження потенційно перспективними для поглибленого вивчення і подальшого використання в медичній практиці.
Зв’язок роботи з науковими програмами, планами і темами. Дисертаційна робота пов’язана з багаторічною плановою науковою тематикою кафедри мікробіології Івано-Франківського державного медичного університету з проблеми вивчення антибіотиків, їх впливу на організм людини та умовно-патогенні мікроорганізми. Робота виконана в рамках комплексних наукових програм Івано-Франківського державного медичного університету "Антиінфекційна резистентність та стан здоров’я дітей м. Івано-Франківська в сучасних соціально-економічних та екологічних умовах" (номер державної реєстрації 0103U004919) та "Синтез похідних оксополігідроакридинів і вивчення їх протимікробної активності" (номер державної реєстрації 0104U002556). Автор – відповідальний виконавець перерахованих тем.
Тема дисертації затверджена на засіданні Вченої ради Івано-Франківського державного медичного університету 27.03. 2001 р.
Мета і завдання дослідження. Мета роботи – розробити стратегію пошуку нових ефективних засобів для лікування та профілактики стафілококових інфекцій серед синтетичних похідних тіазолідину, фурану, хіноліну і акридину та біологічно активних речовин природного походження.
Для реалізації мети сформульовано і розв’язано наступні основні завдання:
вивчити регіональні епідеміологічні аспекти поширення MRS в лікувальних закладах Прикарпаття;
з’ясувати механізми резистентності сучасних клінічних ізолятів метіцилінрезистентних стафілококів (MRS) до фторхінолонів, макролідів та тетрациклінів;
сформувати колекцію клінічних ізолятів стафілококів з ідентифікованими детермінантами антибіотикорезистентності, придатних для використання в якості еталонних тест-штамів при розробках нових протимікробних засобів відповідно до актуальних клінічних потреб;
виконати первинний мікробіологічний скринінг комбінаторних бібліотек нових синтетичних похідних тіазолідину, тіазолу, фурану, хіноліну та акридину з використанням клінічних штамів стафілококів з різними профілями та детермінантами антибіотикорезистентності, ідентифікувати серед них "структури-лідери" для поглибленого вивчення;
провести аналіз кореляції "структура–активність", виявити молекулярні фрагменти, які критично впливають на реалізацію протимікробного ефекту відносно MRS;
провести мікробіологічне обгрунтування нових синтетичних гетероциклічних сполук – кандидатів у лікувальні засоби;
вивчити протимікробну активність лікарських рослин флори України відносно MRS;
оцінити антиадгезивні, протизапальні та імуномодулюючі властивості рослинних засобів;
удосконалити методологію спрямованого пошуку потенційних модифікаторів антибіотикорезистентності стафілококів серед сполук синтетичного і природного походження;
розробити технології одержання протимікробних комплексів з рослинної сировини.
Об’єкт дослідження – еталонні і клінічні штами S. aureus і CNS, виділені від пацієнтів з гнійно-запальними захворюваннями різноманітної локалізації.
Предмет дослідження – протистафілококова активність гетероциклічних сполук (похідних тіазолідину, тіазолу, фурану, хіноліну та акридину), рослинних екстрактів, антибіотиків, антисептиків, дезинфектантів.
Методи дослідження – мікробіологічні, хімічні, фітохімічні, біохімічні, хроматографічні, біоавтографічні, імунологічні, токсикологічні, математичні, статистичні.
Наукова новизна одержаних результатів. Вперше в Україні на регіональному масштабі впроваджено довготермінову програму епідеміологічного і мікробіологічного моніторингу за поширенням MRS. На багатому фактичному матеріалі продемонстровано тенденції до набування циркулюючими у вітчизняних лікувальних закладах штамами MRSA і MR-CNS резистентності до фторхінолонів, глікопептидів, антибіотиків інших груп і антисептиків. Встановлено значне поширення серед вітчизняних клінічних штамів стафілококів ефлюксних механізмів резистентності до фторхінолонів (NorA), макролідів (MsrA), тетрациклінів (TetK).
Піднімається питання про існування в Україні MRS із зниженою чутливістю і резистентністю до ванкоміцину та реальну небезпеку їх внутрішньолікарняного поширення.
На основі теоретичного узагальнення результатів експериментального дослідження протимікробних властивостей нових синтезованих гетероциклічних сполук різних класів і біологічно активних комплексів рослинного походження обгрунтовано нову стратегію пошуку ефективних засобів для лікування та профілактики сучасних стафілококових інфекцій, подолання медикаментозної стійкості стафілококів. Розроблено нові методологічні підходи до первинного скринінгу і поглибленого мікробіологічного дослідження потенційних кандидатів у протимікробні лікувальні засоби, в основу яких покладено застосування в якості тест-об’єктів ізолятів з ідентифікованими детермінантами антибіотикорезистентності і репрезентативних панелей всесторонньо охарактеризованих штамів.
Серед нових синтезованих гетероциклічних сполук (похідних тіазолідину, тіазолу, тріазолу, фурану, хіноліну та акридину) виявлено структури-лідери з високим рівнем протимікробної активності відносно MRS. На основі 2D - і 3D-QSAR аналізу встановлено математичні взаємозв’язки між структурними характеристиками досліджених сполук і рівнем їх активності відносно MRS, сформульовано вимоги до дизайну оптимізованих структур. Виявлено нові класи сполук, які виступають в ролі інгібіторів недавно ідентифікованих актуальних мішеней для дії протимікробних препаратів у клітинах MRSA – ферментів біосинтезу пептидоглікану MurC (5- [2-(арилметилокси) - 5-нітрофеніл] метиліден-2-тіоксотіазолідин-4-они) і MurB (2,4,5-тризаміщені 4-спіранові похідні тіазолідин-2-ону з піразолобензоксазиновим фрагментом). Вперше продемонстровано виражений синергізм протимікробної дії похідних 4-азолідонів з b-лактамними антибіотиками (оксациліном) відносно MRSA. Низький рівень токсичності окремих досліджених похідних тіазолідину та оксополігідроакридинів дозволяє розглядати їх в якості потенційних кандидатів у лікувальні засоби і рекомендувати для поглибленого фармакологічного вивчення.
Здійснено широкомасштабне цілеспрямоване тестування екстрактів лікарських рослин флори України, що належать до різних таксономічних груп, на предмет виявлення природних джерел сполук з високим рівнем прямої протимікробної активності відносно MRS та імуномодулюючими властивостями, а також сполук нового виду фармакологічної дії – модифікаторів антибіотикорезистентності бактерій. Встановлено закономірності продукції метаболітів, які здатні модифікувати антибіотикорезистентність стафілококів, рослинами різних таксономічних груп, а також удосконалено методику їх спрямованого пошуку.
Одержані результати істотно розширюють існуючі уявлення про фармакологічні властивості офіцинальних і неофіцинальних лікарських рослин, фармакопейних фітопрепаратів. Вперше виявлено і докладно вивчено виражену здатність компонентів водно-етанольного екстракту бруньок берези бородавчастої Betula verrucosa Ehrh. дозозалежним чином відновлювати чутливість поліантибіотикорезистентних штамів стафілококів до b-лактамних антибіотиків, макролідів, лінкозамідів, тетрациклінів і фторхінолонів. Розроблено технологію одержання модифікаторів антибіотикорезистентності стафілококів з фармакопейної рослинної сировини – бруньок берези бородавчастої (Патент України UA № 27940).
Практичне значення одержаних результатів. За результатами дисертаційного дослідження у Прикарпатському регіоні впроваджено постійно діючу динамічну багаторівневу систему епідеміологічного моніторингу (з елементами зворотного зв’язку) за розповсюдженням MRS в лікувальних закладах, що дозволило в 2003-2006 рр. досягнути зниження частоти та інтенсивності епідемічних спалахів, а також загального поширення MRS-інфекцій у великих багатопрофільних клініках.
З метою попередження внутрішньолікарняного поширення MRS рекомендуються бацилоцид, хлоргексидин, етоній та хлорофіліпт. Для епідеміологічного контролю за виникненням і поширенням внутрішньолікарняних спалахів інфекції MRS рекомендується визначення і співставлення антибіотикотипів виділених штамів. Для диференціації метіцилінрезистентних стафілококів (MRSA, MR-CNS) та стафілококів з пограничною метіцилінрезистентністю (BSSA, BS-CNS) при проведенні ретроспективного епідеміологічного аналізу слід використовувати матеріали досліджень чутливості штамів одночасно до оксациліну і цефазоліну. Встановлено регіональні особливості чутливості до антибіотиків метіцилінчутливих (MS-) і метіцилінрезистентних (MR-) штамів S. aureus та CNS, а також штамів з пограничною метіцилінрезистентністю, що доцільно використовувати при виборі антимікробних препаратів з лікувальною метою.
Розроблено комплексну лікувальну композицію етонію, амізону і силларду-П з протимікробними, протизапальними та імуномодулюючими властивостями (Патент України UA №19175), яка проявляє виражений терапевтичний ефект при хронічному генералізованому пародонтиті і може використовуватися для місцевого лікування інших гнійно-запальних процесів.
Відповідно до актуальних клінічних вимог удосконалено методологію первинного скринінгу і поглибленого мікробіологічного дослідження потенційних кандидатів у протимікробні лікувальні засоби, в основу яких покладено застосування в якості тест-об’єктів сучасних клінічних ізолятів з ідентифікованими детермінантами антибіотикорезистентності (продукція пеніцилінзв’язуючого білка PBP2ў, функціонування ефлюксних механізмів резистентності до фторхінолонів NorA, макролідів MsrA, тетрациклінів TetK) і репрезентативних панелей всесторонньо охарактеризованих штамів. Використані в дисертаційній роботі 17 авторських штамів S. aureus і 19 штамів CNS (виділених з клінічного матеріалу в 2000-2005 рр.) прийняті на зберігання до колекції філії музею мікроорганізмів ДУ "Інститут мікробіології та імунології ім. І.І. Мечникова АМН України" (м. Харків) та в музей патогенних для людини мікроорганізмів Інституту епідеміології та інфекційних хвороб ім. Л.В. Громашевського АМН України (м. Київ). Використання вказаних штамів стафілококів іншими колективами дослідників дозволить підвищити і підняти на якісно новий рівень інформативність розробок в області створення нових вітчизняних протимікробних засобів.
Виявлення нових видів лікарської рослинної сировини, що є джерелами сполук з високим рівнем прямої протимікробної активності відносно MRS, антиадгезивними, імуномодулюючими властивостями та низьким рівнем цитотоксичності відкриває широкі перспективи для розробки вітчизняних фітопрепаратів. Завершено доклінічне дослідження нового ефективного протимікробного засобу – настоянки бруньок берези (Патент України UA № 27940).
В межах первинного етапу складного багатостадійного процесу створення нового фармацевтичного засобу охарактеризовано синтетичні сполуки (L-131, M-116), які володіють значною протимікробною активністю відносно MRS і низьким рівнем токсичності. Вказані сполуки, а також похідні 2-(5-арил-2-фурил) - 4-хінолінкарбонових кислот (Патент України UA № 23769) і четвертинні солі N-феніл-6-(p-диметиламінобензиліден) циклопента [с] хінолінію доцільно використовувати для конструювання антисептиків і дезинфектантів.
Результати дослідження теоретично обгрунтовують новий напрямок подолання антибіотикорезистентності стафілококів – комбіновану хіміотерапію із застосуванням модифікаторів резистентності синтетичного або природного походження. Розроблено оригінальну просту і достатньо чутливу методику для скринінгу сполук (як природного, так і синтетичного походження) на здатність відновлювати чутливість резистентних штамів мікроорганізмів до класичних антибіотиків (Патент України UA 27939).
Результати дослідження рекомендовані і використовуються в програмах навчання лікарів, фармацевтів і біологів на кафедрах вищих навчальних закладів та в системі післядипломної освіти (Львівський і Вінницький національні медичні університети, Івано-Франківський, Буковинський, Тернопільський, Одеський медичні університети, Львівський національний університет ім. І. Франка, Прикарпатський державний університет), для контролю за якістю протимікробних фітопрепаратів при їх виробництві.
Особистий внесок здобувача. Дисертант самостійно провів патентно-ліцензійний пошук, сформулював тему і мету, розробив методологію виконання роботи, оформив усі наукові публікації, написав усі розділи дисертації, сформулював висновки та практичні рекомендації.
Вивчені у дисериаційній роботі гетероциклічні сполуки синтезовані вітчизняними хіміками: проф. Р.Б. Лесиком на кафедрі фармацевтичної, органічної і біоорганічної хімії Львівського Національного медичного університету ім. Д. Галицького (похідні тіазолідину і споріднені гетероциклічні структури), проф. М.Д. Обушаком на кафедрі органічної хімії Львівського Національного університету ім.І. Франка (похідні тіазолідину, тіазолу, фурану, хіноліну), доц. М.В. Мельник на кафедрі біологічної і біонеорганічної хімії Івано-Франківського державного медичного університету (похідні оксополігідроакридинів) і доц. З.Л. Новицьким на кафедрі хімії фармацевтичного факультету Івано-Франківського державного медичного університету (четвертинні солі циклопента [с] хінолінію). Заготівлю рослинної сировини, її ідентифікацію та екстрагування здійснено автором особисто. Автор висловлює подяку доц. Б.М. Зузуку (кафедра фармакогнозії і ботаніки фармацевтичного факультету Івано-Франківського державного медичного університету) за цінні поради з оптимізації способів та режимів екстрагування рослинної сировини.
Особисто здобувачем за робочою документацією клінічних бактеріологічних лабораторій лікувально-профілактичних закладів м. Івано-Франківська і області виконано епідеміологічний аналіз стафілококових інфекцій, вивчено закономірності поширення антибіотикорезистентних (в тому числі метіцилінрезистентних) стафілококів у регіоні. У бактеріологічній лабораторії кафедри мікробіології Івано-Франківського державного медичного університету від пацієнтів з гнійно-септичними і запальними процесами різноманітної локалізації здобувачем особисто впродовж 2000-2006 рр. виділено 360 штамів стафілококів. Вказані ізоляти, а також 170 штамів стафілококів, які були передані у лабораторію кафедри для подальшого вивчення з бактеріологічної лабораторії Івано-Франківської ОКЛ та міської централізованої бактеріологічної лабораторії, особисто здобувачем ідентифіковані, досліджені на чутливість до сучасних антибіотиків, антисептиків, дезинфікуючих засобів і офіцинальних фітопрепаратів. Самостійно встановлено механізми резистентності клінічних штамів до оксациліну, макролідів, тетрациклінів, фторхінолонів. Автором особисто відібрано і підготовлено до депонування в національних колекціях 36 клінічних штамів стафілококів (17 штамів S. aureus і 19 штамів CNS) з різними профілями антибіотикорезистентності. Самостійно розроблено алгоритми пошуку синтетичних і природних сполук з протимікробною активністю відносно MRS, відібрано типові клінічні ізоляти стафілококів для використання в якості тест-штамів при первинному мікробіологічному скринінгу, сформовано репрезентативні панелі штамів для поглиблених мікробіологічних досліджень.
Особисто здобувачем виконано первинний мікробіологічний скринінг 316 нових синтетичних сполук і 359 рослинних екстрактів з використанням в якості тест-культур колекційних і відібраних клінічних штамів MS - та MR-стафілококів різної видової належності. Самостійно визначено рівні протимікробної дії найбільш перспективних за результатами первинного скринінгу сполук і рослинних препаратів на сформованих панелях 50-150 клінічних штамів стафілококів з різними профілями і детермінантами антибіотикорезистентності. Автором особисто здійснено узагальнення результатів мікробіологічного дослідження, аналіз залежності протимікробної активності синтетичних сполук від їх структури. На основі результатів аналізу "структура – активність" дисертантом самостійно сформульовано пропозиції для хіміків-синтетиків щодо напрямків оптимізації структур-лідерів, що забезпечило можливість одержання нових серій активних сполук для мікробіологічного тестування. Докінгові дослідження афінності 4-азолідонів до ензиму біосинтезу пептидоглікану MurB виконані при допомозі проф. Р.Б. Лесика на кафедрі фармацевтичної, органічної і біоорганічної хімії Львівського Національного медичного університету ім. Д. Галицького.
Здобувачем особисто розроблено стратегію пошуку в рослинній сировині сполук нового спрямування дії – модифікаторів антибіотикорезистентності бактерій. Самостійно виконано дослідження синергізму протимікробної дії рослинних екстрактів і класичних антибіотиків відносно резистентних штамів стафілококів. Особисто вивчено вплив рослинних екстрактів на динаміку росту мікробних культур та адгезивні властивості стафілококів. Дослідження здатності рослинних екстрактів індукувати продукцію ендогенного IFN і TNF-a виконано за участю канд. мед. наук Н.М. Жолобак у відділі інтерферону та імуномодуляторів Інституту мікробіології і вірусології ім. Д.К. Заболотного НАН України (зав. – докт. біол. наук., засл. діяч науки і техніки України, чл. -кор. НАН України, проф. М.Я. Співак).
Токсикологічні експерименти виконано за участю І.О. Нектєгаєва (Львівський Національний медичний університет ім. Д. Галицького) і проф. С.Б. Геращенка (Івано-Франківський державний медичний університет).
Апробація результатів дисертації. Основні наукові положення, висновки та практичні рекомендації дисертації доповідались і обговорювались на ІX і Х з’їздах Товариства мікробіологів України (Чернігів, 2000; Одеса, 2004), 2-му з’їзді фтизіатрів і пульмонологів України (Київ, 1998), VІІ і VІІІ ювілейному з’їздах Всеукраїнського лікарського товариства (Тернопіль, 2003; Івано-Франківськ, 2005), VII, ІХ і Х Конгресах Світової Федерації Українських Лікарських Товариств (Львів, Трускавець, 2000; Луганськ, 2002; Чернівці, 2004), на V Міжнародному медичному конгресі студентів і молодих вчених, приуроченому до 10-ї річниці незалежності України (Тернопіль, 2001), міжнародних конференціях пам’яті Р. Вейгля International Weigl Conference "Microorganisms in Pathogenesis and their Drug Resistance" (Lviv, 2003), "Chemistry of Nitrogen Containing Heterocycles" (Kharkiv, 2003), "Новые технологии получения и применения биологически активных веществ" (Алушта, 2002), "Оздоровчі ресурси Карпат і прилеглих регіонів" (Чернівці, 1999), міжнародних науково-практичних конференціях "Лекарства – человеку" (Харків, 2000), "Пробіотики – ХХІ століття: Біологія. Медицина. Практика" (Тернопіль, 2004), IV Українській науково-практичній конференції з міжнародною участю з клінічної фармакології "Актуальні питання фармакології" (Вінниця, 2004), Всеукраїнській науково-практичній конференції з міжнародною участю "Сучасні досягнення фармацевтичної науки та практики" (Запоріжжя, 2006), XXІ Українській конференції з органічної хімії (Чернігів, 2007), науково-практичних конференціях з міжнародною участю "Сепсис: Проблеми діагностики, терапії та профілактики" (Харків, 2006), "Науково-технічний прогрес і оптимізація технологічних процесів створення лікарських препаратів" (Тернопіль, 2006), "Сучасний стан і актуальні проблеми ортопедичної стоматології" (Івано-Франківськ, 2005), регіональній науково-практичній конференції "Антибіотикотерапія у внутрішній медицині і хірургії" (Івано-Франківськ, 2006), на Всеукраїнському науково-практичному семінарі "Перспективи створення в Україні лікарських препаратів різної спрямованості дії" (Харків, 2004), 9-ій науковій конференції "Львівські хімічні читання – 2003" (Львів, 2003), науковій конференції, присвяченій 100-річчю з дня народження проф. Калини Георгія Платоновича "Розвиток санітарної мікробіології в Україні" (Чернівці, 2002), на науковій конференції, присвяченій 50-й річниці з часу заснування Івано-Франківської державної медичної академії (Івано-Франківськ, 1995), на підсумкових наукових конференціях Івано-Франківського державного медичного університету (1998, 2003, 2007), на засіданнях Івано-Франківського обласного товариства мікробіологів і епідеміологів.
Публікації. За темою дисертації опубліковано 76 наукових робіт, серед них 37 статей у фахових наукових журналах і збірниках, рекомендованих ВАК України для публікації результатів дисертаційних досліджень, отримано 6 патентів України на корисні моделі і винаходи (і 1 позитивне рішення за заявкою на винахід), підготовлено до друку монографію.
Структура дисертації. Дисертаційна робота викладена на 319 сторінках комп’ютерного тексту, містить вступ, огляд літератури, розділ матеріалів і методів досліджень, 7 розділів власних досліджень з 40 рисунками і 63 таблицями, розділ аналізу та узагальнення одержаних результатів, висновки, практичні рекомендації, список використаної літератури, який налічує 494 джерела (85 кирилицею і 409 латиною), а також 14 додатків, викладених у окремому томі на 289 сторінках.
Основний зміст роботиУ вступі проаналізовано фактори, які сприяють формуванню і поширенню поліантибіотикорезистентних штамів стафілококів у сучасних умовах. Наголошується на відсутності у вітчизняних лікувальних закладах систем мікробіологічного моніторингу та протиінфекційного контролю, що призводить до порушення основних принципів застосування протимікробних препаратів. Обгрунтовано актуальність теми дисертаційного дослідження, викладено мету та завдання, які розв’язувались при його виконанні. Визначено зв’язок роботи з державними науковими програмами, розкрито наукову новизну і практичне значення здобутих результатів, наведено дані щодо апробації дослідження, вказано обсяг і структуру дисертації.
У першому розділі подано огляд літератури, в якому стисло викладено проблему глобального поширення у світі MRSA і MR-CNS, охарактеризовано їх роль у виникненні опортуністичних та нозокоміальних інфекцій в сучасних умовах. Акцентовано увагу на механізмах метіцилінрезистентності стафілококів та їх асоційованої резистентності до антибіотиків інших груп, синтетичних хіміотерапевтичних засобів, антисептиків, дезинфектантів. Крім того, критично проаналізовано сучасні засоби і підходи до лікування інфекцій, спричинених MRS.
У другому розділі охарактеризовано матеріали, методи та обсяг виконаних досліджень. Із 1990 р. виконується постійний моніторинг за характером мікрофлори, що виділяється від пацієнтів у лікувальних закладах різного профілю м. Івано-Франківська і області. На основі комп’ютерної програми WHONET 5.1 (http: // www. who. int/drugresistance/whonetsoftware/en/) створена постійно поповнювана база даних, яка містить результати мікробіологічного дослідження різних видів клінічного матеріалу (включаючи антибіотикограми збудників) з докладною інформацією про відповідних пацієнтів. Проаналізовано результати вивчення чутливості до антибіотиків різних груп 9980 ізолятів стафілококів (4271 штамів, або 42,80% S. aureus і 5709 штамів, або 57, 20% CNS), виділених на Прикарпатті в 1990-2006 рр., досліджено епідеміологічні аспекти поширення MRS.
Для поглибленого мікробіологічного дослідження з визначенням профілів та детермінант антибіотикорезистентності відібрано 530 штамів стафілококів клінічного походження (в тому числі 204 штами S. aureus і 326 штамів CNS), які ідентифікували відповідно до рекомендацій 12-го видання "Визначника бактерій Берджі" за комплексом культуральних і біохімічних властивостей ("STAPHYtest 16", Lachema, Чехія). Крім того, в роботі використано 17 колекційних штамів стафілококів з Музею патогенних мікроорганізмів ДУ "Інститут мікробіології та імунології ім. І.І. Мечникова АМНУ" (м. Харків). Чутливість клінічних і колекційних ізолятів до антибіотиків визначали дискодифузійним методом на середовищі Мюллера–Хінтона з 4% хлориду натрію згідно з рекомендаціями Національного комітету клініко-лабораторних стандартів (NCCLS) США (1999), а також методами серійних розведень в агарі (Красильников А.П., 1995) та бульйоні (Thornsberry C. etc., 1983).
Ідентифікацію метіцилінрезистентних штамів стафілококів здійснювали на основі визначення чутливості до оксациліну методом двократних серійних розведень в сольовому агарі Мюллера–Хінтона та виявлення пеніцилін-зв’язуючого білка PBP2ў (продукту гена mecA) методом латекс-аглютинації (Slidex® MRSA Detection, bioMerieux, Франція). Ідентифікацію ефлюксного механізму резистентності до фторхінолонів здійснювали на основі зміни чутливості ізолятів до ципрофлоксацину в присутності специфічних інгібіторів помпи NorA – 20 мкг/мл резерпіну (Gibbons S. etc., 2003) і 25 мкМ верапамілу (Ince D. і Hooper D. C., 2001). Ефлюксний механізм резистентності стафілококів до макролідів (помпа MsrA) виявляли за зміною чутливості штамів до еритроміцину в присутності суббактеріостатичної концентрації (0,5 мкМ/мл) арсенату натрію (Wondrack L. etc., 1996). Крім того, вивчали чутливість клінічних ізолятів стафілококів до тетрацикліну в присутності 30 мкг/мл резерпіну – неспецифічного інгібітора помпи TetK (Gibbons S. і Udo E. E., 2000; Gibbons S. etc., 2003). Протимікробні концентрації антибіотиків та їх комбінацій з відомими інгібіторами ефлюксних механізмів резистентності визначали мікрометодом серійних розведень в бульйоні (Thornsberry C. etc., 1983).
Виконано первинний мікробіологічний скринінг 316 нових синтетичних гетероциклічних сполук (похідних тіазолідину, тіазолу, фурану, хіноліну та акридину) і 359 рослинних екстрактів (з них 203 водно-етанольні, 156 – органічні) різних органів 155 культивованих і дикоростучих лікарських рослин флори України. Скринінгові дослідження виконано за допомогою розробленої мікромодифікації методу дифузії в агар. Активні препарати досліджено методами серійних розведень в агарі та бульйоні з використанням сформованих тестувальних панелей колекційних і клінічних штамів стафілококів. З метою оцінки і порівняльного аналізу протистафілококової активності препаратів визначали їх ефективні діючі концентрації для груп штамів, сформованих в межах загальної вибірки за ознаками видової належності та антибіотикорезистентності: МБцК90 і МБцК50 (бактерицидні концентрації для 90% і 50% тест-штамів відповідно), МБсК90 і МБсК50 (бактеріостатичні концентрації для 90% і 50% тест-штамів), середні геометричні значення. МБцК і МБсК, співвідношення МБцК/ /МБсК. На основі спостережень за динамікою росту періодичних культур стафілококів визначали коефіцієнти відносного пригнічення росту в присутності різних концентрацій препаратів, розраховували значення ІС50 (концентрацій, що викликають пригнічення росту мікробних культур на 50%) в різні терміни експерименту. За допомогою пробіт-аналізу розраховували також значення Ki – концентрації, яка зумовлює двократне збільшення тривалості часу генерації клітин у логарифмічній фазі росту культур (Sompolinsky D. etc., 1973).
Для вияснення впливу особливостей структури синтетичних сполук на їх протимікробну активність використано QSAR (Quantitative structure-activity relationships) підхід (Khan N. etc., 2006, Kuz’min V. E. etc., 2002). Створені QSAR-моделі дозволили здійснити віртуальний дизайн структур з потенційною протимікробною активністю. Окремі теоретично змодельовані структури було синтезовано, і їх активність відносно MRS підтверджено експериментально.
Комп’ютерне моделювання зв’язування похідних тіазолідину з активним центром ферменту біосинтезу пептидоглікану MurB (гнучкий докінг) проведено з допомогою програми Glide (®Maestro, Macromodel, Schrodinger L. L. C), яка оцінює зв’язування ліганду та мішені з допомогою двох різних скорінгових функцій GlideScore (GS) та EnergyModel(EM) (в т. ч. енергії утворення водневих зв’язків, Ван-дер-Ваальсових взаємодій тощо). Альтернативне докінгове дослідження проведено програмою Fred (®Vida2, Omega, Fred, OpenEye Scientific Software). Для докінгових досліджень структури ферменту MurB обрані з Protein Data Bank (PDB, http: // www. rcsb. org/pdb) з кодами: 2MBR – структура виділена з E. coli (Benson T. E. etc., 1997) та 1HSK – структура виділена із S. аureus (Benson T. E. etc., 2001). Пошук моделей з багатьма змінними та відбір дескрипторів проведено за методом часткових найменших квадратів з використанням програм QSAR (®Gaussian03, Gaussian, Inc) та BuildQSAR (De Oliveira D. B., Gaudio A. C., 2000).
Для скринінгової оцінки синергізму дії синтетичних сполук і рослинних екстрактів з антибіотиками відносно стафілококів застосовану оригінальну просту та достатньо чутливу методику (Патент України UA № 27939). В якості тест-штаму використано докладно охарактеризований авторський штам S. aureus "Кунда" (MecA+NorA+MsrA+TetK+). Крім того, мікрометодом серійних розведень в бульйоні визначали ефективні протимікробні концентрації препаратів при їх ізольованому та поєднаному застосуванні. Біоавтографічні дослідження екстрактів виконано за методом A. Nostro і співавт. (2000).
Фармакологічну активність відібраних рослинних екстрактів оцінювали також за їх здатністю пригнічувати адгезію стафілококів до клітин буккального епітелію людини (Ellen R. P. і Gibbons R. J., 1974), гальмувати розвиток проліферативної фази запалення на моделі ватяної гранульоми (D’Arcy P. F. etc., 1960), індукувати продукцію IFN і TNF в культурах клітин in vitro (Ершов Ф.И. і співавт., 1988; Meager A. etc., 1989). В дослідах in vivo на мишах вивчали вплив рослинних екстрактів на інтерфероновий статус організму (рівень сироваткового IFN, здатність спленоцитів в умовах in vitro синтезувати IFN-б у відповідь на введення віруса хвороби Ньюкастл та IFN-г у відповідь на введення ФГА), фагоцитарну активність макрофагів перитонеального ексудату відносно S. aureus 209-Р (Бутенко Г.М. і співавт., 2001) та їх киснево-залежну кіллерну активність в НСТ-тесті (Грачева М.П., 1984).
Токсикологічні дослідження окремих препаратів включали вивчення їх цитотоксичності in vitro в культурі перитонеальних макрофагів мишей (Вильнер Л.М., 1977). Гостру токсичність сполук in vivo оцінювали при різноманітних шляхах введення за значеннями максимально переносимих (МПД) і летальних доз (LD10, LD50 і LD90), встановленими методом пробіт-аналізу (Біленький М.Л., 1963). Також вивчали ефект кумуляції (Гацура В.В., 1974) та подразнюючу дію препаратів (Ієвлєва Е.А., 1974).
Для статистичної обробки результатів мікробіологічних та імунологічних експериментів застосовано методи варіаційної статистики, одно - і двовибірковий F-тест для дисперсії, кореляційний, лінійний регресійний, одно - і двофакторний дисперсійний (ANOVA), багатофакторний об’єднуючий кластерний аналіз, пробіт-аналіз із використанням спеціалізованих комп’ютерних програм WHONET 5.1, UTHSCSA ImageTool 2.0, STATISTICA for Windows 5.0, MSOffice Excel 2003.
Результати власних досліджень викладені у наступних семи розділах дисертації (3-9).
Аналіз чутливості сучасних клінічних штамів стафілококів до антибіотиків та антисептиків. Створена система моніторингу за збудниками опортуністичних і внутрішньолікарняних інфекцій дозволила з’ясувати особливості епідеміології MRS і штамів з пограничною метіцилінрезистентністю у Прикарпатському регіоні в 1990-2006 рр. У загальній структурі ізолятів стафілококів, визнаних етіологічними чинниками опортуністичних і госпітальних інфекцій, частка MRSA становить 27,0%, MR-CNS – 22,7%, штамів з пограничною метіцилінрезистентністю – 20,6% (BSSA) і 24,4% (BS-CNS). В нестаціонарних умовах MRS виступають в ролі етіологічних факторів нагнійних і запальних процесів значно рідше (4,9-8,8%). За частотою виділення стафілококів з пограничною метіцилінрезистентністю (18,6-23,0%) амбулаторні пацієнти майже не відрізняються від стаціонарних. Основними видами клінічного матеріалу, в якому присутні MRSA є гній, раневий ексудат та мазки з носоглотки. MR-CNS, крім того, досить часто виділяються із сечостатевого тракту. У цих же видах клінічного матеріалу часто присутні стафілококи з пограничною резистентністю до метіциліну. Основна частка MR-ізолятів стафілококів походить від пацієнтів хірургічного профілю. Серед CNS клінічного походження MR-ізоляти належать переважно до видів S. haemolyticus і S. cohnii ssp. cohnii, а BS-штами представлені в основному S. epidermidis і S. haemolyticus. Епідеміологічний аналіз дозволив встановити сезонні та вікові особливості поширення інфекцій, спричинених MRS. На основі співставлення антибіотикотипів виділених штамів ідентифіковано ряд внутрішньолікарняних спалахів MRS-інфекції у великих багатопрофільних стаціонарах. За схильністю до внутрішньогоспітального епідемічного поширення MRS розташовуються в наступному порядку: MRSA > MR-CNS >> BSSA > BS-CNS.
З’ясовано регіональні особливості чутливості до антибіотиків різних груп виділених MR - і BS-штамів S. aureus та CNS. Регіональні ізоляти MRS закономірно характеризуються значною резистентністю до цефалоспоринів, але 66,7-80,0% з них виявляють чутливість до карбапенемів (іміпенему і меропенему). Водночас штами MRSA і MR-CNS володіють високою частотою асоційованої резистентності до аміноглікозидів ІІ покоління (62,5-82,7%), макроділів (66,7-100,0%), лінкозамідів (50,0-96,7%), тетрациклінів (73,9-92,4%), нітрофуранів (60,0-85,7%). Лише 33,3-57,2% ізолятів MRSA проявляють задовільну чутливість до рифампіцину і фузидину. Чутливість до фторхінолонів проявляють 25,0-48,2% штамів MRSA, 25,0-57,1% MR-CNS, 50,0-75,2% BSSA і 50-70,9% BS-CNS. За допомогою регресійного аналізу визначено математичні лінійні функції, які описують темпи набування регіональними ізолятами MR-стафілококів резистентності до офлоксацину. У 1998-2004 рр. спостерігалася стабільна швидкість втрати чутливості до офлоксацину в межах 2,83% штамів на рік, яка за останні 2 роки дещо сповільнилася (до 1,83% штамів на рік).
Регіональні клінічні ізоляти MRS в цілому володіють задовільною чутливістю до ванкоміцину. Середній рівень чутливості до ванкоміцину в штамів MRSA вищий (МПК 2,35 мкг/мл), ніж у MR-CNS (МПК 3,89 мкг/мл). Проте в лікувальних закладах м. Івано-Франківська зареєстровано внутрішньолікарняні спалахи інфекції ванкоміцинрезистентними (VR-) стафілококами та штамами із зниженим рівнем чутливості до ванкоміцину, випадки носійства (в тому числі назофарингеального) цих мікроорганізмів серед клінічно здорових осіб, що робить загрозу їх глобального поширення у регіоні цілком реальною. Серед ізолятів MRSA виявлено 1,93% штамів VISA (S. aureus з помірною чутливістю до ванкоміцину, МПК 8 мкг/мл). Серед клінічних штамів MR-CNS частота поширення VI-CNS становить 12,0%, VR-CNS (з МПК 16-32 мкг/мл) – 6,0%. Переважна більшість VI-CNS і VR-CNS належить до S. haemolyticus (66,6% виявлених ізолятів).
На основі цілеспрямованого пошуку і відбору сформовано тестувальні панелі сучасних клінічних штамів стафілококів з різними профілями антибіотикорезистентності для вивчення протимікробних властивостей природних і синтетичних сполук. У цих штамів фенотипічно ідентифіковано класичну детермінанту метіцилінрезистентності (продукцію пеніцилінзв’язуючого білка PBP2¢) та детермінанти асоційованої резистентності до антибіотиків інших груп, зокрема ефлюксні механізми резистентності до фторхінолонів (помпа NorA), макролідів (MsrA), тетрациклінів (TetK).
Пошук похідних 4-азолідонів з активністю відносно MRS. В результаті тотального високоефективного скринінгу 154 нових синтетичних сполук з тіазолідиновими і спорідненими гетероциклами на 6 штамах MecA– і 7 штамах MecA+ стафілококів та наступного тестування на 50 клінічних ізолятах S. aureus і CNS ідентифіковано три нові класи похідних 4-азолідонів із значною протимікробною активністю відносно MRS:
5- [2-(арилметилокси) - 5-нітрофеніл] метиліден-2-тіоксотіазолідин-4-они;
2,4,5-тризаміщені 4-спіранові похідні тіазолідин-2-ону з піразолобензоксазиновим фрагментом;
похідні 6-оксо-5,6-дигідро [1,3] тіазоло [2,3-b] [1,2,4] тріазол-6-ону.
Досліджені 5-ариліден-2-тіоксотіазолідин-4-они є новою групою ефективних інгібіторів ферментів біосинтезу пептидоглікану S. aureus – MurC (Sim M. M. etc., 2002) і MurG (Helm J. S. etc., 2003). Встановлено критичний позитивний вплив 2-тіоксотіазолідин-4-онового фрагменту в поєднанні з 2-бензилокси-5-нітрофенілметиліденовим радикалом на антимікробну дію. В якості оптимальної структури з протистафілококовою активністю ідентифіковано 5- [2-бензилокси-5-нітрофеніл] метиліден-2-тіоксотіазолідин-4-он (сполука L131). Подальше ускладнення каркасу молекули за рахунок введення додаткових замісників у 2-бензилокси-5-нітрофенілметиліденовий залишок і особливо у різні позиції тіазолідинового циклу негативно відображається на протимікробній активності. Сполука L131 володіє мікромолярним діапазоном протимікробної активності відносно стафілококів (для MecA- S. aureus МБсК 3,85 мкг/мл, МБцК 19,55 мкг/мл; для MecA+ S. aureus – 6,73 і 26,48 мкг/мл відповідно). Її протистафілококова активність близька до активності хлоргексидину та етонію і значно переважає інші антисептики порівняння (ріванол, тімол, мірамістин, повідон-йодид).
Встановлено, що 4-спіранові похідні тіазолідин-2-ону з піразолобензоксазиновим фрагментом відносно MRSA активніші, ніж відносно MSSA. При цьому 2,4-дизаміщені спіранові похідні помітно поступаються за активністю 2,3,4-тризаміщеним і особливо 2,4,5-тризаміщеним. Структурою-лідером на основі проведеного тестування визначено сполуку L115 – 5-феніл-1,10b-дигідропіразоло [1,5-с] [1,3] бензоксазино-2-спіро-4¢- [5¢-(2¢¢-хлор) - бензилметиліден] тіазолідин-2¢-он (відносно MRSA МБсК 20,66 мкг/мл, МБцК 48,68 мкг/мл).
В ході докінгових і 3D-QSAR досліджень перевірено гіпотезу про можливість блокування 4-спірановими похідними тіазолідин-2-ону з піразолобензоксазиновим фрагментом активного центру ензиму MurB синтезу пептидоглікану (рис.1).
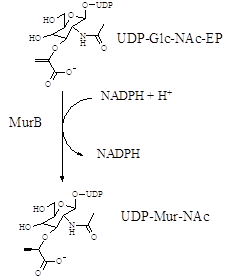
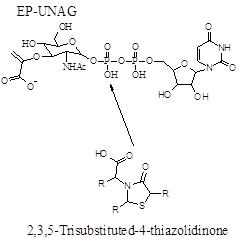
Рис.1. Біохімічна роль ензиму MurB та імітування похідними 4-тіазолідонів фосфатної групи його природного ліганду.
Задовільні значення скорінгових функцій, що оцінюють якість та енергію зв’язування докованих лігандів (досліджуваних сполук) з молекулою мішені отримано лише для структури 1HSK ферменту MurB S. aureus. Гіпотеза про можливість імітування взаємодії фрагменту фосфатної групи уридиндифосфат-N-ацетилглюкозаміну енолпірувату (Andres C. J. etc., 2000) підтвердилася тільки для активних щодо стафілококів сполук L115 та L103. Cаме 2-оксо-група при тіазолідиновому циклі в цих сполуках відтворює водневі зв’язки атома оксигену фосфату (природнього ліганду UDP-Glc-NAc-EP) з атомами водню амінокислотних залишків Gly-67 та Gly-65 ензиму MurB. У результаті аналізу докованих позицій визначено можливі шляхи модифікації структури для сполук-лідерів з метою покращення афінітету до MurB та протимікробної активності.
На основі виконаних досліджень запропоновано стратегію пошуку нових протимікробних сполук серед 4-азолідонів та споріднених гетероциклічних систем, яка включає комбінаторний підхід до синтезу з комп’ютерною систематизацією даних, поєднання традиційного та віртуального скринінгу і дизайну, QSAR-аналіз. Визначено структурні вимоги для молекулярного дизайну антимікробних 4-азолідонів та споріднених гетероциклічних систем.
Із врахуванням прогностичних даних 2D-QSAR аналізу шляхом цілеспрямованого синтезу отримано похідні 6-оксо-5,6-дигідро [1,3] тіазоло [2,3-b] [1,2,4] тріазол-6-ону (сполуки L-1558 і L-1369), активність яких поширюється на MS - і MR-стафілококи (для MRSA МБсК 18,57-27,60 мкг/мл, МБцК 41,02-74,30 мкг/мл). Співвідношення МБцК/МБсК (2,00-3,17) і характер кривих, що характеризують динаміку росту культур MSSA і MSRA, вказують на не різко виражену бактерицидну активність сполук L-1558 і L-1369. За здатністю викликати двократне продовження тривалості періоду генерації (Ki) в культурах MecA– і MecA+ S. aureus сполуки L-1558 і L-1369 практично не відрізняються (65,0-65,4 мкг/мл для MecA– S. aureus 209-Р і 63,8-75,0 мкг/мл для MecA+ S. aureus "Кунда").
В ході досліджень встановлено, що 55,0% сполук із випадково сформованої вибірки похідних 4-азолідонів істотно підвищували чутливість до оксациліну MecA+ S. aureus "Кунда". Найбільш активними у цьому відношенні виявилися похідні 5- [2-(R-бензилокси) - 5-нітрофенілметиліден] -2-тіоксотіазолідин-4-онів (сполуки L-127 і L-1985). Виражений синергізм з оксациліном спостерігався при концентраціях вказаних сполук 12,5 мкг/мл (1/8–1/16 їх МПК для тест-штаму). Дещо слабшу, але стабільно постійну здатність потенціювати протимікробну дію оксациліну відносно MRSA проявили похідні 2-оксо-норборнено [2¢,3¢; 5,6] тіопірано [2,3-d] [1,3] тіазолу (2 сполуки із 2 тестованих: L149 і L1445), 4-ізонікотиноїлгідразонові похідні 2-оксотіазолідину (4 сполуки із 4 тестованих: Ш-17, Ш-20, Ш-21 і Ш-22), а також отримані шляхом цілеспрямованого синтезу на основі прогностичних даних 2D-QSAR аналізу N-(R-феніл) - тіазол-5-іл-ацетаміди (сполуки L-1558 і L-1995).
Невисока токсичність (V клас безпеки), властива похідним 4-азолідонів, в поєднанні з виразною специфічною фармакологічною активністю (пряма протимікробна дія та здатність до синергічної взаємодії з b-лактамними антибіотиками) є вагомими аргументами для поглибленого вивчення цих сполук як нових потенційних препаратів для боротьби з антибіотикорезистентними штамами мікроорганізмів, передусім MRS. Одержані результати свідчать, що ферменти ранніх етапів біосинтезу пептидоглікану (MurB, MurC, MurG) можуть розглядатися в якості важливих нових мішеней для дії протимікробних засобів у клітинах MRSA.
Дослідження протимікробної активності похідних фурану і тіазолу відносно MRS. Найперспективнішим класом сполук, які проявляють стабільно високу активність відносно стафілококів, у тому числі їх клінічних поліантибіотикорезистентних штамів, визначено похідні 2-(5-арил-2-фурил) - 4-хінолінкарбонових кислот (Патент України UA №23769). На основі аналізу "структура – активність" встановлено роль заміщуючих радикалів у різних позиціях базисних каркасів для вияву молекулами протимікробних властивостей, накреслено шляхи для подальшої оптимізації вказаних структур. Відносно MSSA найбільш активними є похідні з двома атомами галогену (Cl, Br) в різних позиціях бензольного кільця 5-R-феніл-2-фурильного фрагмента молекули (сполуки V042, V043, V044, V045). Відносно MRSA і MR-CNS високу активність проявляють похідні з галогеновими замісниками (Cl, Br) в позиції С6 хінолінового ядра і аліфатичними замісниками (ізо-пропіл, втор-бутил, метил) в пара-положенні бензольного кільця 5-R-феніл-2-фурильного фрагмента (сполуки V051, V052, V053). Вказані сполуки можна рекомендувати для поглиблених мікробіологічних досліджень в якості потенційних кандидатів у лікувальні засоби.
Протистафілококова активність похідних оксополігідроакридинів. Встановлено високий рівень бактерицидної активності відносно сучасних клінічних штамів S. aureus і CNS (незалежно від їх метіцилінрезистентності та рівнів асоційованої резистентності до фторхінолонів, тетрациклінів та макролідів) похідних 1-оксо-3,3-диметил-10-R-феніл-1,2,3,4-тетрагідробензо [j] акридинію та 1,8-діоксо-3,3,6,6-тетраметил-1,2,3,4,5,6,7,8,9,10-декагідроакридину. Сполука М116 – 1-фенілгідразил-3,3-диметил-10-(4-метил) феніл-1,2,3,4-тетрагідробензо [j] акридинію бромід (для MRSA МБсК 3,98 мкг/мл, МБцК 7,04 мкг/мл), яка характеризується значним хіміотерапевтичним індексом (61-163 при пероральному і 15-80 при парентеральному введенні), може розглядатися в якості перспективного кандидата у лікувальні засоби.
Дослідження протистафілококової активності четвертинних солей циклопента [с] хінолінію. Новим класом сполук з вираженою бактерицидною активністю (0,8-1,56 мкг/мл) відносно стафілококів, включаючи штами MRSA і MR-CNS, є четвертинні солі N-феніл-6-(4-диметиламінобензиліден) циклопента [с] хінолінію, проте вони характеризуються високим рівнем гострої токсичності (LD50 25,6? 56,0 мг/кг).
Дослідження протимікробної активності рослин флори України відносно поліантибіотикорезистентних клінічних штамів стафілококів. На основі цілеспрямованого тестування 203 водно-етанольних екстрактів різних органів 155 лікарських рослин флори України виявлено природні джерела сполук з високим рівнем протимікробної активності відносно MRS, придатних для створення нових лікувальних засобів (слань цетрарії ісландської Cetraria islandica (L) Ach. та евернії сливової Evernia prunastri (L) Ach., бруньки берези бородавчастої Betula verrucosa Ehrh. та тополі чорної Populus nigra L., трава і суцвіття гринделії розчепіреної Grindelia squarrosa (Pursh) Dun., кореневища гірчака зміїного Polygonum bistorta L., кермеку Мейєра Limonium meyeri (Boiss) O. Kuntze і кермеку південнобузького Limonium hypanicum Klok., листя мучниці звичайної Arctostaphylos uva-ursi (L) Spreng. та ін). Розроблено оптимальні способи екстрагування, які дозволяють одержати з рослинної сировини комплекси сполук, що володіють не тільки прямою протимікробною активністю відносно MRS, але й антиадгезивними, протизапальними та імуномодулюючими властивостями (табл.1). Виявлено нові природні джерела індукторів ендогенного IFN і TNF-a. Водно-етанольні екстракти коренів живокосту лікарського Symphytum officinalis L. і пагонів омели білої Viscum album L. проявляють імуномодулюючі властивості також в умовах дослідів in vivo.
Таблиця 1
Спектр біологічних властивностей 90% водно-етанольних екстрактів лікарських рослин
| № п/п | Рослинні екстракти | Частини рослин | Протимікробна дія | Пригнічення адгезії | Протизапальна дія | Індукція ендогенного | Антибіотикопотенціююча активність | ||||||||||||||||||||||
| IFN | TNF | OXA | CIP | TET | ERY | ||||||||||||||||||||||||
| 1. | 2. | 3. | 4. | 5. | 6. | 7. | 8. | 9. | 10. | 11. | 12. | ||||||||||||||||||
| 1. | Arctostaphylos uva-ursi (L) Spreng. Мучниця звичайна | лис. | ++ | ++ | ND | – | ND | +++ | +/– | + | + | ||||||||||||||||||
| 2. | Betula verrucosa L. Береза бородавчаста | бр. | +++ | ++ | +++ | ++ | – | ++++ | ++++ | ++++ | ++++ | ||||||||||||||||||
| 3. | Biota orientalis (L) Endl. Біота східна (Широкогілочник східний) | хвоя, пл. | +++ | +/– | + | – | ++ | ++ | + | ND | +++ | ||||||||||||||||||
| 4. | Calendula officinalis L. Нагідки лікарські | суцв. | + | +++ | ND | +++ | – | – | ++ | – | +/– | ||||||||||||||||||
| 5. | Cetraria islandica (L) Ach. Цетрарія ісландська ("Ісландський мох") | слань | +++ | +++ | ++ | ++ | – | ++ | +/– | +++ | +/– | ||||||||||||||||||
| 6. | Cotinus coggygria Scop. Скумпія звичайна | лис. | ++ | – | ND | + | ND | +++ | + | +++ | + | ||||||||||||||||||
| 7. | Evernia prunastri (L) Ach. Евернія сливова ("Дубовий мох") | слань | + | +++ | +/– | ++ | – | ++ | – | +++ | – | ||||||||||||||||||
| 8. | Geranium pratense L. Герань лучна | корен. | ++ | +/– | ND | +/– | ND | ++ | + | + | +/– | ||||||||||||||||||
| 9. | Ginkgo biloba L. Гінкго дволопатеве | лис. | +/– | +++ | + | ++ | – | ++ | +/– | ND | + | ||||||||||||||||||
| 10. | Grindelia squarrosa (Pursh) Dun. Гринделія розчепірена | н/ч | ++ | +++ | +++ | + | + | ++ | + | ++ | – | ||||||||||||||||||
| 11. | Hypogymnia physodes (L) Nyl. Гіпогімнія здута | слань | +++ | ND | ND | +++ | – | ++++ | – | ND | ++ | ||||||||||||||||||
| 12. | Juniperus communis L. Ялівець звичайний | хвоя | +++ | +++ | ND | – | ND | + | + | ND | +/– | ||||||||||||||||||
| 13. | Limonium hypanicum Klok. Кермек південнобузький | кор. | ++ | ND | ND | +++ | – | +++ | – | +/– | – | ||||||||||||||||||
| 14. | Limonium meyeri (Boiss) O. Kuntze Кермек Мейєра | кор. | ++ | ++ | ND | + | – | ++ | – | +/– | – | ||||||||||||||||||
| 15. | Populus nigra L. Тополя чорна (Осокір) | бр. | ++ | ++ | ND | +/– | – | +++ | +++ | ++++ | +++ | ||||||||||||||||||
| 16. | Potentilla erecta (L) Rausch. Перстач прямостоячий (Калган) | корен. | ++ | ND | ND | + | ND | +++ | ++ | ++ | + | ||||||||||||||||||
| 17. | Rhododendron kotschyi Simonk. Рододендрон східнокарпатський | лис. | ++ | ND | ND | ++ | – | +/– | +/– | – | +/– | ||||||||||||||||||
| 18. | Rhus coriaria L. Сумах дубильний | лис. | +/– | ND | ND | + | – | ++ | ++ | +/– | – | ||||||||||||||||||
| 19. | Polygonum aviculare L. Спориш звичайний | н/ч | – | ND | ND | ++ | +++ | – | +/– | + | – | ||||||||||||||||||
| 20. | Polygonum bistorta L. Гірчак зміїний | корен. | ++ | – | +++ | +++ | – | +++ | ++ | ++ | + | ||||||||||||||||||
| 21. | Salix aurita L. Верба вушката | кора | + | + | ND | ND | ND | +++ | – | ++ | – | ||||||||||||||||||
| 22. | Sanguisorba officinalis L. Родовик лікарський | кор. | ++ | + | ND | + | – | ++ | – | ND | – | ||||||||||||||||||
| 23. | Sieversia montana (L) R. Br. Сіверсія гірська | корен. | ++ | + | ND | ++ | – | +++ | – | ND | – | ||||||||||||||||||
| 24. | Thea sinensis L. Чай китайський | лис. | +++ | ++ | ND | +/– | ND | +++ | – | ++++ | ++ | ||||||||||||||||||
| 25. | Vaccinium myrtillus L. Чорниця | н/ч | + | ND | ND | +++ | – | + | – | +/– | +/– | ||||||||||||||||||
| 26. | Vaccinium vitis-idaea L. Брусниця | н/ч | + | ND | ND | +++ | – | ++ | – | – | +/– | ||||||||||||||||||
| 27. | Viscum album L. Омела біла | н/ч | +/– | – | ND | +++ | ++ | +/– | – | ND | +/– | ||||||||||||||||||
Примітки: 1. ND – показник не вивчали; OXA –, CIP –, ERY –, TET –
2. Градація ступеня зниження МПК антибіотиків у присутності екстрактів: +/- - в 2-4 рази, + - у 4-8 разів, ++ - у 16-32 рази, +++ - у 64-128 разів, ++++ - > 128 раз.
3. Частини рослин: бр. – бруньки, лис. – листки, суцв. – суцвіття, пл. – плоди, н/ч – надземна частина, кор. – корені, корен. – кореневища.
Доведено їх стимулюючий вплив на інтерфероновий статус піддослідних тварин (підвищення титрів сироваткового IFN, продукції спонтанного IFN та стимульованого ФГА IFN-g спленоцитами), поглинальну здатність макрофагів перитонеального ексудату при фагоцитозі S. aureus 209-P, киснево-залежну бактерицидну активність у спонтанному НСТ-тесті та функціональний резерв фагоцитів
Антибіотикопотенціюючі властивості рослин флори України. Розроблено оригінальну просту і достатньо чутливу методику для скринінгової оцінки синергізму дії біологічно активних сполук рослинних екстрактів з антибіотиками відносно стафілококів (Патент України UA №27939). Рослинні екстракти наносяться у вигляді плям діаметром до 1,0 см на на пластинки із силікагелем для тонкошарової хроматографії "Sorbfil", після чого їх заливають розплавленим і остудженим поживним агаром з антибіотиком в концентрації 1/2-1/4 МПК, попередньо свіжо засіяним тест-культурою в кінцевій концентрації 107 КУО/мл. Контрольні дослідження виконуються з використанням поживного середовища без антибіотиків. Для виявлення життєздатних бактерій і контрастування зон відсутності або пригнічення росту піcля інкубації в термостаті впродовж доби агар обробляють 1% водним розчином 1,3,5-трифенілтетразолію хлориду. Посіви повторно інкубують в термостаті впродовж 2 год. При цьому ділянки інтенсивного росту культури добре контрастуються формазаном (рис.2). Метричний аналіз цифрових зображень здійснюється за допомогою спеціалізованої комп’ютерної програми UTHSCSA ImageTool 2.0 (http: // ddsdx. uthscsa. edu). Застосування в якості тест культури штаму MRSA "Кунда" з детально охарактеризованими детермінантами резистентності дозволило виявити присутність у рослинній сировині інгібіторів класичного механізму метіцилінрезистентності стафілококів (пов’язаного з продукцією PBP2¢), а також ефлюксних механізмів резистентності NorA, MsrA, TetK.
Валідність запропонованої скринінгової методики підтверджено співставленням результатів тестування 36 рослинних екстрактів з відповідними даними, отриманими за допомогою традиційного методу "титрувальної тест-панелі" ("сheckerboard titration"), що звичайно використовується для вивчення синергізму протимікробної дії. Принципового розходження результатів при цьому не спостерігалося. Не було зафіксовано жодного хибно позитивного результату скринінгового тестування. Рівень чутливості запропонованого скринінгового методу знаходиться в межах 97,22±2,74%.
На основі тестування 203 водно-етанольних екстрактів встановлено, що найбільш перспективними представниками флори України для пошуку модифікаторів антибіотикорезистентності бактерій є лишайники родин пармелієві (Parmeliaceae) і уснеєві (Usneaceae); папороті родини щитникові (Aspidaceae) та покритонасіні родин сумахові (Anacardiaceae), селерові (Apiaceae), айстрові (Asteraceae), шорстколисті (Boraginaceae), вересові (Ericaceae), букові (Fagaceae), геранієві (Geraniaceae), лілійні (Liliaceae), кермекові (Limoniaceae), розові (Rosaceae), вербові (Salicaceae).
Синергічна взаємодія рослинних екстрактів із терапевтичними концентраціями класичних антибіотиків відносно полірезистентних стафілококів проявляється в діапазоні концентрацій екстрагованих речовин 5-200 мкг/мл, що відповідає рівням розведень екстрактів (1: 160 - 1: 5210), які не володіють цитотоксичними властивостями.
Виконано поглиблене дослідження антибіотикопотенціюючих властивостей бруньок берези бородавчастої Betula verrucosa Ehrh. (Gemmae Betulae), які є фармакопейною лікарською сировиною. Водно-етанольний екстракт бруньок берези володіє вираженою дозозалежною здатністю відновлювати чутливість поліантибіотикорезистентних штамів стафілококів до b-лактамних антибіотиків, макролідів, лінкозамідів, тетрациклінів та фторхінолонів in vit-ro (табл.2). Водночас синергізм його взаємодії з аміноглікозидами (гентаміцином) виражений значно слабше. Здатність відновлювати чутливість поліантибіотикорезистентних MRSA і
Таблиця 2
Відновлення чутливості до антибіотиків клінічних штамів стафілококів під впливом 90% водно-етанольного екстракту бруньок берези бородавчастої
| Кратність зниження протимікробних концентрацій антибіотиків | ||||||
| Штами стафілококів | 1: 640 (46,88 мкг/мл†) | 1: 1280 (23,44 мкг/мл) | 1: 2560 (11,72 мкг/мл) | |||
| МБсК | МБцК | МБсК | МБцК | МБсК | МБцК | |
| Оксацилін | ||||||
| S. aureus ICA-5 | - | - | 32 | 128 | 8 | 8 |
| S. aureus "Кунда" | - | - | >256 | 128 | 16 | 8 |
| S. auricularis 5-03 | 8 | 8 | 16 | 8 | 4 | 2 |
| S. haemolyticus "Сопуляк" | 16 | 8 | 16 | 32 | 8 | 2 |
| S. haemolyticus "Баб’як" | 32 | 8 | 32 | 16 | 16 | 4 |
| Ципрофлоксацин | ||||||
| S. aureus ICA-5 | - | - | 4 | 4 | 2 | 1 |
| S. aureus "Кунда" | - | - | 8 | 8 | 4 | 4 |
| S. auricularis 5-03 | 256 | 8 | 2 | 1 | 1 | 0,5 |
| S. haemolyticus "Сопуляк" | 256 | 128 | 2 | 4 | 0,5 | 1 |
| S. haemolyticus "Баб’як" | 256 | 4 | 1 | 2 | 0,5 | 1 |
| Еритроміцин | ||||||
| S. aureus ICA-5 | - | - | 1024 | 64 | 32 | 8 |
| S. aureus "Кунда" | - | - | 1024 | 32 | 64 | 8 |
| S. auricularis 5-03 | 32 | 64 | 4 | 8 | 1 | 0,5 |
| S. haemolyticus "Сопуляк" | 32 | 1024 | 4 | 64 | 0,5 | 4 |
| S. haemolyticus "Баб’як" | 2 | 64 | >16 | 512 | 8 | 32 |
| Кліндаміцин * | ||||||
| S. aureus ICA-5 | - | - | >512 | >16 | 4 | >2 |
| S. aureus "Кунда" | - | - | >32 | >16 | >2 | >2 |
| Тетрациклін | ||||||
| S. aureus ICA-5 | - | - | 1 | 0,5 | 1 | 1 |
| S. aureus "Кунда" | - | - | 4 | 4 | 2 | 4 |
| S. auricularis 5-03 | >256 | >1024 | >256 | 2 | 64 | 8 |
| S. haemolyticus "Сопуляк" | >8 | 4 | >8 | >8 | 4 | 2 |
| S. haemolyticus "Баб’як" | 0,5 | 8 | >4 | 64 | 1 | 4 |
| Гентаміцин | ||||||
| S. aureus ICA-5 | - | - | 1 | 1 | 1 | 2 |
| S. aureus "Кунда" | - | - | 32 | 1 | 4 | 2 |
| S. auricularis 5-03 | >64 | 128 | 0,25 | 0,25 | 0,5 | 0,5 |
| S. haemolyticus "Сопуляк" | >32 | 32 | 0,5 | 0,25 | 0,5 | 0,5 |
| S. haemolyticus "Баб’як" | 4 | 0,5 | 1 | 0,5 | 0,5 | 0,5 |
Примітки: 1. † - концентрація нелетких екстрагованих сполук.
* - чутливі до кліндаміцину штами S. haemolyticus і S. auricularis не тестувались.
MR-CNS до оксациліну і еритроміцину проявляється при розведеннях екстракту 1: 2560 – 1: 5120 (що відповідає концентрації нелетких екстрагованих сполук 5,86-11,72 мкг/мл).
Після 10 пасажів на середовищах із суббактеріостатичними концентраціями 90% водно-етанольного екстракту бруньок у штамів MecA+ стафілококів зареєстровано зниження рівня продукції пеніцилінзв’язуючого білка PBP2¢. Біоавтографічні дослідження тонкошарових хроматограм сумарного 90% водно-етанольного екстракту бруньок берези, а також хлороформного і етилацетатного екстрактів у різних системах розчинників (хлороформ – метанол – вода 80: 18: 2, н-бутанол – оцтова кислота – вода 40: 12: 28 і етилацетат – метанол – вода 100: 13: 17) дозволяють пов’язати оксацилінпотенціюючу дію екстракту бруньок берези з присутністю в них танінів (катехінів), а їх пряму протимікробну активність – із терпеновими сполуками.
При послідовній вичерпній екстракції бруньок берези органічними розчинниками із зростаючою полярністю максимальне нагромадження сполук з ципрофлоксацинпотенціюючою активністю відносно NorA+ штамів S. aureus спостерігається у хлороформній витяжці. При цьому виразний синергічний ефект з ципрофлоксацином проявляється в концентраціях екстракту, рівних 1/4-1/8 МБцК (31,25-62,5 мкг/мл). Менш виражений синергічний ефект з ципрофлоксацином проявляють гексановий і етилацетатний екстракти (в концентраціях 1/2-1/4 МБцК), але активність останніх поширюється і на штами CNS. Компоненти хлороформного екстракту також знижують рівень асоційованої резистентності MRSA до тетрацикліну.
В ході виконаної роботи розроблено і оптимізовано технологію одержання екстрактів, яка дозволяє забезпечити максимальний вихід сполук із прямою протимікробною активністю відносно стафілококів (включаючи MR-ізоляти) та компонентів з властивостями модифікаторів антибіотикорезистентності бактерій (Патент України UA № 27940). Одержаний комплекс екстрагованих біологічно активних сполук бруньок берези характеризується низькою гострою токсичністю, не володіє подразнюючими і алергізуючими властивостями.
Аналіз і узагальнення одержаних результатів викладено в наступному розділі дисертації. В ньому у стислій формі наведено підсумки виконаної роботи, обговорено основні результати експериментів, які дозволили реалізувати мету і завдання дослідження, обгрунтувати висновки.
Результати виконаної роботи дозволили сформулювати основні стратегічні напрямки створення нових ефективних протистафілококових препаратів, попередження виникнення та подолання резистентності госпітальних штамів стафілококів:
Раціональний підхід до молекулярного дизайну нових синтетичних сполук із протимікробними властивостями на основі застосування сучасних комп’ютерних технологій моделювання ліганд-рецепторної взаємодії та прогностичних можливостей QSAR-аналізу.
Ідентифікація нових бактеріальних мішеней для потенційних протимікробних засобів (ензими ранніх етапів біосинтезу пептидоглікану MurB, MurC).
Пошук ефективних інгібіторів ефлюксних помп резистентності (NorA, MsrA, TetK та ін) серед синтетичних і природних сполук.
Подальша розробка і впровадження у клінічну практику засобів для комбінованої протимікробної хіміотерапії.
Висновки
В дисертаційній роботі на основі даних експериментальних досліджень та їх теоретичних узагальнень обгрунтовано стратегію пошуку нових ефективних засобів для лікування та профілактики сучасних стафілококових інфекцій, подолання медикаментозної стійкості стафілококів. На основі встановлених взаємозв’язків "структура – активність" визначено напрямки синтезу гетероциклічних сполук з протимікробною активністю відносно поліантибіотикорезистентних стафілококів в рядах похідних тіазолідину, тріазолу, хіноліну, акридину. Обгрунтовано і експериментально доведено синергізм протимікробної дії відносно MRS синтетичних сполук і біологічно активних сполук рослинного походження з класичними антибіотиками (b-лактамами, фторхінолонами, макролідами, тетрациклінами). Запропоновано комплексну лікувальну композицію. Завершено доклінічне дослідження нового протимікробного засобу – настоянки бруньок берези бородавчастої.
У загальній структурі ізолятів стафілококів, визнаних етіологічними чинниками опортуністичних і госпітальних інфекцій, частка метіцилінрезистентних штамів S. aureus становить 27,0%, MR-CNS – 22,7%. Клінічні штами MRSA виділяються переважно з гною, раневого ексудату та носоглотки, а MR-CNS, крім того, із сечостатевого тракту.
У великих багатопрофільних лікувальних закладах Прикарпаття існують внутрішньолікарняні осередки інфекції MRS. За схильністю до внутрішньогоспітального епідемічного поширення вони розташовуються в наступному порядку: MRSA > MR-CNS >> BSSA > BS-CNS. Впровадження у регіоні постійно діючої динамічної багаторівневої системи епідеміологічного моніторингу (з елементами зворотного зв’язку) дозволило в 2003-2006 рр. обмежити поширення MRS в лікувальних закладах, досягнути зниження частоти та інтенсивності спричинюваних ними епідемічних спалахів.
Крім значної резистентності до цефалоспоринів, регіональні штами MRS характеризуються високою частотою асоційованої резистентності до аміноглікозидів, макролідів, лінкозамідів, тетрациклінів, нітрофуранів. Лише 33,3-57,2% ізолятів MRSA проявляють задовільну чутливість до рифампіцину і фузидину. Впродовж 16-річного періоду спостереження (1990-2006 рр) у Прикарпатському регіоні спостерігається стабільна тенденція до прогресуючого набування клінічними штамами стафілококів резистентності до фторхінолонів. Знижену чутливість або резистентність до ванкоміцину виявлено у 1,93% штамів MRSA, серед MR-CNS вона сягає 18,0% і властива переважно штамам S. haemolyticus.
На основі цілеспрямованого пошуку і відбору сформовано репрезентативні панелі сучасних клінічних штамів стафілококів з фенотипічно ідентифікованими детермінантами антибіотикорезистентності: пеніцилінзв’язуючим білком PBP2¢, ефлюксними помпами резистентності до фторхінолонів (NorA), макролідів (MsrA), тетрациклінів (TetK).
Запропонована стратегія пошуку нових протимікробних сполук серед похідних 4-азолідонів, яка включає комбінаторний підхід до синтезу з комп’ютерною систематизацією даних, поєднання традиційного та віртуального скринінгу і дизайну, QSAR-аналіз, забезпечує істотну оптимізацію процесу фармакологічних досліджень та ідентифікації "структур-лідерів", що відображено у високому відсотку активних сполук (22,1%) серед структур-кандидатів для мікробіологічних досліджень.
Застосована процедура тотального високоефективного скринінгу і QSAR-аналізу дозволяє визначити структурні вимоги для молекулярного дизайну антимікробних 4-азолідонів та споріднених гетероциклічних систем. Ідентифіковано нові класи сполук із значною протимікробною активністю відносно метіцилінрезистентних стафілококів – 5- [2-(арилметилокси) - 5-нітрофеніл] метиліден-2-тіоксотіазолідин-4-они та 2,4,5-тризаміщені 4-спіранові похідні тіазолідин-2-ону з піразолобензоксазиновим фрагментом, активність яких очевидно пов’язана з блокуванням ферментів біосинтезу пептидоглікану MurC і MurB. Оптимальною структурою з протистафілококовою активністю є 5- [2-бензилокси-5-нітрофеніл] метиліден-2-тіоксотіазолідин-4-он (сполука L131). Похідні 4-азолідонів і оксацилін проявляють синергізм протимікробної дії по відношенню до MRSA.
Використання прогнозуючої здатності 2D-QSAR аналізу результатів фармакологічного скринінгу значно підвищує ефективність молекулярного дизайну структур, активних відносно поліантибіотикорезистентних штамів мікроорганізмів. Достовірність методу доведено синтезом теоретично змодельованих структур – похідних 6-оксо-5,6-дигідро [1,3] тіазоло [2,3-b] [1,2,4] тріазол-6-ону (сполук L-1558 і L-1369), високоактивних відносно MS - і MR-стафілококів.
Стабільно високу протистафілококову активність виявляють 2-(5-арил-2-фурил) - 4-хінолінкарбонові кислоти, похідні 1-оксо-3,3-диметил-10-R-феніл-1,2,3,4-тетрагідробензо [j] акридинію, 1,8-діоксо-3,3,6,6-тетраметил-1,2,3,4,5,6,7,8,9,10-декагідроакридину, четвертинні солі N-бензил-6-(4-R-бензиліден) циклопента [с] хінолінію.
Серед лікарських рослин флори України виявлено природні джерела сполук з високим рівнем протимікробної активності відносно MRS, придатних для створення нових лікувальних засобів (слань цетрарії ісландської Cetraria islandica (L) Ach. та евернії сливової Evernia prunastri (L) Ach., бруньки берези бородавчастої Betula verrucosa Ehrh. та тополі чорної Populus nigra L., трава і суцвіття гринделії розчепіреної Grindelia squarrosa (Pursh) Dun., листя мучниці звичайної Arctostaphylos uva-ursi (L) Spreng., кореневища гірчака зміїного Polygonum bistorta L., кермеку Мейєра Limonium meyeri (Boiss) O. Kuntze і кермеку південнобузького Limonium hypanicum Klok. та ін). Біологічно активні сполуки вказаних рослинних екстрактів, поряд із прямою протимікробною активністю відносно MRS, володіють антиадгезивними, протизапальними та імуномодулюючими властивостями.
Оптимізовано методологічні підходи до стратегії цілеспрямованого пошуку модифікаторів антибіотикорезистентності бактерій в рослинній сировині. Розроблено оригінальну просту і достатньо чутливу методику для скринінгового дослідження сполук (як природного, так і синтетичного походження) на предмет виявлення у них здатності відновлювати чутливість резистентних штамів мікроорганізмів до класичних антибіотиків. Рівень чутливості запропонованого скринінгового методу знаходиться в межах 97,22±2,74%.
Модифікатори антибіотикорезистентності бактерій достатньо широко розповсюджені в рослинній сировині. Здатністю відновлювати чутливість MRSA до оксациліну володіє 33,99% досліджених екстрактів. Лікарські рослини є джерелом сполук, здатних блокувати ефлюксні механізми асоційованої резистентності MRSA до фторхінолонів (ципрофлоксацину) – 24,63% досліджених екстрактів, макролідів (еритроміцину) – 24,14% екстрактів, тетрацикліну – 38,89% екстрактів. У рослин різних таксономічних груп існують закономірності продукції метаболітів, здатних модифікувати антибіотикорезистентність стафілококів.
Водно-етанольний, хлороформний і етилацетатний екстракти бруньок берези бородавчастої володіють вираженою дозозалежною здатністю відновлювати чутливість поліантибіотикорезистентних штамів стафілококів до b-лактамних антибіотиків, макролідів, лінкозамідів, тетрациклінів і фторхінолонів in vitro.
Практичні рекомендації
З метою вдосконалення системи епідеміологічного моніторингу за поширенням MRS в лікувальних закладах рекомендовано застосування спеціалізованого комп’ютерного програмного забезпечення (програма WHONET 5.1, WHO Collaborating Centre for the Surveillance of Antibiotic Resistance).
Для проведення ретроспективного епідеміологічного аналізу поширення метіцилінрезистентних стафілококів (MRSA, MR-CNS) та стафілококів з пограничною метіцилінрезистентністю (BSSA, BS-CNS) доцільно використовувати матеріали досліджень чутливості штамів одночасно до оксациліну і цефазоліну: метіцилінрезистентні стафілококи характеризуються фенотипом резистентності OxarCzor, штами з фенотипом OxarCzos належать до ізолятів з пограничною резистентністю.
Встановлені регіональні особливості чутливості до антибіотиків MS - і MR-штамів S. aureus та CNS, а також штамів з пограничною метіцилінрезистентністю, що доцільно використовувати при виборі антимікробних препаратів з лікувальною метою.
Для попередження внутрішньолікарняного поширення MRS рекомендувати використовувати бацилоцид, хлоргексидин, етоній і хлорофіліпт.
Розроблено комплексну лікувальну композицію етонію, амізону і силларду-П з протимікробними, протизапальними та імуностимулюючими властивостями для місцевого застосування при хронічному генералізованому пародонтиті та інших гнійно-запальних процесах (Патент України UA №19175).
Створено колекцію 36 авторських штамів стафілококів клінічного походження з ідентифікованими детермінантами антибіотикорезистентності (продукція пеніцилінзв’язуючого білка PBP2¢, функціонування ефлюксних механізмів резистентності до фторхінолонів NorA, макролідів MsrA, тетрациклінів TetK) для використання в якості об’єктів у різноманітних фундаментальних та прикладних дослідженнях. Штами знаходяться на зберіганні в колекціях музею мікроорганізмів ДП "Інститут мікробіології та імунології ім. І.І. Мечникова АМНУ" (м. Харків), в музеї патогенних для людини мікроорганізмів Інституту епідеміології та інфекційних хвороб ім. Л.В. Громашевського АМНУ (м. Київ).
Рекомендовано методику дослідження синергізму протимікробної дії лікувальних антимікробних препаратів (Патент UA №27939).
Для поглибленого фармакологічного дослідження рекомендувати синтетичні препарати (L-131, M-116) в якості потенційних кандидатів для створення нових антимікробних засобів з високою активністю відносно метіцилінрезистентних стафілококів.
Завершено доклінічне дослідження настоянки бруньок берези бородавчастої Betula verrucosa Ehrh. (Gemmae Betulae) в якості фармацевтичного протимікробного засобу (Патент України UA №27940).
Список робіт, опублікованих за темою дисертації
1. Куцик Р.В. Скринінгове дослідження протимікробної активності лікарських рослин Прикарпаття відносно поліантибіотикорезистентних клінічних штамів стафілококів: Повідомлення 1 // Галицький лікарський вісник. - 2004. -Т.11, №4. -С.44-48.
2. Куцик Р.В. Дослідження чутливості до офіцинальних препаратів лікарських рослин штамів метіцилінорезистентних стафілококів, виділених від пацієнтів з фурункульозом і неспецифічними уретритами // Арх. клін. мед. - 2005. -№2(8). -С. -65-69.
3. Куцик Р.В. Скринінгове дослідження протимікробної активності лікарських рослин Прикарпаття відносно поліантибіотикорезистентних клінічних штамів стафілококів: Повідомлення 2 // Галицький лікарський вісник. - 2005. -Т.12, №3. -С.52-58.
4. Куцик Р.В. Протимікробна активність екстрактів лишайників Cetraria islandica (L) Ach. і Evernia prunastri (L) Ach. відносно стафілококів з різним рівнем метіцилінорезистентності // Анали Мечниківського інституту. - 2008. -№1. -С.42-46. -Режим доступу: http: // www. nbuv. gov. ua/ e-journals/AMI/2008/j12008. htm.
5. Куцик Р.В. Антибіотикопотенціююча активність бруньок берези бородавчастої Betula verrucosa Ehrl. // Акт. питання фармацевт. та мед. науки та практики. -2006. -Вип.15, Т.1. -С. 205-211.
6. Кучеренко К.В., Куцик Р.В. Етіологічна структура та особливості антибіотикограми збудників при деяких фонових та передракових станах шийки матки // Галицький лікарський вісник. - 1999. -Т.6, №2. -С.51-54. Особистий внесок автора: мікробіологічні дослідження, узагальнення і аналіз результатів, оформлення статті.
7. Куцик Р.В., Куровець Л.М. Видовий спектр і чутливість до антибіотиків стафілококів, виділених від пацієнтів з фурункульозом // Мікробіол. журн. - 2002. -Т.64, №5. -С.60-63. Особистий внесок автора: постановка завдання, забір і бактеріологічне дослідження біологічного матеріалу, аналіз результатів, оформлення статті.
8. Нозокоміальні пневмонії у хірургічних хворих / Р.Б. Костирко, І.І. Тітов, Р.В. Куцик, Р.М. Мізюк, Т.І. Клюфінська, О.О. Янків // Галицький лікарський вісник. - 2002. -Т.9, №3. -С.162-164. Особистий внесок автора: мікробіологічні дослідження, аналіз результатів.
9. Поточний контроль санепідрежиму, як складова реалізації нового підходу до управління якістю медичної допомоги та профілактики внутрішньолікарняних інфекцій / С.К. Борщ, Р.В. Куцик, О.В. Борщ, Б.І. Васильчук, В.М. Вовчук, І.С. Грибовська, К.М. Грибовський, Л.Б. Ярич // Галицький лікарський вісник. - 2003. -Т.10, №3. -С.106-111. Особистий внесок автора: участь у розробці тактики поточного контролю за санепідрежиммом, редагування статті.
10. Синтез та мікробіологічний скринінг четвертинних солей циклопента [с] хінолінію / Р.В. Куцик, З.Л. Новіцький, М.В. Мельник, А.О. Стецьків, Л.М. Куровець, О.В. Боднарчук // Вісн. Вінницького Націон. мед. ун-ту. - 2004. -№8(2). -С.430-434. Особистий внесок автора: постановка завдання, дослідження антимікробної активності сполук, аналіз і узагальнення результатів, оформлення статті.
11. Вивчення антагоністичної активності лактобацил, введених у пробіотичний препарат лактобактерин, щодо етіологічних чинників дисбактеріозу кишечника, гнійно-запальних процесів та пробіотичних штамів мікроорганізмів / С.К. Борщ, Н.М. Середюк, Р.В. Куцик, О.Д. Матейчук, Р.М. Мізюк // Галицький лікарський вісник. - 2004. -Т.11, №3. -С.16-19. Особистий внесок автора: постановка завдання, виділення штамів стафілококів, аналіз результатів, редагування статті.
12. Антиінфекційна резистентність школярів м. Івано-Франківська в сучасних екологічних умовах / А.П. Юрцева, Р.В. Куцик, Б.М. Павликівська, О.В. Фофанова, З.О. Ціхонь, Р.М. Мізюк // Арх. клін. мед. - 2004. -№1(5). -С. -69-71. Особистий внесок автора: мікробіологічні дослідження, узагальнення і аналіз результатів, оформлення статті.
13. Борщ С.К., Середюк Н.М., Куцик Р.В. Вивчення на прикладі E. coli шт. М-17, введеної в препарат біфікол, закономірностей прояву антагоністичних властивостей мікроорганізмів, що належать до різних таксономічних одиниць, є збудниками дисбактеріозу кишечника, гнійно-запальних процесів та пробіотичними штамами // Галицький лікарський вісник. - 2004. -Т.11, №4. -С.9-11. Особистий внесок автора: постановка завдання, виділення штамів стафілококів, аналіз результатів, редагування статті.
14. Спосіб визначення антиколонізаційної резистентності слизової оболонки порожнини рота / У.Р. Никифорчин, М.М. Рожко, Р.В. Куцик, Т.М. Михайленко, Г.С. Орнат. - Інформ. лист №70-2004. -Київ, 2004. -2c. Особистий внесок автора: постановка завдання, інтерпретація і узагальнення результатів.
15. Куцик Р.В., Куровець Л.М., Зузук Б.М. Дослідження протистафілококової активності екстрактів гірчака зміїного (Polygonum bistorta L) // Вісн. Одеського національного університету. Сер. біол. - 2005. -Т.10, Вип.7. -С. -137-143. Особистий внесок автора: постановка завдання, одержання екстрактів, логіка, тактика та виконання експериментальних досліджень, узагальнення результатів, оформлення статті.
16. Клінічні та мікробіологічні прояви дисбактеріозу кишечника у пацієнтів із гастроінтестінальною патологією / С.К. Борщ, Н.М. Середюк, Р.В. Куцик, Л.С. Малофій, В.М. Вовчук, В.М. Благодатний, Р.М. Мізюк, Н.С. Духович // Арх. клін. мед. - 2005. -№2(8). -С. -44-48. Особистий внесок автора: дослідження антибіотикорезистентності виділених штамів, аналіз результатів, редагування статті.
17. Мізюк Р.М., Куцик Р.В., Борщ С.К. Особливості мікробного спектру та резистентності до антибіотиків мікроорганізмів, виділених в стаціонарах Івано-Франківської області // Галицький лікарський вісник. - 2005. -Т.12, №2. -С.36-41. Особистий внесок автора: дослідження антибіотикорезистентності виділених штамів, аналіз і узагальнення результатів, редагування статті.
18. Скринінгове дослідження протимікробної активності спиртових екстрактів лікарських рослин / Р.М. Мізюк, Р.В. Куцик, Б.М. Зузук, С.К. Борщ, Н.І. Фрич // Галицький лікарський вісник. - 2005. -Т.12, №4. -С.66-71. Особистий внесок автора: постановка завдання, одержання екстрактів, аналіз результатів, редагування статті
19. Борщ С.К., Куцик Р.В. Обгрунтування патогенетичних варіантів синдрому дисбактеріозу кишечнику для вибору схем базової пробіотичної терапії // Ліки України. - 2005. -№12(101). -С.113-119. Особистий внесок автора: постановка завдання, редагування статті.
20. Кукурудз Н.І., Герелюк В.І., Куцик Р.В. Клініко-мікробіологічна ефективність застосування композиції амізон-етоній імобілізованої на кремнеземі "Силлард-П" у лікуванні генералізованого пародонтиту // Ліки. - 2006. -№3-4. -С.93-102. Особистий внесок автора: бактеріологічне дослідження біологічного матеріалу, аналіз результатів.
21. Кукурудз Н.І., Куцик Р.В., Луцак Л.В. Мікробіологічне обгрунтування застосування композиції амізон-етоній, імобілізованої на сорбенті "Силлард-П", для лікування генералізованого пародонтиту // Укр. мед. альманах. - 2006. -Т.9, №5. -С.67-70. Особистий внесок автора: постановка завдання, дослідження антимікробної активності композиції, узагальнення результатів, оформлення статті.
22. Курбатова С.С., Куцик Р.В., Герелюк В.І. Мікробіологічне обгрунтування застосування зинаксину в комплексному лікуванні генералізованого пародонтиту // Вісн. стоматол. -2006. -№2(52). -С.50-54. Особистий внесок автора: постановка завдання, логіка, тактика та виконання експериментальних досліджень, узагальнення і аналіз результатів.
23. Борщ С.К., Куцик Р.В. Класифікація різновидів антагністичної активності мікроорганізмів при виборі пробіотичних препаратів для хворих із синдромом дисбактеріозу кишечника // Ліки України. - 2007. -№10(114). -С.66-71. Особистий внесок автора: постановка завдання, редагування статті.
24. Порівняльний аналіз чутливості до антибіотиків золотистих стафілококів і грибів, виділених у пацієнтів із дисбактеріозом кишечника / С.К. Борщ, В.Г. Войцеховський, Р.В. Куцик, В.П. Борщ // Галицький лікарський вісник. - 2007. -Т.14, №4. -С.17-21. Особистий внесок автора: постановка завдання, аналіз і узагальнення результатів, оформлення статті.
25. Синтез и антимикробная активность 5(R1-бензил-) - 2-(R2-бензилиденгидразоно) - 3-фурфурил-4-тиазолидинонов / В.М. Цялковский, В.С. Матийчук, Р.В. Куцык, Н.Д. Обушак, Т.И. Клюфинская // Хим. -фарм. журн. - 2005. -Т.39, №5. -С. 20-22. Особистий внесок автора: дослідження антимікробної активності сполук, аналіз і узагальнення результатів.
26. Synthesis and antimicrobial activity of 5-(R1-benzyl) - 2-(R2-benzylidenehydrazono) - 3-(2-furylmethyl) thiazolidin-4-ones / V. M. Tsyalkovsky, V. S. Matiychuk, R. V. Kutsyk, N. D. Obushak, T.I. Klyufinskaya // Pharmacuetical Cemistry J. - 2005. -Vol.39, №5. -P.245-247. Особистий внесок автора: дослідження антимікробної активності сполук, аналіз і узагальнення результатів.
27. Синтез и противомикробная активность амидов 2,4-диоксотиазолидин-5-уксусной кислоты / Б.С. Зименковский, Р.В. Куцик, Р.Б. Лесык, В.М. Цялковский, В.С. Матийчук, Н.Д. Обушак, Т.И. Клюфинская // Хим. -фарм. журн. - 2006. -Т.40, №6. -С.13-16. Особистий внесок автора: дослідження антимікробної активності сполук, аналіз і узагальнення результатів.
28. Synthesis and antimicrobial activity of 2,4-dioxothiazolidine-5-acetic acid amides / B. S. Zimenkovskii, R. V. Kutsyk, R. B. Lesyk, V. S. Matyichuk, N. D. Obushak, T.I. Klyufinska // Pharm. Chemstry J. - 2006. -Vol.40, №6. -P.303-306. Особистий внесок автора: дослідження антимікробної активності сполук, аналіз і узагальнення результатів.
29. Синтез та вивчення антимікробної активності похідних азолідину з 2-(2-хлорбензилокси) - 5-нітрофенільним фрагментом в молекулах / Р.Б. Лесик, Б.С. Зіменковський, Р.В. Куцик, Д.В. Атаманюк, Г.М. Семенців // Фармацевт. журн. - 2003. -№2. -С.52-56. Особистий внесок автора: дослідження антимікробної активності сполук, аналіз і узагальнення результатів.
0 комментариев