Навигация
Полногеномная амплификация
4.3 Полногеномная амплификация
В последнее время основным методом увеличения количества ДНК при анализе единственной клетки в ПГД является полногеномная амплификация (ПА). Использование этого метода позволяет значительно увеличить количество ДНК-матрицы, необходимой для проведения ПЦР. Наиболее часто используемый метод полногеномной амплификации - добавочная предамплификация (ДПА). При использовании этого метода случайные последовательности 15-нуклеотидных праймеров инициируют синтез геномной ДНК.
Недостатком ПА является то, что амплифицируется большое количество повторяющейся ДНК (короткие тандемные повторы), что дает некий "фон", который может приводить к ошибкам специфической ПЦР. Эти ошибки возникают в результате скольжения цепи ДНК во время полимеризации продукта, особенно при низких температурах, необходимых для этого метода. В связи с этим не рекомендуется использование полногеномной амплификации при клинической диагностике заболеваний, связанных с экспансией тринуклеотидных повторов, или при диагностике, основанной на анализе сцепления с высокополиморфными микросаттелитными повторами.
5 Методы анализа мутаций, основанные на ПЦР
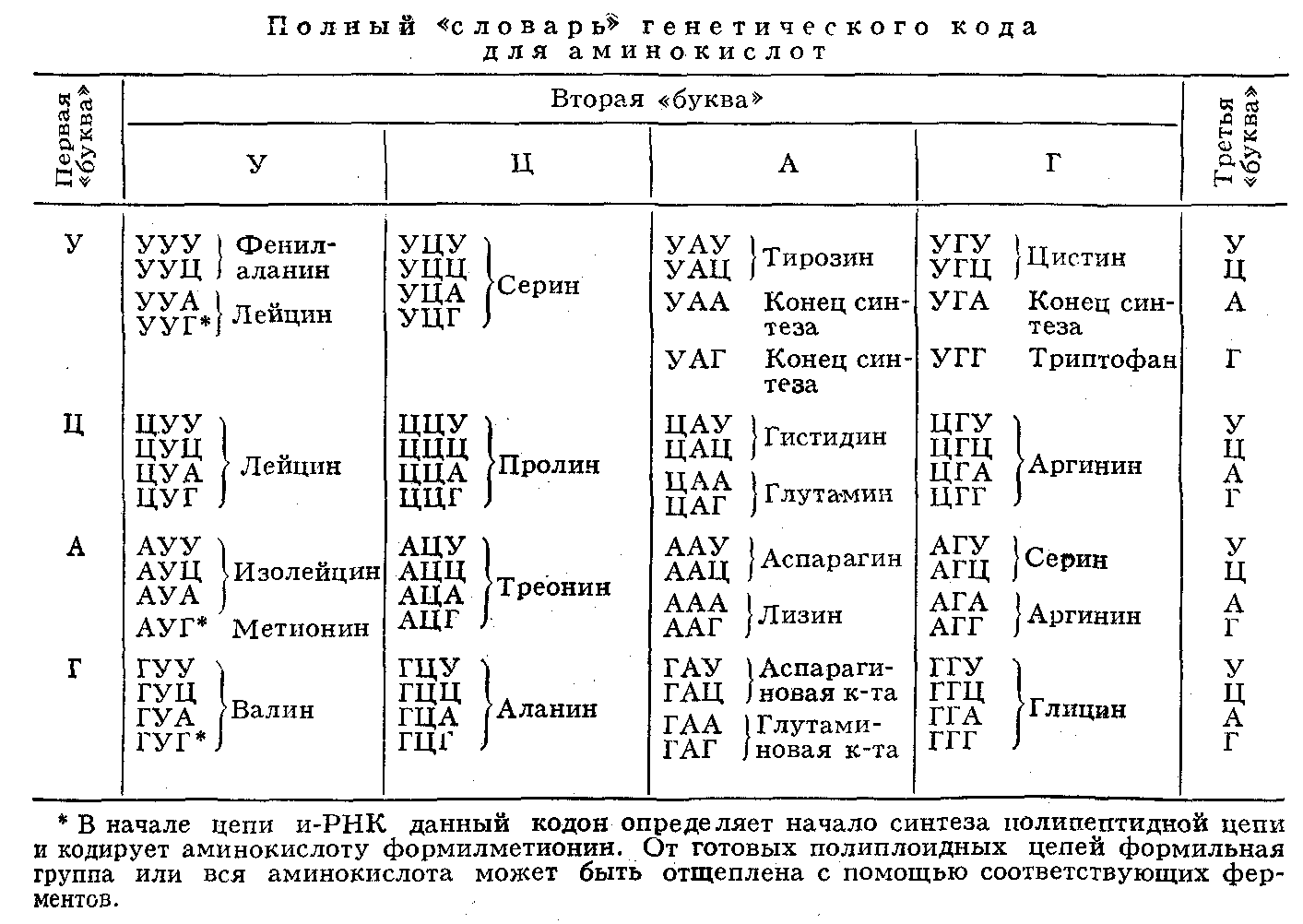
С того момента, когда стало возможным амплифииировать ДНК одной клетки в достаточном для анализа количестве, были использованы все основные методы определения мутаций.
ДНК-диагностику мутаций можно условно разделить на 3 категории:
1) анализ определенной специфической мутации;
2) скрининг неизвестных мутаций в определенном гене;
3) определение не собственно мутации, а ее наличие (косвенная ДНК-диагностика).
Методы первой категории обычно широко используют для определения единичных распространенных мутаций. Методы второй категории являются скрининговыми и обычно используются для поиска еще не охарактеризованных мутаций в определенных генах. Косвенная ДНК-диагностика основана на анализе сцепления заболевания с полиморфными ДНК-маркерами в семье, когда ген не охарактеризован, но известна его локализация на хромосоме, если проведение прямой ДНК-диагностики затруднено из-за наличия псевдогенов, повторяющихся последовательностей или большого по величине гена, когда скрининг мутации может занять несколько недель.
Среди методов прямой ДНК-диагностики можно выделить:
1. аллель-специфическую ПЦР, с помощью которой проводят анализ наиболее распространенных мутаций гена CFTR при муковисцидозе, спинальной мышечной атрофии и пигментном ретините;
2. анализ с использованием рестрикционных эндонуклеаз применяют для диагностики определенных точечных мутаций при спинальной мышечной атрофии, пигментном ретините и др.;
3. анализ гетеродуплексов был эффективно использован для диагностики болезни Тея-Сакса, семейного аденоматозного полипоза и муковисцидоза;
4. анализ однонитевого конформациопного полиморфизма был эффективен в диагностике мутаций при семейном аденоматозном полипозе, β-талассемии, дефиците средней цепи ацилкоэнзим α-дегидрогсназы;
5. с помощью денатурирующего градиентного гель-электрофореза определяли мутации при β-талассемии;
6. прямое секвенирование (определение нуклеотидного состава ДНК) позволяет выявить любую мутацию в определенном гене. Оно было эффективно использовано при диагностике многих заболеваний.
6 Анализ сцепления (косвенная ДНК-диагностика)
В ряде случаев бывает так, что ген заболевания еще не клонирован и поэтому прямая диагностика мутации невозможна. Однако известно, что предполагаемый ген расположен в определенном месте хромосомы. Этой информации уже достаточно для проведения ДНК-диагностики семейного случая заболевания с использованием высокополиморфных молекулярных маркеров, сцепленных заболеванием.
Для косвенной диагностики подходят маркеры, расположенные внутри или вблизи гена, но при условии, если они находятся в неравновесии по сцеплению, т.е. определенные аллели наследуются совместно друг с другом, образуя гаплотип, и не подвергаются рекомбинациям в мейозе. Чтобы провести анализ сцепления и определить патологический гаплотип, необходимо протестировать ДНК родственников в семье и проследить аллели маркеров, которые наследуются совместно с заболеванием. Информация об определенных аллелях и гаплотипах у супружеской пары перед ЭКО дает возможность суммировать все возможные генотипы у зиготы, что позволяет обнаружить контаминацию, а также определить гаплоидию или однородительскую дисомию (наследование обеих хромосом от одного из родителей).
Рождение здорового ребенка в результате ЭКО и ПГД зависит от благополучного исхода ряда процессов. Дело в том, что только около 70% яйцеклеток могут быть оплодотворены и еще 70% из них достигнут стадии 6-8 бластомеров. Учитывая эффективность ПГД (80-90%), примерно половина эмбрионов без идентифицированной патологии может быть успешно имплантирована. Таким образом, приблизительно 1/3 от всех циклов ЭКО может успешно закончиться рождением здорового ребенка. ПГД однозначно должна быть рекомендована супружеским парам, которые имеют не только наследственную патологию, но и репродуктивные проблемы или же имевшие место неблагоприятные исходы в результате ПД. Это позволит значительно повысить частоту успешной имплантации и развития нормальной беременности у женщин старше 35 лет, которые имеют высокий риск самопроизвольных выкидышей, а также при привычном невынашивании беременности.
Эффективность ПГД, особенно в случае моногенных заболеваний, во многом зависит от медико-генетического консультирования и проведенного ДНК-исследования супружеской пары, обратившейся за всмопогатсльными репродуктивными технологиями. Наличие в семейном анамнезе аутосомно-доминантных заболеваний, особенно с низкой пенетрантностью и неполной экспрессивностью, требуют молекулярно-генетического исследования конкретного гена для определения мутации еще у родителей. В случае если мутация определена, ПГД будет ориентирована на выявление именно этой мутации. Молекулярное исследование супружеской пары на наличие ряда распространенных моногенных аутосомно-рецессивных заболеваний необходимо. Среди заболеваний, гетерозиготное носительство которых нужно определить, следует выделить муковисцидоз, фенилкетонурию, гемохроматоз, адреногенитальный синдром и некоторые другие. Не всегда на практике имеется возможность осуществить полный скрининг мутаций в соответствующих генах, но мажорные мутации тестировать необходимо. В случае известных Х-сцепленных заболеваний определение мутаций в семье также необходимо, поскольку оно позволяет в случае ПГД ориентироваться именно на мутацию, а не на пол эмбриона.
Несмотря на более чем десятилетний опыт ПГД, внедрение новых методов и инструментов, она продолжает оставаться технически сложной и трудоемкой процедурой, требующей знаний и усилий ряда специалистов. Вот почему тенденция к повышению эффективности ПГД должна быть основана на разработке более эффективных и простых протоколов молекулярно генетического анализа и расширении спектра диагностируемой патологии.
Вывод
Работа с таким уникальным материалом, как ткани плода человека на разных стадиях внутриутробного развития, позволяет не только решить проблему пренатальной диагностики наследственных болезней, но и открывает широкие возможности для изучения такой фундаментальной проблемы, как проблема реализации генетической информации в раннем развитии человека.
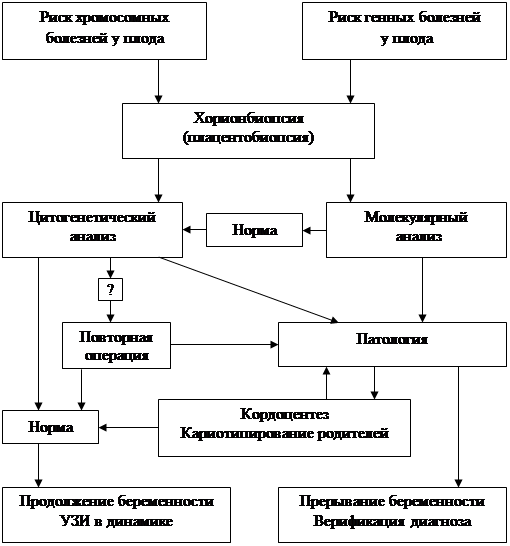
В результате комплексных исследовании был разработан оптимальный алгоритм диагностики наследственных болезней (Приложение 1).
К настоящему времени достигнуты серьезные успехи во всех основных разделах молекулярной медицины - диагностике, профилактике и лечении наследственных и мультифакторных заболеваний. Нет сомнения, что уже в недалеком будущем будет положительно решена и проблема создания индивидуальных, семейных и специализированных баз ДНК-данных - различных вариантов генетических паспортов. Важно, однако, напомнить, что внедрение уже существующих и особенно новых методов и технологий сопряжено с необходимостью приобретения новой прецизионной техники для молекулярных исследований, новых компьютерных программ, с затратами на обучение персонала и подготовку грамотных в вопросах молекулярной медицины врачей.
Алгоритм пренатальной диагностики наследственных болезней (Приложение 1)
Список использованных источников
1. Н.М. Побединский, Е.А. Кириллова, Д.Г. Красников, О.К. Никифорова, Е.Н. Лукаш, Н.В. Зарецкая, Е.П. Гитель, А.Д. Липман, О.В. Паршинова – «Роль медико-генетического консультирования в акушерстве и перинатологии» - Акушерство и гинекология 2000 г. № 4 стр. 52 - 55;
2. В.С. Горин, В.Н. Серов, С.Г. Жабин, А.П. Шин, Р.В. Горин – «Пренатальная диагностика хромосомных заболеваний: новые направления и методы» - Акушерство и гинекология 2001 г. № 1 стр. 5 – 8;
3. Э.К. Айламазян, В.С. Баранов – «Молекулярная медицина – новые направления в акушерстве и гинекологии» - Акушерство и гинекология 2002 г. № 4 стр. 9 – 14;
4. М.В. Немцова, Д.В. Залетаев – «Молекулярные аспекты предымплантационной диагностики» - Акушерство и гинекология 2005 г. № 2 стр. 10 – 12;
5. П.В. Новиков – «Состояние пренатальной диагностики врождённых и наследственных заболеваний в Российской Федерации (по материалам деятельности медико-генетических учреждений)» - Акушерство и гинекология 2006 г. № 2 стр. 3 – 7;
Похожие работы
... в крови активность ангиотензин-конвертирующего фермента. Вследствие уменьшения альвеолярной вентиляции развивается респираторный ацидоз (снижение рН и повышение РС02) . Пути оптимизации лабораторной диагностики туберкулеза Проводимая в последние годы большая организационная работа по осуществлению противотуберкулезных мероприятий позволяет ожидать снижения эпидемиологических показателей, но ...
... живые организмы-и удивительное многообразие генов, кодирующих эти белки. В геноме каждого человека есть какие-то области, определяющие его индивидуальность. Некоторые гены человека отличаются от генов крысы всего несколько нуклеотидами-знаками генетического кода. Другие гены у них разные, но одинаковые у двух людей. Изменчивость, связанная с существованием генов , подобных генам группы крови у ...
... каждого отдельного открытия прожить? Если бы не открыли - прожили бы. А.П. Назаретян: С вашей точки зрения, какие проблемы из тех, что встанут перед человечеством, без генетической инженерии разрешиться не смогут? Е.С. Платонов: Самые разные. Во-первых, это проблемы ранней диагностики и лечения наследственных аномалий. Во-вторых, возможности и задачи транспланто-логии в расширенном понимании. ...
... заболевания. Определение маркеров опухолей хотя и дорогой, но очень важный метод исследования, без которого в ряде случаев обойтись просто невозможно. Большинство лабораторных методов исследования требуют специального оборудования. Так, для подготовки и сохранения проб при заданной температуре, а также проведения бактериологических и серологических исследований используют термостаты, а также ...
0 комментариев