Навигация
Способы получения антибиотиков
4.3 Способы получения антибиотиков
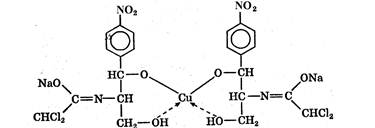
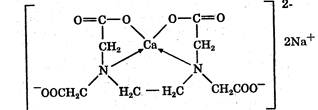
Более половины из известных антибиотиков продуцируют лучистые грибы рода Streptomyces — актиномицеты (стрептомицеты). К этой группе относятся стрептомицин и другие антибиотики-гликозиды (неомицины, канамицины), тетрациклины, левомииетин, антибиотики-макролиды (эритромицин, олеандомицин) и анзамицины (рифамицин), полиеновые антибиотики (нистатин) и др. Другим важным продуцентом являются лучистые (плесневые) грибы — различные виды рода Pénicillium. Они осуществляют биосинтез пенициллинов, а также некоторых противоопухолевых и противовирусных антибиотиков. Бактерии, главным образом рода Bacillus, продуцируют большинство антибиотиков- полипептидов. Они, как правило, высокотоксичны, но некоторые из них применяют в медицине (грамицидин, полимиксин и др.).
Способы получения антибиотиков можно подразделить на три основные группы.
I. Микробиологический синтез на основе плесневых или лучистых грибов. Этим способом получают антибиотики тетрациклинового ряда, природные пенициллины, антибиотики-гликозиды, макролиды и др.
II. Химический синтез из простых органических веществ. Его используют для получения антибиотиков, имеющих несложную химическую структуру (левомицетин и его производные).
III. Сочетание микробиологического и химического синтеза. На основе трансформации молекул природных антибиотиков получают полусинтетические антибиотики (полусинтетические пенициллины, цефалоспорины, тетрациклины и др.).
Получение большинства природных антибиотиков основано на биосинтезе, осуществляемом в клетке микроорганизма. Микробная клетка выполняет роль сложнейшей химической лаборатории, в которой происходят очень тонкие процессы, недоступные пока для органического синтеза, причем для их проведения не требуется высоких температур, повышенного давления, катализаторов.
Получение антибиотиков с помощью микробиологического синтеза включает такие основные этапы, как изыскание высокопроизводительных штаммов продуцентов, подбор питательных сред, процесс ферментации, выделение и очистка антибиотика.
Биосинтез выполняют в специальных аппаратах — ферментерах — вместимостью в несколько десятков тысяч литров. Ферментацию проводят «глубинным способом», который заключается в том, что рост плесени и образование антибиотика происходят по всей толще ферментационной массы. Каждый из микроорганизмов требует специальных условий ферментации: температуры, подачи воздуха (аэрации), определенной продолжительности процесса. Для обеспечения жизнедеятельности микроорганизма и максимального накопления антибиотика необходимы специальные питательные среды. Регулируя качественный и количественный состав ингредиентов питательных сред, можно существенно влиять на выход антибиотика. Питательные среды вначале подают в посевные аппараты (через установки непрерывной стерилизации). Здесь происходит выращивание культур. Затем смесь культуры и питательной среды перемещают в ферментер, где происходит процесс биосинтеза. В ферментер добавляют также пеногасители во избежание образования пены при аэрации.
Антибиотики выделяют из культуральной жидкости осаждением, с помощью адсорбционной или ионообменной хроматографии, экстракцией различными органическими растворителями или при различных значениях среды. Очистку антибиотика-сырца осуществляют хроматографическим методом или противоточной экстракцией с последующей перекристаллизацией. Выделенный кристаллический антибиотик подвергают тщательному химическому и биологическому контролю. Весь процесс производства антибиотиков осуществляют в строго соблюдаемых асептических условиях.
4.4 Методы анализа антибиотиков
Количественное определение большинства антибиотиков осуществляют биологическим методом, основанным на сравнительной оценке угнетения роста тест-микроорганизмов. Активность устанавливают диффузионным или турбидиметрическим методами. ГФ XI рекомендует для количественного определения метод диффузии в агар, заключающийся в сравнении действия определенных концентраций испытуемого и стандартного образцов антибиотика на тест-микроорганизм (ГФ XI, в. 2, с. 210).
Это испытание основано на способности антибиотиков угнетать рост микроорганизмов. Определение проводят методом диффузии в агар на плотной питательной среде путем сравнения размеров зон угнетения роста тест-микробов испытуемым препаратом и Государственным стандартным образцом (ГСО) антибиотика. Активность ГСО устанавливают, как правило, в соответствии с Международными биологическими или химическими стандартами.
Поскольку состав агаровой среды и условия выполнения биологического испытания одинаковы, величина зоны диффузии (в которой развитие тест-микроорганизма подавляется антибиотиком) зависит только от химической природы антибиотика и его концентрации. Процесс инкубации осуществляют в течение 16-18 ч при 36-38°С.
Расчет биологической активности производят по стандартной кривой, предварительно построенной на основании результатов определения пяти концентраций стандартного препарата. Умножением полученной концентрации (ЕД/мл) на степень разведения вычисляют активность (содержание ЕД) антибиотика в 1 мг препарата. Точность определений колеблется от 5 до 25%.
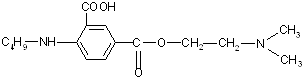
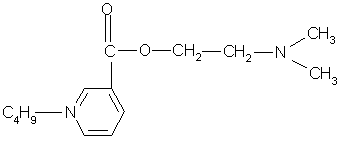
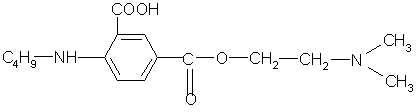
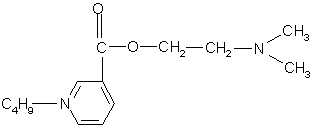
Единица действия (ЕД) представляет собой меру, которой выражается биологическая активность антибиотиков. За ЕД принимают минимальное количество антибиотика, подавляющего развитие тест-микроорганизма в определенном объеме питательной среды. Количественное выражение 1 ЕД отличается у различных антибиотиков. Например, у натриевой соли бензилпенициллина 1 ЕД соответствует 0,5988 мкг химически чистого вещества, а у стрептомицина основания, тетрациклина и его производных 1 ЕД соответствует 1 мкг химически чистого вещества.
В последние годы разработаны ускоренные биологические методы определения антибиотиков в биологических жидкостях.
Для установления концентрации антибиотиков аминогликозидов в крови больных применяют более простой модифицированный метод диффузии в агар. Ускорение определения до 2-6 ч вместо 16-18 ч достигается за счет создания максимально благоприятных условий для роста тест-микроорганизмов (уменьшения слоя питательной среды, оптимизации температуры инкубации и т.д.).
К ускоренным микробиологическим методам относят методы, основанные на подавлении изменений рН питательной среды в процессе роста тест-микроорганизмов. Концентрацию определяют сравнением изменений рН в средах испытуемых и стандартных образцов через 1,5 ч после начала инкубации. На этом принципе основан так называемый уреазный метод, заключающийся в наблюдении за изменением рН жидкой питательной среды, содержащей 2% мочевины. Выделяющийся в процессе роста микроорганизма аммиак вызывает изменение рН среды. Точность определений около 46%.
Ферментативный метод основан на инактивации аминогликозидов в крови специфическими ферментами (аденилтрансфераза и ацетилтрансфераза), продуцируемыми грамотрицательными микроорганизмами, устойчивыми к антибиотикам этой группы. Эти ферменты катализируют процесс аденилирования или ацетилирования аминогликозидов в присутствии 14С-аденозинтрифосфата или 14С-ацетилкоэнзима А. Они являются источником радиоактивности. Затем способом подсчета радиоактивности делают заключение о концентрации антибиотика. Определение занимает 1-2 ч.
Радиоиммунный метод основан на сравнительной оценке конкуренции антибиотика, меченного тритием, и испытуемого антибиотика по отношению к специфическим антителам иммунной сыворотки. Метод отличается очень высокой чувствительностью (0,003-0,01 мкг/мл), результаты получают в течение 1-2 ч, точность высокая (коэффициент вариации 4-5%).
На точность биологических методов оказывают влияние целый ряд факторов (характер питательной среды, условия инкубации, точность измерения зон угнетения роста и т.д.). Поэтому понятно стремление исследователей к замене биологических методов контроля химическими и физико-химическими. При этом обязательно должна соблюдаться адекватность предлагаемых методик по отношению к результатам биологического контроля.
Использование различных химических и физико-химических методов рассмотрено далее на примерах испытаний на подлинность и количественного определения ЛВ, относящихся к числу антибиотиков и их полусинтетических аналогов.
Похожие работы
... отдельные компоненты должны быть совместимы между собой в физико-химическом, фармакодинамическом и фармакокинетическом отношениях [8]. 1.3 Роль компьютера при создании новых лекарственных средств Ежегодно химики синтезируют, выделяют и характеризуют от 100 до 200 тысяч новых веществ. Многие из этих веществ проходят первичные испытания на выявление той или иной биологической активности. ...
... на фармакологический эффект, усложняет процесс изыскания новых Л В. Тем не менее современные методы исследования позволили определить предпосылки решения этой важной проблемы. 7 Предпосылки создания новых лекарственных веществ Изыскание новых ЛВ осуществляют различными путями. Ведущим направлением являются исследования в области модификации структуры известных природных БАВ. Одним из ...
... , основанной на поглощении атомами рентгеновского излучения. Ультрафиолетовая спектрофотометрия — наиболее простой и широко применяемый в фармации абсорбционный метод анализа. Его используют на всех этапах фармацевтического анализа лекарственных препаратов (испытания подлинности, чистоты, количественное определение). Разработано большое число способов качественного и количественного анализа ...
... моноклональных антител, даже если их получают на основе человеческих гибридом. Эта проблема не нова для медицины и не является непреодолимой. 02.09.10-15.09.10 18 Тема №18. Технология лекарственных форм в экстремальных условиях. По причинам возникновения чрезвычайные ситуации могут быть техногенного, природного, биологического, экологического и социального характера. Внутренними ...

0 комментариев