Навигация
Испытуемых (мужчины) в возрасте от 16-30 лет в динамике - 12 месяцев
45 испытуемых (мужчины) в возрасте от 16-30 лет в динамике - 12 месяцев.
Участники эксперимента были разделены на две группы. Вводдная и
заключительная части занятия в обеих группах были одинаковыми. Отличия
касались только основной части занятия. Первая (контрольная) группа
занималась по базовым программам бодибилдинга [Уайдер Д., 1993]. Во второй
(экспериментальной) группе основная часть занятия дополнительно включала
программы развития аэробной выносливости (езда на вело тренажере, бег на
третбане, прыжки со скакалкой), подобранных по К.Куперу [1989] в нашей
модификации с учетом уровня функциональной подготовленности занимающихся и
критериев оценки ММТ, ЖМТ и ИПМС, разработанных нами. Эта программа
тренировок была названа "способ оздоровления, коррекции массы и пропорций
тела "Аэробилдинг".
Полученные данные свидетельствуют о том, что одна силовая подготовка, хотя и приводит к увеличению мышечной массы, но не ведет к увеличению
интегрального показателя здоровья. Тогда как сочетание силовых и аэробных
упражнений по разработанным нами программам ведет как к эффективному
увеличению мышечной массы, так и к повышению уровня здоровья.
Итак, состав тела и в первую очередь соотношение жировой и мышечной
массы, являются факторами, влияющими на интегральные показателями здоровья.
С учетом влияния этих факторов мы можем прогнозировать оптимальный состав
тела, необходимый для оптимального состояния здоровья.
Этиология и патогенез ожирения
До последнего времени мы могли лишь с сожалением констатировать, что
более или менее точно причина развития ожирения может быть определена нами
не более чем в 3-5 случаях из 100, а именно при так называемом вторичном
ожирении, связанном с некоторыми эндокринными болезнями и поражением
центральной нервной системы. Действительно, не вызывает сомнения, что,
например, при гипотиреозе ожирение развивается вторично, ввиду недостатка
продукции тиреоидных гормонов и отмечающегося, в силу этого, торможения
процессов липолиза. Нарастание избыточной массы тела при инсуломе очевидно
связано с угнетением липолиза на фоне гиперинсулинизма и, возможно с
нарушением пищевого поведения и гиперфагией, которая очень характерна для
гиперинсулинизма, наблюдаемого при инсуломе. Гиперфагией может быть
обусловлено и ожирение, развивающееся при органическом поражении некоторых
зон головного мозга, ведающих пищевым поведением (церебральное ожирение). И
так далее.
В остальных же 95-97 случаях из ста, когда ожирение развивается первично,
и, в силу этого, не связано с какой либо конкретной причиной, механизм его
развития до конца не ясен. И, полагаем, нет нужды уточнять, что именно
отсутствие точных научных представлений о механизмах нарастания избыточной
жировой массы и создает ту неудовлетворительную ситуацию, которая
складывается сейчас в лечение ожирения.
Для объяснения природы заболевания было предложено довольно большое
количество гипотез, многие из которых не утратили своей актуальности до
настоящего времени, обсуждение же других может представлять интерес лишь в
историческом аспекте.
Вообще, история развития наших представлений об этиологии и патогенезе
ожирения отражает ту интересную ситуацию, когда гипотезы, казалось бы,
очевидные с самого начала, в дальнейшем при появлении новых данных уже
переставали нас устраивать. Истина, как бы, ускользала от нас, объяснения
становились все более замысловатыми, возникало ощущение, что дело это далеко
не такое простое и мы бросались в другую крайность. Возникали гипотезы об
ожирении, как о сложном полиэтиологическом и полипатогенетическом
заболевании, которые тут же вступали в противоречие с тем очевидным фактом,
что в основе заболевания лежит в общем то абсолютно физиологическое явление,
а именно способность жировой ткани накапливать жир.
Так, например, очень логичной выглядела схема развития заболевания,
ставящая во главу угла энергетический дисбаланс. Согласно этой гипотезе,
ожирение развивается при преобладании энергии потребления над энергией
расхода. Данная ситуация может развиваться как при избыточном потреблении
пищи, так и при малоподвижности (переход на более спокойную работу,
прекращение занятий спортом и т.д.). Логичным подтверждением этой схемы
являются общеизвестные факты - при увеличении потребления пищи масса тела
человека чаще всего нарастает, а при отказе от пищи снижается. При
уменьшении двигательной активности масса тела может увеличиваться, а при
интенсивных тренировках снижаться. И в плане доказательства соответствия
данной гипотезы истине нас должны интересовать два глобальных вопроса, а
именно, свойственно ли чрезмерное потребление энергии хотя бы большинству
больных ожирением, и действительно ли расход энергии у полных людей значимо
ниже такового у худых. Мы могли бы непосредственно перейти к анализу этих
вопросов, однако нам показалось целесообразным привести здесь небольшой
обзор, посвященный регуляции пищевого поведения и потребления энергии. Дело
в том, что в более ранних монографиях, посвященных ожирению, сам факт
чрезмерного потребления энергии полными людьми ни у кого не вызывал
сомнения. И повествование начиналось сразу с рассмотрения регуляции пищевого
поведения. Именно в регуляции авторы искали поломки ведущие далее к развитию
ожирения. Нам всегда представлялось сомнительным, что в основе болезни,
которая встречается практически у каждого второго взрослого человека, лежит
какая то сложная изолированная поломка, проявляющаяся только тем, что люди
становятся более склонными к еде.
Регуляция потребления энергии
Напомню, что элементарное пищевое поведение управляется ядрами
вентромедиального и латерального гипоталамуса. При разрушении
вентромедиальных ядер экспериментальное животное испытывает постоянную
гиперфагию, потребление пищи увеличивается и вес быстро нарастает. При
стимуляции же этих ядер потребление пищи сокращается, что при повторяющихся
воздействиях может привести к уменьшению жировой массы. Латеральная область
- при ее стимуляции у животных возникают импульсы на потребление пищи, а при
разрушении, наоборот, потребление пищи сокращается [Ян Татонь, 1985].
В целом схема регуляции пищевого поведения на уровне гипоталамических
ядер осуществляется следующим образом.
В состоянии сытости вентромедиальные ядра активны и осуществляют
сдерживающую импульсацию на латеральную область гипоталамуса - пищевое
поведение угнетено. При голоде, а так же на фоне инъекции инсулина
сдерживающая импульсация из вентромедиального ядра прекращается, латеральная
область становится активной и потребление пищи стимулируется. Передача
сдерживающих импульсов из вентромедиального гипоталамуса в латеральную
область осуществляется по нервным путям. При нарушении целостности этих
путей в эксперименте пищевое поведение усиливается - развивается гиперфагия.
Полагают, что клетки вентромедиальных ядер непосредственно реагируют на
уровень глюкозы в крови и если этот уровень достаточен, то тормозящее
влияние на латеральную область присутствует. Если уровень глюкозы снижается,
что бывает при голодании, или при инъекции инсулина, то тормозящее влияние
снимается, латеральная область активируется и возникает пищевое поведение.
Транспорт глюкозы в нервные клетки вентромедиальных ядер гипоталамуса
является инсулинзависимым. Другими словами, на уровне вентромедиальных ядер
оценивается не столько концентрация глюкозы в крови, сколько ее
метаболическая доступность [King B. M. et al., 1996].
В регуляции пищевого поведения кроме гипоталамических ядер участвуют и
другие отделы центральной нервной системы. Практически во всех вышележащих
отделах среднего мозга, а так же в коре обнаружены зоны, при разрушении или
при стимуляции которых возникают изменения пищевого поведения [King BM et
al., 1996; Vander Tuig J.G., Beneke W. M., 1996]. Сказанное позволяет
заключить, что пищевой центр, как таковой, это совокупность ядер,
расположенных на разных уровнях центральной нервной системы. Пищевой центр
очень тонко и сложно реагирует изменениями пищевого поведения на те или иные
изменения внешней и внутренней среды. В результате пищевые стимулы
приобретая сложную эмоциональную окраску, возникают как в условиях дефицита
метаболитов, так и в условиях, вроде бы не связанных с необходимостью есть,
например, при волнениях, при виде пищевых деликатесов или при виде богато
сервированного обеденного стола и т. д..
В ряде случаев при опухолевых процессах в центральной нервной системе, а
так же при некоторых других поражениях головного мозга у больных развивается
ожирение, связанное с патологической гиперфагией, что может говорить о
заинтересованности тех или иных структур пищевого центра. Это так называемое
церебральное ожирение. Его представленность в общей структуре заболеваемости
ожирением не больше 0,1%. В остальных же случаях связывать развитие ожирения
с поломками пищевого центра не представляется возможным.
Для полноты картины укажем, что участие центральной нервной системы в
развитии ожирения может не исчерпываться только влиянием нервных структур на
пищевое поведение. Доказано, что ядра вентромедиального гипоталамуса
участвуют и в регуляции термогенеза, или, говоря шире, в регуляции расхода
энергии. Это участие доказывается и экспериментами, когда после разрушения
ядер гипоталамуса масса тела экспериментальных животных нарастала даже в том
случае, если они содержались на рационах со сниженной калорийностью, а
применение диеты с низким содержанием белка, которая сама по себе
стимулирует термогенез, сдерживало нарастание веса у этих животных [Vander
Tuig J. G., Beneke W. M. 1996].
Далеко не до конца исследован вопрос о гуморальной регуляции пищевого
поведения. В последние два десятилетия появились исследования, показывающие
роль тех или иных нейропетидов и медиаторов нервной системы в регуляции
потребления пищи. Так, в частности установлено, что при повышении активности
катехоламинов в центральной нервной системе пищевое поведение снижается. На
этом принципе построено применение анорексигенных препаратов, агонистов
катехоламинов - амфепромона, фентермина, мазендола и других [Vander Tuig J.
G., Beneke W. M. 1996].
Исследована и роль другого нейротрансмиттера - серотонина. Показано, что
при повышение его уровня в гипоталамических структурах возникает чувство сытости и пищевое поведение снижается, а при уменьшении - наоборот
повышается. Установлено, что наиболее отчетливо повышение уровня серотонина
наблюдается после употребления пищи богатой углеводами или белками и связано
это с особенностями обмена и прохождения через гематоэнцефалический барьер
предшественника серотонина аминокислоты триптофана [Campbell D.B., 1991].
С влиянием серотонина на пищевое поведение связан аноректический эффект
некоторых препаратов, агонистов серотонина - фенфлюрамина, дексфенфлюрамина
и флувоксетина, усиливающих обратных захват этого амина в синаптической щели
и уменьшающих его разрушение моноаминоаксидазой. Интересно, что
первоначально эти препараты разрабатывались и предлагались как
антидепрессанты, а флувоксетин (прозак - Эли-Лили США), как антидепрессант
широко применяется и сейчас. Действительно, в основе многих депрессий лежит
снижение уровня мозгового серотонина. Известно, что иногда депрессия может
сопровождаться усилением пищевого поведения и гиперфагией. Существует
гипотеза, что переедание, ведущее к развитию ожирения может быть следствием
т.н. скрытых депрессий, когда человек, ощущая приближение депрессии, ест
много. Благодаря этому уровень мозгового серотонина повышается и настроение
улучшается [Campbell D. B., 1991].
Полагают, что со снижением уровня мозгового серотонина связаны и такие
пищевые нарушения, как гиперфагическая реакция на стресс и предменструальная
гиперфагия, а так же гиперфагия, развивающаяся обычно у курильшиков при
отказе от курения. Это положение подтверждается и тем, что применение
диетических регуляторов, агонистов серотонина (фенфлюрамин, дексфенфлюрамин)
довольно эфективно снимает данные виды гиперфагии [Campbell D. B., 1991].
Наряду с катехоламинами и серотонином известен еще ряд веществ, так или
иначе влияющих на пищевое поведение: нейропептид-Y, холецистокинин, лептин,
кортикотропит релизингфактор, эндорфины, некоторые аминокислотные
последовательности (фрагменты молекулы АКТГ) и др. Их влияние на потребление
пищи различно. Снижение потребления пищи связывают с лептином и
холецистокинином, а повышение - с нейропептидом Y и эндогенными опиатами
(эндорфинами) [Drewnowski A. еt al., 1995, Lauterio T. J., et al, 1999].
Подчеркнем, что сама пища, вернее нутриенты, в ней содержащиеся, являются
мощными и, скорее всего, самым главными регуляторами аппетита и пищевого
поведения. Установлено, что чувство голода возникает при уменьшении
содержания глюкозы в крови и в спиномозговой жидкости, а так же гликогена в
печени. Рецепция этого состояния осуществляется с участием афферентных
волокон вагуса и "пищевых" ядер гипоталамуса. При восстановлении в ходе еды
обычного содержания глюкозы наступает насыщение и потребление пищи
прекращается. Другими словавми, организм довольно жестко контролирует
потребление углеводов и их баланс. Обусловлено это скорее всего малой
емкостью депо гликогена. Действительно, по оценкам разных авторов
возможности накопления гликогена в организме не превышают 120 - 170 г
[Кендыш И. Н., 1985].
Несколько иначе обстоят дела с потреблением жира. Согласно данным ряда
исследований увеличение количества жира в пище не приводит к адекватному
уменьшению потребления других нутриентов и делает общее питание более
калорийным [Lawton C. L. et al., 1994, Buemann B., et al, 1998, Carmichael
A. R. 1999]. Эти исследования позволяют сделать вывод, что регуляция
потребления энергии на фоне диеты с большим содержанием жира нарушается, что
может привести к перееданию. Кстати, избирательное удаление жира из диеты не
ведет к адекватному увеличению потребления других нутриентов и к полной
энергетической компенсации дефицита жира [Pi-Sunyer F. X., 1990]. В отличии
от углеводов, возможности накопления жира могут достигать несколько десятков
килограммов. Видимо, этим обусловлено отсутствие тесной связи между
потреблением жира и массой его запасов.
Пищевые нарушения у больных ожирением
Примерно в 30-40% случаев у больных с ожирением регистрируются те или
иные пищевые нарушения, среди которых наиболее часто встречается
гиперфагическая реакция на стресс, компульсивная гиперфагия, углеводная
жажда и предменструальная гиперфагия [Aicianaineay O. Г., 1989; Wurtman J et
al., 1987, Greeno C. G., et al. 1999]. Данные нарушения часто сочетаются, то
есть у одного пациента могут в той или иной степени быть выражены некоторые
из них или даже все. Последнее, кстати, может свидетельствовать о близких
механизмах их возникновения и развития. Поскольку в отечественной литературе
сведений о них очень мало, дадим небольшую справку.
Гиперфагическая реакция на стресс как пищевое нарушение проявляется тем,
что при психоэмоциональном напряжении, волнении или сразу после окончания действия фактора вызвавшего стресс, у человека резко усиливается аппетит и
возникает желание есть. Чаще всего пища при этом не дифференцируется,
другими словами, люди едят все подряд, хотя есть исследования, показывающие,
что предпочтение в этом состоянии отдается все таки продуктам жирным и
сладким. Поскольку фактор, вызвавший стресс, может действовать долго, то и
чрезмерное потребление пищи может наблюдаться в течение длительного периода,
что далее может вести к нарастанию избыточной массы тела.
Очень близко к понятию гиперфагическая реакция на стресс лежит и понятие
компульсивная гиперфагия. В этом случае больные без видимых причин, или, во
всяком случае, по причинам, ими не осознаваемым потребляют большое
количество пищи, опять же чаще сладкой и жирной и чаще в виде так
называемых закусок, то есть в виде дополнительных приемов пищи, не связанных
с основными приемами еды. Полагают, что в основе компульсивной гиперфагии
лежат механизмы, близкие к таковым при гиперфагической реакции на стресс,
только в последнем случае причина, вызвавшая стресс осознается, а в первом -
нет. Как разновидность компульсивной гиперфагии рассматривается т.н. ночная
гиперфагия - императивное повышение аппетита в вечернее и ночное время
[Birketvedt G. S., et al. 1999].
Углеводная жажда. Отметим, что термин этот вошел в обиход тогда, когда
основную причину ожирения связывали именно с избыточным потреблением
углеводов. Сейчас чаще говорят просто о пищевой жажде, полагая, что для ее
удовлетворения пациентам требуется пища, оптимально, одновременно сладкая и
жирная - шоколад, мороженное, крем и т.п. В случае с углеводной жаждой
подобного рода пища похожа по своему эффекту на наркотик. В его отсутствии у
пациентов развивается тягостное депрессивное состояние, чем-то напоминающее
абстиненцию, тогда как при потреблении сладостей эти явления проходят
[Wurtman J et al., 1987].
Предменструальную гиперфагию можно рассматривать как одно из проявлений
синдрома предменструального напряжения. Явления гиперфагии, опять же чаще с
предпочтением сладкой и жирной пищи, наблюдаются у женщин в течение 4-7 дней
перед месячными.
Логично было бы предположить, что наличие пищевых нарушений ведет далее к
развитию ожирения, однако, большинство авторов воздерживаются от столь
категорических оценок. Дело в том, что данные нарушения, во-первых,
наблюдаются с примерно близкой частотой как у больных ожирением, так и у лиц
с нормальной массой тела [Wurtman J et al., 1987, Greeno C. G., et al.
1999]. Во-вторых, данные нарушения часто развиваются у больных уже после
того как у них развилось ожирение [Aicianaineay O. Г., 1989]. В третьих,
данные нарушения часто носят не постоянный характер. Многие пациенты
отмечают, что стрессовая гиперфагия наблюдается у них лишь иногда. Другие
замечают, что при волнениях одной интенсивности действительно возникает
желание есть, тогда как при волнениях большей или меньшей интенсивности
желание есть может полностью отсутствовать [Aicianaineay O. Г., 1989]. Не
удается доказать так же, что пациенты с пищевыми нарушениями потребляют
больше энергии [Greeno C. G., et al. 1999].
Механизмы возникновения пищевых нарушений до конца не установлены.
Полагают, что они связаны с нарушением трансмиссии серотонина в структурах
головного мозга, отвечающих за регуляцию пищевого поведения [Leibowitz S.
F., Alexander J. T. 1998]. В развитии пищевых нарушений принимают участие и
эндорфины. Во всяком случае, применение налоксона - антагониста опиатов,
ведет к уменьшению проявлений компульсивной гиперфагии [Drewnowski A. еt
al., 1995, Birketvedt G. S., et al. 1999].
Нельзя не согласиться с мнением многих авторов, что пищевые нарушения
представляют собой весьма серьезную проблему для лечения ожирения [Greeno C.
G., et al. 1999], поскольку желание есть у таких больных носит императивный
характер и распространяется, как правило, именно на те продукты, которые в
больших количествах есть нежелательно (шоколад, пирожные с кремом,
мороженное и т. п.). Установлено, что наличие пищевых нарушений является
одним из значимых предикторов повышения веса после его успешного снижения
[McGuire M. T., et al. 1999].
Потребление энергии у лиц, страдающих ожирением
На уровне бытового сознания очень популярна точка зрения, что полные люди
едят неадекватно много и все их попытки убедить нас в обратном
воспринимаются не более, чем попытки скрыть от нас истину. Мысль эта
популярна на столько, что активно поддерживается и многими врачами. Однако,
до настоящего времени нет ни одного сколь нибудь серьезного исследования,
демонстрирующего, что полные люди потребляют действительно в среднем больше
энергии, чем худые. Хотя попытки доказать это предпринимались многократно [Campbell L. V. 1998, Wells J. C. 1998].
I.Andersson и S.Rossner [1996] применили довольно оригинальный метод
исследования потребления энергии. Пациенты с ожирением, а так же лица,
отобранные для контроля, в течение трех месяцев звонили в исследовательский
центр всякий раз после еды и сообщали об использованных в пищу продуктах и
об их количествах. При этом было установлено, что и при ожирении и в
контроле была примерно одна и та же суточная калорийность, порядка 2700
ккал. Полные люди потребляли больше белков, а худые - больше алкоголя.
Достоверной разницы в потреблении других нутриентов авторы не отметили. Как
полные так и худые потребляли больше пищи (энергии) в выходные дни. Как
среди полных, так и среди худых встречались люди с большим потреблением
энергии (примерно одна треть). Как у полных, так и худых с большим
потреблением энергии это увеличение суточной энергетики пищи достигалось за
счет большего потребления жиров.
Согласно эпидемиологическим данным C.Bolton-Smith et al. [1994] имеется
неожиданная, но значимая обратная корреляция между ИМТ и суточной
калорийностью пищи. Другими словами, чем больше человек весит, тем меньше он
потребляет энергии.
Интересны исследования V.George et al. [1989]. Авторы изучали дневники
питания, полученные от 430 человек, как имеющих избыточных вес, так и
весящих нормально. Далее по критерию суточной калорийности авторы разделили
совокупную выборку на две группы. Одну составили люди с привычно большим
потреблением энергии, вторую те, калорийность дневного рациона которых была
небольшой. Оказалось, что люди с избыточным весом чаще встречались среди лиц
с небольшим потреблением энергии. И наоборот, худые в основном оказывались
среди лиц с большим потреблением калорий.
Отметим, что дневниковый метод анализа структуры питания некоторыми
авторами критикуется. Существует мнение, что полные люди сознательно или
неосознанно занижают данные о потребление пищи [Schutz Y. 1995]. Однако,
существуют исследования, показывающие, что занижение отчетов о потреблении
пищи одинаково характерно как для полных, так и для худых [Samaras K. et
al., 1999]. Укажем, что хорош этот метод или плох, в настоящее время он
остается единственным, позволяющий в естественных условиях исследовать
калорийность и нутриентный состав питания [Bandini L. G., et al. 1999]. Нам
представляется, что неточности, возникающие при дневниковом методе анализа,
могут быть уменьшены с помощью более основательного иструктажа испытуемых,
стандартизации используемых в пищу продуктов, блюд и порций.
Структура расхода энергии у больных ожирением
То, что патогенез ожирения может быть связан с нарушением расхода
энергии, как гипотеза выглядит довольно логично. И не случайно, что
состоянию расхода энергии у тучных больных изучалось всесторонне.
В достаточно большом числе работ показано, что расход энергии в покое у
больных ожирением не меньше, а наоборот, больше чем у лиц с нормальной
массой* [Astrup A., 1987; Bandini L.G et al., 1990, Weyer C., et al, 1999].
По данным ряда исследований, у больных с ожирением по сравнению с контролем
повышен и общий расход энергии [Bessard T. et al., 1983.; Bandini L. G. et
al., 1990, Wells J. C. 1998].
Что касается постпрандиального термогенеза, то по данным ряда авторов у
больных ожирением он достоверно ниже, чем в контроле [Shetty P.S. et al.,
1981; Astrup A. еt al., 1987]. Это нарушение определенным образом связано с
нарушением реакции симпато-адреналовой системы на пищевые раздражители. Так,
по некоторым данным, уровень норадреналина в ответ на прием пищи у больных
ожирением хотя и увеличивался, но значительно меньше, чем у лиц с нормальным
весом [Astrup A. еt al., 1987].
В исследовании J. Salas-Salvado и соавторов [1993] у больных с ожирением
по сравнению с контролем обнаружено уменьшение образования тепла, как после
нагрузки глюкозой, так и после физической нагрузки. Это позволяет заключить,
что у больных с ожирением страдает не только постпрандиальный термогенез, но
и термогенез, связанный с физической деятельностью*.
Основываясь на данных, рассмотренных выше, можно утверждать, что у
пациентов с ожирением нарушена структура расхода энергии. Вместе с тем нет
ни одного убедительного исследования, демонстрирующего, что полные люди
расходуют значимо меньше энергии чем худые [Wells J. C. 1998, Weyer C., et
al, 1999].
Завершая анализ концепции энергетического дисбаланса, как возможной
причины ожирения, укажем, что несмотря на свою кажущуюся логичность она
имеет ряд довольно серьезных противоречий. В самом деле, не является твердо
доказанным ни то, что больные ожирением потребляют больше энергии, чем
худые, ни то, что они по сравнению с худыми меньше ее тратят. С позиций энергетического дисбаланса довольно трудно ответить на вопрос, почему при
одном и том же состоянии потребления и расхода энергии далеко не все
заболевают ожирением. Даже в экспериментах на добровольцах, когда на
довольно длительное время энергетика их питания на 50-70% превосходило
суточную норму, находились такие, масса тела которых не нарастала [Horton T.
J et al., 1995].
С позиций энергетического дисбаланса трудно объяснить и многочисленные
факты, когда масса тела пациентов неуклонно нараставшая до этого, затем, без
каких либо усилий с их стороны на длительное время стабилизировалась, причем
пациенты не меняли ни образа питания ни образа жизни.
С позиций этой гипотезы довольно трудно объяснить природу рецидивов
ожирения. Так, в частности, оказались несостоятельными попытки связать
склонность к рецидивам с некоторым снижением энергетики расхода, которое
может наблюдаться в ходе диетотерапии, так как после окончания соблюдения
диеты и возвращения к исходному питанию энергорасход так же быстро
возвращается к исходному уровню.
Роль дисбаланса нутриентов в патогенезе ожирения
С позиций гипотезы энергетического дисбаланса нет разницы и в том, в виде
какого именно нутриента - жира, или углеводов, поступает избыток энергии.
Такая разница действительно могла бы отсутствовать если выполняется по
крайней мере два условия. Во-первых, жиры и углеводы, на долю которых
приходится порядка 85-90% поступающей энергии, должны свободно переходить
друг в друга, и, во-вторых, окисление их должно быть одинаково доступным и
на энергетическом уровне одинаково выгодным для организма.
Однако исследования, специально посвященные этому вопросу, показывают,
что и первое и второе условие не исполняется организмом в полной мере.
Энергетический эффект (разница между затраченной и полученной энергией)
расщепления углеводов выше, чем таковой от расщепления жиров [Acheson K. J.
et al., 1984, Flatt J-P., 1997], а утилизация жира непосредственно из пищи
более проста и в энергетическом плане более выгодна, чем формирование жира
из углеводов [Acheson K. J. et al., 1988]. Другими словами, при достаточном
поступлении этих субстратов в организм, последний при окислении отдает
предпочтение углеводам, а при утилизации - жирам.
Установлено, что хотя взаимопереход жиров и углеводов, вещь возможная,
однако, представленность его в организме весьма невелика, то есть метаболизм
каждого из этих нутриентов относительно автономен. Это подтверждается и
данными, Acheson K. J. et al. [1988] согласно которым, у человека источником
накопления жира в депо служит в основном диетический жир, а не углеводы,
поступающие с пищей [Acheson K. J. et al., 1984, Acheson K. J. et al., 1988;
Horton T. J. et al., 1995; Willett W. C., 1998]. Синтез жиров de novo из
углеводов возможен только при их одномоментном и массивном, порядка 500 г,
поступлении в организм [Acheson K. J. et al. 1988, Hellerstein M. K et al.,
1991; Horton T. J. et al., 1995; Willett W. C., 1998].
В достаточно большом количестве работ принципиально показано, что
увеличение доли жира в пище, приводит в большей степени к увеличению его
накопления, чем к повышению окисления жирных кислот. Так, по данным Flatt et
al. [1985] добавление маргарина к стандартному завтраку не увеличивает
окисления жиров по крайней мере в течение следующих девяти часов. Согласно
данным Schutz et al. [1992], добавление жира к стандартному суточному
рациону не приводит к заметным изменениям окисления липидов в течение суток.
Возможности утилизации жиров и углеводов существенно различаются. Емкость
депо углеводов в организме лимитирована и составляет порядка 70 г в печени и
Похожие работы
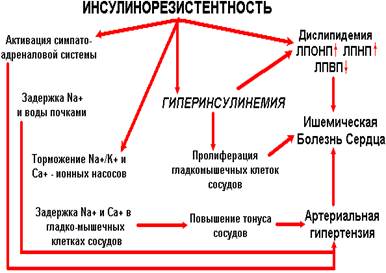
... клиники и установления диагноза СД 2 типа. Ряд исследований свидетельствует о развитии МС вследствие длительного течения АГ, которая приводит к снижению периферического кровотока и развитию ИР. Артериальная гипертензия и метаболический синдром АГ часто является одним из первых клинических проявлений МС. В основе патогенеза АГ при МС лежит ИР и вызванная ею компенсаторная ГИ в сочетании с ...
... диабета 2-го типы составляет в Европе 40-60 миллионов человек. В индустриальных странах распространённость МС среди населения старше 30 лет составляет 10-20 %, в США — 25 %. Ранее считалось, что метаболический синдром – это удел людей среднего возраста и, преимущественно, женщин, обычно его частота возрастает в менопаузальном периоде. Однако проведённые под эгидой Американской Ассоциации Диабета ...
... , скорость обменных процессов в тканях и энергетические затраты организма. В результате нарастает масса тела. [1] 3.2.3 Надпочечниковый механизм Надпочечниковый (глюкокортикоидный, кортизоловый) механизм ожирения включается вследствие гиперпродукции глюкокортикоидов в коре надпочечников (например, при болезни или синдроме Иценко-Кушинга). Под влиянием избытка глюкокортикоидов активизируется ...
... основе выявлялся отек, значительное полнокровие сосудов, т.е. преобладают микроциркуляторные нарушения. Выводы Таким образом, наличие МС: – является основой полиморбидности в гастроэнтерологии; – характеризуется системными однотипными изменениями органов пищеварения, обусловленными преимущественно микроциркуляторными нарушениями; – характеризуется отсутствием четкой клинической симптоматики, а ...
0 комментариев