Навигация
Становление и развитие контрольно-аналитической службы в России
4 Становление и развитие контрольно-аналитической службы в России
Служба контроля качества Л С в России имеет более чем 200-летнюю историю, которая неразрывно связана со становлением всей системы управления фармацевтической деятельностью. В течение этих лет в России все положения, касающиеся контроля качества ЛС, имели законодательно закрепленную силу и утверждались высшими органами государственной власти. В первой половине XVT1 в. был создан Аптекарский приказ, который осуществлял в числе прочих задач контроль за качеством изготовления Л С в аптеках. В 1784 г. Указом Сената было введено требование обязательной экспертизы новых Л С. Сенат выдавал разрешения на их реализацию. Дальнейшее развитие система обеспечения качества Л С в России получила с изданием первого Аптекарского Устава 1789 г., 8 из 23 параграфов которого были посвящены вопросам контроля качества ЛС. Этим же Уставом впервые в России был утвержден реестр разрешенных к применению Л С. Реестр в дальнейшем ежегодно пересматривался Министерством внутренних дел, в ведении которого находилось фармацевтическое законодательство.
В становлении государственного контроля качества Л С в России важную роль сыграло законодательное принятие Сенатом в 1807 г. заключения о специфическом характере фармацевтической деятельности. Суть его состояла в том, что торговля лекарствами отличается от всех прочих видов торговли и должна находиться под ближайшим надзором правительства.
Во втором издании Аптекарского Устава (1836 г.) требования к условиям обеспечения качества ЛС были расширены и направлены на соблюдение условий правильного хранения ЛС в аптеках. В 1892 г. вопросы контроля качества Л С включены в Устав врачебный. В нем закреплялась обязательность представлен™ данных о составе нового ЛС Медицинскому Совету, который оценивал его эффективность и устанавливал область применения. Уставом были определены критерии разрешения к медицинскому применению новых ЛС: оригинальность, преимущество по эффективности действия.
В конце XIX — начале XX в. в России в связи с расширением промышленного производства ЛС были разработаны и ут ■ верждены «Правила об условиях, порядке разрешения и обустройстве фабрик, лабораторий и особых отделений химических заводов для изготовления сложных фармацевтических препаратов», В них регламентированы требования к условиям производства ЛС. Они во многом сходны с современными требованиями, предъявляемыми при лицензировании.
Качество ввозимых зарубежных ЛС контролировалось в соответствии с «Правилами для пропуска заграничных лекарств». которые также во многом напоминают современные требования. При разрешении ввоза Л С допускалось и\ боасекие от химического исследования в том случае, если заявитель представлял акт химического анализа ввозимого ЛС выполненного таким русским или иностранным учреждением, компетентность которого признана Медицинским Советом. В случае изменения дозы и вида ЛФ требовалось новое ходатайство с описанием состава и технологии получения и с приложением анализа, произведенного компетентной лабораторией.
Таким образом, система государственного контроля качества лекарств в России имела четкую законодательную основу и была ориентирована прежде всего на надзор за соблюдением условий изготовления и контроля качества лекарств.
В связи с изменением социально-экономических условий в России после 1917 г. произошла полная реорганизация системы аптечной службы и государственного контроля качества лекарств. В первые годы советской власти (декабрь 1918 г.) было подписано постановление Народного Комиссариата здравоохранения РСФСР «О национализированных аптеках, аптечных предприятиях, об организации управления ими и органах, их снабжающих». Общее руководство аптечной службой страны, включая надзорные и контрольные функции, возлагалось этим постановлением на Фармацевтический отдел Наркомздрава (НКЗ).
В начале 1919 г. на Первом Всероссийском съезде фармацевтических подотделов медико-санитарных отделов областных и уездных Советов рабочих, крестьянских и красноармейских депутатов были определены задачи аптечной службы страны. В соответствии с ними была введена в аптеках должность контролера проверки правильности изготовления Л С ассистентами. Организация контрольно-аналитической службы аптечных управлений началась с создания в 1923 г. контрольно-аналитических лабораторий в Москве, Ленинграде, Свердловске, а затем и в других городах. Продажа отечественных и зарубежных Л С допускалась только после предварительного химического анализа в контрольно-аналитических лабораториях. Выход в свет в 1926 г. первой советской фармакопеи создал необходимую научную основу организации контроля качества лекарств. Начиная с 1929 г. КАнЛ вменено в обязанность проведение выборочного контроля качества ЛС, изготовленных в аптеках.
Большое внимание улучшению контрольно-аналитической службы было уделено на проведенном в 1926 г. Всероссийском фармацевтическом совещании. На нем обсуждались итоги работы по созданию государственной системы лекарственного обслуживания населения. В 1926-1927 гг. было завершено формирование системы аптечного дела в СССР утверждением устава, прав и обязанностей аптекоуправлений при отделах здравоохранения. В 1930-1935 гг. созданы республиканские аптечные управления в РСФСР и па Украине, а затем и в других союзных республиках. Координацию их деятельности осуществляла Аптечная инспекция, созданная в 1936 г. при НКЗ.
Большое внимание уделялось контролю качества лекарств в процессе их производства на предприятиях химико-фармацевтической промышленности. Согласно утвержденной приказом ВСНХ СССР от 24.12.25 г. №224 «Инструкции о порядке открытия заводов и лабораторий для производства фармацевтических препаратов» управляющий и владельцы предприятия должны были нести ответственность, в т.ч. уголовную, за доброкачественность выпускаемых Л С и за соответствие их требованиям действующих в СССР фармакоией и другой НД.
В 30-е гг. обеспечение качества Л С промышленного изготовления возлагалось на отделы технического контроля (ОТ К) и контрольные лаборатории предприятий. Несмотря на принимаемые меры, на проведенном Аптечной инспекцией НКЗ СССР в 1938 г. совещании по улучшению качества ЛС указывалось на недопустимо высокий уровень брака Л С как промышленного (до 7,1% серий), так и аптечного (до 27,6%) изготовления. Основными причинами брака Л С промышленного производства были: отсутствие должного контроля за качеством ЛС; несоблюдение требований технологических процессов производства; антисанитария в содержании помещений, аппаратуры, тары; недоброкачественное сырье и небрежное отношение к его хранению; недостаточное количество и качество профилактических мероприятий; крайне неблагоприятные условия для работы контрольных лабораторий и ОТК заводов. Характерно, что ряд этих недостатков имеет место и на современных ХФЗ и для их устранения требуется неуклонное соблюдение Правил GMP.
В последующие годы (1936-1940) аптечные управления усиливают внимание к контролю качества лекарств. Во всех областных центрах были созданы КАнЛ в соответствии с приказом НКЗ СССР от 3 марта 1939 г. К концу 1937 г. в стране их имелось 188. Это дало возможность расширить сферу деятельности КАнЛ и проводить выборочную ежемесячную копт- рольную проверку лекарств, приготовленных в аптеках. В 1938 г. по решению НКЗ в аптеках начинают создаваться контрольно-аналитические кабинеты и столы. К началу 1941 г. в стране имелось 295 КАнЛ и 1133 контрольно-аналитических кабинетов и столов. Наряду с увеличением числа подразделений контрольно-аналитической службы в стране большое внимание уделялось улучшению качества их работы. КАнЛ к этому времени стали организационно-методическими центрами контрольно-аналитической службы. Были определены виды внутриаптечного контроля качества ЛС, которые совершенствуются и не теряют своего значения в настоящее время.
Учитывая высокий процент брака, НКЗ СССР пересмотрел задачи и методы работы контрольно-аналитической службы. В 1939 г. НКЗ СССР утвердил «Инструкцию о внутриаптечном контроле», предусматривающую профилактический, опросный, органолептический, физический и, по мере надобности, качественный химический анализы. Управление химико-фармацевтической промышленности обязало предприятия при отправке товаров прилагать копии анализов с заключением ОТК заводов. В 1939 г. НКЗ утвердил положение о КАнЛ, контрольно-аналитических кабинетах при аптеках, инструкцию по оценке качества ЛС, изготавливаемых в аптеках. В результате принятых мер уже в 1940 г. удельный вес неудовлетворительно приготовленных лекарств снизился до 1%,
Война нанесла огромный урон здравоохранению и аптечной системе страны. Было уничтожено большое число аптек, аналитических лабораторий и других аптечных учреждений, вдвое сократилось число фармацевтов. Огромные задачи стоили перед аптечными работниками по восстановлению системы бесперебойного обслуживания населения лекарствами.
В 1945 г. Аптечная инспекция была реорганизована в Главное аптечное управление (ГАПУ) Наркомздрава СССР. Несмотря на трудности послевоенного периода, уже к 1946 г. число аптек превысило довоенный уровень, было восстановлено большинство разрушенных КАнЛ. Увеличившееся в годы Великой Отечественной войны количество фарманевтичес- ких фабрик при аптечных управлениях обусловило необходимость совершенствования системы контроля качества выпускаемых ими ЛС, В связи с этим было пересмотрено положение об ОТК на этих предприятиях, в котором конкретизированы функции и значительно расширены права ОТК.
В 1951 г. ГАПУ Минздрава СССР обязало КАнЛ контролировать качество всех Л С, поступающих на аптечные склады, независимо от наличия результатов заводского анализа. Через 5 лет был введен дифференцированный режим контроля качества Л С, который был несколько изменен в 1963 г. Он предусматривал обязательный посерийный контроль всех новых ЛС, поступающих на аптечные склады от предприятий, в течение двух лет с момента освоения их промышленного выпуска; ядовитых Л С, растворов в ампулах и флаконах для инъекций, остальные проверялись выборочно. Введение данного порядка способствовало активизации работы КАнЛ по контролю качества ЛС промышленного производства.
Вопросы контроля качества Л С всегда находились и находятся в центре внимания деятельности правительства страны. До 1962 г. в Советском Союзе государственный контроль качества Л С был возложен на Инспекцию по контролю за качеством медицинской продукции (Инспекция), которая являлась подразделением Управления лекарственных средств и медицинской техники с инспекцией по качеству МЗ СССР. Инспекция осуществляла контроль за качеством медицинской продукции, выпускаемой отечественными предприятиями, а также получаемой по импорту и отправляемой по экспорту. Постановлением Совета Министров СССР от 14.05.62 г. №438 Инспекция была реорганизована в Государственную инспекцию по контролю за качеством лекарственных средств и изделий медицинской техники МЗ СССР, которой были подчинены Государственный научно-исследовательский институт стандартизации и контроля лекарственных средств (ГНИИСКЛС) и КАнЛ аптечных управлений.
Просуществовавшая почти 30 лет (до начала 90-х гг.) государственная система контроля качества ЛС осуществлялась на общесоюзном (предварительный и последующий контроль), региональном (на аптечных базах), территориальном — республиканском, краевом, областном (на аптечных складах) и учрежденческом (в аптеках) уровнях. Система была ведомственного характера, функционировала в условиях централизованного распределения ЛС и предусматривала контроль их качества на всех этапах. Все синтетические ЛВ, антибиотики, витамины и препараты из животного и растительного сырья, выпускаемые промышленными предприятиями любых ведомств, подлежали государственному контролю качества в ГНИИСКЛС.
Следующий этап государственного контроля качества ЛС осуществлялся на аптечных складах (базах). Утвержденная приказом МЗ СССР от 28.12.84 г. №1475 Инструкция определяла порядок контроля, согласно которому при поступлении на склад предписывалось проведение тщательного осмотра внешнего вида Л С, упаковки и маркировки выборочно от каждой поступившей серии.
Контроль качества импортных ЛС отличался от порядка контроля качества отечественных Л С. Предварительный контроль проходили поступившие на центральные базы ГАПУ МЗ СССР первые три серии впервые закупленных ЛС. Объем последующего контроля дифференцировался по группам ЛС (по всем показателям НД, на стерильность и пирогенность выборочно). При поступлении на аптечные склады от транзитных баз импортные ЛС подлежали посерийной проверке внешнего вида, приведенного в НД.
Контрольно-аналитические лаборатории осуществляли контроль качества ЛС, изготовляемых в аптеках, аптечных пунктах 1 группы, выпускаемых фармацевтическими фабриками и поступающих на аптечные склады от промышленных предприятий, а также организационно-методическое руководство деятельностью аптечных учреждений и предприятий в части контроля качества ЛС. Поскольку значительное количество ЛС в тот период изготавливалось в аптеках, была разработана и введена система внутриаптечного контроля качества Л С, охватывающая все стадии процесса изготовления Л С и включающая как предупредительные мероприятия, так и различные виды контроля (письменный, органолептический, опросный, физический, химический и др.). Проверка качества ЛС в аптеках осуществлялась провизорами-аналитиками аптек и КАнЛ и регламентировалась приказом Минздрава СССР от 30.04.85 г. №582.
Вопросы контроля качества лекарств с каждым годом приобретают все большее значение. Они всегда находились и находятся в центре внимания деятельности аптечных учреждений. По состоянию на 1 января 1990 г, в системе «Союзфарма- ция» функционировшю 277 КАнЛ. Они осуществляли общее руководство контролем качества ЛС, которые поступали на 270 аптечных складов (баз) от отечественных предприятий и по импорту, а также изготавливались 78 фармацевтическими фабриками и более чем 30 000 аптеками страны. В этих лабораториях работало 2100 специалистов, в том числе 94,3% провизоров. Кроме того, в аптеках страны имелось около 9500 аналитических кабинетов и более 23 000 контрольно-аналитических столов, В них контролировали качество лекарственных средств 14 300 провизоров. А всего в аналитической службе заняты более 19% провизоров от общего их числа. Сеть контрольно-аналитических лабораторий была размещена по административно-территориальному признаку. В СССР существовали республиканские, областные и городские лаборатории, а также лаборатории на аптечных складах и фармацевтических фабриках. Большинство из них сохранилось как в России, так и в странах ближнего зарубежья.
Таким образом, к началу 90-х гг. в России сформирована принципиально новая система государственного управления качеством ЛС, призванная обеспечивать эффективность и безопасность ЛС в условиях рыночных отношений. Правовые основы этой системы были затем еще отрегулированы в Федеральном законе «О лекарственных средствах».
В последующие до конца XX в. годы, пройдя длительный путь развития, претерпев неоднократные изменения, в России сложилась и действует единая многоуровневая служба контроля качества Л С. В целях совершенствования системы регистрации и усиления контроля за качеством отечественных и импортных Л С в Российской Федерации была создана контрольно-разрешительная система обеспечения качества ЛС, утвержденная приказом Минздрава России от 02.09.93 г. №211. Контролирующие функции выполняются на региональном уровне 165 территориальными КАнЛ и центрами кон- троля качества лекарственных средств (ЦККЛ).
Похожие работы
... отдельные компоненты должны быть совместимы между собой в физико-химическом, фармакодинамическом и фармакокинетическом отношениях [8]. 1.3 Роль компьютера при создании новых лекарственных средств Ежегодно химики синтезируют, выделяют и характеризуют от 100 до 200 тысяч новых веществ. Многие из этих веществ проходят первичные испытания на выявление той или иной биологической активности. ...
... названия. В качестве основного синонима будут также приводиться торговые названия, под которыми JIC зарегистрировано или производится в Российской Федерации. 4 Методологические основы классификации лекарственных средств Количество ЛС в мире непрерывно возрастает. На фармацевтическом рынке в России в настоящее время обращается более I8 ООО наименований ЛС, что в 2,5 раза больше, чем в 1992 г. ...
... с высокой пропускной способностью (HTS-метод). Сегодня HTS-метод (High Throughput Screening) повсеместно используется в фармацевтической индустрии для открытия новых лекарственных средств. С помощью высокоскоростной компьютеризованной технологии сотни тысяч веществ проверяются на активность относительно исследуемой молекулы, предназначенной для взаимодействия[8]. 2. Применение компьютерного ...
... процесс разделения нестабильных веществ можно проводить в холодильной камере. Выделенное соединение подвергают структурному химическому исследованию, а затем изучают его фармакологическое действие. Получение лекарственных веществ методом культуры тканей высших растений В нашей стране заготавливаются десятки тысяч тонн ЛРС. Однако потребность в БАВ, содержащихся в растениях, с каждым годом ...
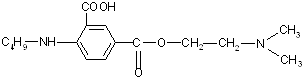
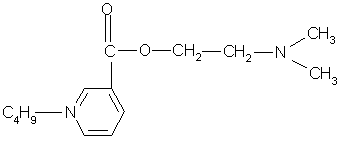
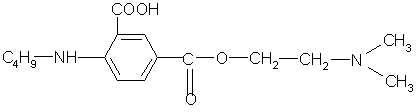
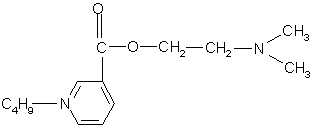

0 комментариев