Зміст.
Вступ. 2
Розділ 1. Медичні полімери. 5
1.1 Полімери медичного призначення. 5
1.2 Класифікація медичних полімерів та сфери їх використання. 6
1.3 Вимоги до медичних полімерів. 8
Розділ 2. Механізми використання медичних матеріалів в біологічних системах.
2.1. Особливості створення та використання протезів. 10
2.1. Полімерні шовні матеріали та полімерні клеї медичного призначення. 14
2.3. Полімери у стоматології. 16
2.4.Використання полімерних матеріалів у офтальмології. 17
2.5 Використання полімерних кровозамінників. 18
Розділ 3. Новітні методи терапії із використанням полімерних матеріалів. 20
Розділ 4. Створення штучних органів і тканин. 24
Висновок. 33
Список використаної літератури. 34
Вступ.
Усім відома здатність окремих органів тіла відновлюватися при різних травмах, пораненнях і т.п. Так, при ушкодженні шкірного покриву відбувається активація системи, що згортає кров, кров згортається й закупорює судини, запобігаючи тим самим повному знекровлюванню й загибелі організму. Пізніше на цьому місці формується нова тканина.
Разом з тим, іноді, залежно від причини травми і її розмірів організм буває не в силах сам упоратися із загоєнням і відновленням якого-небудь органа й потребує допомоги ззовні, тобто хірургічного або іншого втручання. У найбільш складних випадках може знадобитися повна заміна ушкодженого органа або тканини.
І тоді виникає питання, чим заміняти? Можна використати відповідний орган, узятий у донора, живого або померлого, або спеціальний протез, здатний відтворювати, хоча б частково, біологічну функцію вилученого органа. Відзначимо, що на сьогоднішній день практично всі органи людини, за винятком мозку й шлунка, піддаються моделюванню з метою створення відповідних протезів.
У наш час значних успіхів досягла трансплантація органів від донора до хворого. Початок ери трансплантації відкрив професор Бернард, який 3 грудня 1967 р. в Кейптауні пересадив чоловіку серце дівчини, що загинула в автомобільній катастрофі. Після операції реципієнт прожив 18 днів і помер не через відмову пересадженого органа, а в результаті ослаблення імунної системи організму й запалення легень. До сьогодні у світі виконані вже сотні таких операцій, і життя деяких хворих продовжене на десять і більше років. У ряді клінік проведені й більш складні операції по одночасному пересадженню серця й іншого органа, наприклад, печінки або обох легенів. У грудні 1986 р. англійський хірург Д. Уоллворк уперше у світі здійснив одночасно потрійну трансплантацію. Разом з тим, незважаючи на приголомшливі успіхи трансплантології, залишаються невирішеними проблеми наукового, морально-етичного та юридичного характеру, які в значній мірі стримують більше широке застосування методу пересадки органів. Існуючі банки органів і тканин можуть забезпечити матеріалом не більше 10 % хворих, що потребують операцій. Частину проблем намагаються вирішити шляхом використання гетеротрансплантантів, тобто органів і тканин, узятих у тварин. У січні 1984 р. у США була навіть проведена операція по пересадці серця мавпи дівчинці на 15-й день після її народження. Дитина прожила три тижні, після чого в неї перестали функціонувати нирки.
Найважливіша проблема трансплантації – відторгнення пересадженого органа живим організмом – ще далека від остаточного вирішення. Кожен організм на поверхні практично всіх своїх клітин має спеціальний набір білків, названих антигенами сумісності. Будучи однаковими в різних органах і тканинах того самого організму, у різних індивідуумів антигени різні. Тому всяке пересадження живої тканини, узятої від іншого організму, приводить в дію імунну систему. Виявивши й розпізнавши чужорідні клітини й молекули, лімфоцити руйнують їх.
Більшість із перерахованих проблем не виникає при використанні конструкцій із синтетичних матеріалів. Крім того, і це надзвичайно важливо, немає принципових проблем з масовим виготовленням полімерних протезів: це все-таки не банк органів, який формується роками. І хоча зараз полімерні протези вже міцно ввійшли в клінічну практику, необхідний був революційний стрибок у психології лікарів, що заміняють живий орган на «неживу» холодну матерію. Однак реальність наших днів така, що вже зараз, по даних департаменту науки й техніки Японії, у світі штучні кістки й суглоби одержали 17,5×104 чоловік, кровоносні судини – 7,5 ×105, клапани серця – 3,0×105, штучну нирку – 7,2 × 105 чоловік.
Настільки стрімке зростання споживання синтетичних полімерних матеріалів у медицині викликало нову, надзвичайно важливу проблему, а саме проблему біологічної сумісності полімерів. Переважна більшість матеріалів медичного призначення функціонує в прямому або непрямому контакті із тканинами організму. Щоправда, вони не викликають імунної реакції, та відторгнення, але наслідки такого контакту можуть виявитися настільки ж несприятливими, якщо заздалегідь не прийняти рішучих заходів.
Для того щоб зробити цей, загалом, очевидний зараз висновок, ученим і фахівцям довелося провести численні дослідження, у результаті яких вдалося сформулювати основні вимоги до полімерів медичного призначення.
Саме використання нових полімерних матеріалів у трансплантології та медичній практиці дозволить покращити лікування людей, багатьом надасть можливість вести активний спосіб життя.
Розділ 1. Медичні полімери.
Полімерні матеріали – матеріали на основі високомолекулярних сполук – речовин, що складаються з однотипних груп атомів, з'єднаних хімічними зв'язками. Основну масу високомолекулярних сполук одержують або методами хімічного синтезу з мономерів – продуктів переробки природної сировини (нафти, газу, вугілля й ін.), або шляхом переробки природних полімерів (наприклад, целюлози, лігніну). До складу полімерів завжди входять наповнювачі, барвники, пластифікатори, стабілізатори й інші домішки, що регулюють функціональні й технологічні властивості полімерів. При виготовленні виробів компоненти, що входять до складу полімера ретельно перемішують для одержання однорідної пластмаси, з якої пресуванням, литтям під тиском, екструзією (формуванням виробів шляхом видавлювання полімерних матеріалів через профілюючий інструмент), вальцюванням або іншим технологічним методом одержують готовий виріб.
1.1 Полімери медичного призначення.Для медичних цілей використовують полімерні матеріали загальтехнічного призначення, а також спеціальні полімерні матеріали медичного призначення. З перших виготовляють будівельне й санітарно-технічне устаткування лікувальних установ, посуд, предмети догляду за пацієнтами, деталі різних приладів, дослідницької й лікувальної апаратур, інструментів, посуду для аналітичних лабораторій й ін. Застосування полімерних матеріалів замість традиційних матеріалів (металів, скла) обумовлено їх кращими технологічними властивостями, комплексом фізико –механічних характеристик, можливістю переробки у вироби масового вжитку й одноразового застосування. Крім загальтехнічних, до цих полімерних матеріалів пред'являються додаткові санітарно-гігієнічні вимоги – мінімальне виділення в навколишнє середовище газоподібних продуктів, що не перевищує ГДК; нерозчинність у миючих розчинах; можливість стерилізації дезінфікуючими розчинами, газами, УФ-опроміненням, γ-випромінюванням.
Найбільше широко застосовуються полімерні матеріали на основі полівінілхлориду, сополімерів стиролу, поліпропілену, поліметилметакрилату, поліуретанів, фенолформальдегідних смол.
Спеціальні полімерні матеріали медичного призначення призначені для безпосереднього контакту з живим організмом – в ендопротезах і матеріалах для відбудовчої хірургії, у матеріалах і виробах для відбору крові, у вигляді інструментів для внутріорганних досліджень, апаратури, що заміняє функції органів, компонентів терапевтичних і діагностичних засобів. Основу таких полімерних матеріалів становлять синтетичні й природні високомолекулярні сполуки, які не мають на живий організм шкідливого впливу. За характером взаємовпливу на організм полімерні матеріали поділяють на біоінертні, біосумісні та біоактивні.
1.2 Класифікація медичних полімерів та сфери їх використання.Біоінертні полімерні матеріали: поліетилен, поліпропілен, фторопласт, силікони, поліметилметакрилат практично не змінюють своїх властивостей під впливом середовищ живого організму. У вигляді готових виробів або матеріалів їх використовують для створення штучних судин (поліетилентерефталат, поліпропілен, фторопласт), клапанів серця (силікон, фторопласт, поліпропілен, поліетилентерефталат), кришталиків очей (поліметилметакрилат), частин ендопротезів суглобів (поліаміди, фторопласт), як штучні сухожилля, м’язові зв'язки (поліпропілен, поліетилентерефталат), деталей апаратів штучної нирки, штучного серця (поліетилен, поліпропілен, поліакрилати, силікони, ефіри целюлози).
Біосумісні полімерні матеріали здатні поступово піддаватися біодеструкції або розчиненню в біологічних середовищах, що дозволяє найбільш сприятливо здійснювати відбудовні хірургічні операції, використовуючи регенераторні функції організму. Матеріали сополімерів вінілпіролідона, акриламіду, акрилатів, поліамідів у вигляді комбінованих протезів, сіток, плівок, листових матеріалів, піноматеріалів, клейових композицій, що розсмоктуються, застосовують для тимчасового заміщення тканин при резекціях, зміцненні стінок органів, закриття ран внутрішніх органів, заповнення післяопераційних порожнин. У травматології біосумісні полімерні матеріали із співполімерів вінілпіролідона й метилметакрилату застосовують для заміщення дефектів кісткової тканини, у вигляді різних сполучних елементів, для склеювання кісткових уламків. У серцево-судинній хірургії аналогічні полімерні матеріали використають при протезуванні судин, зміцненні серцевої стінки.
Біоактивні полімерні матеріали можуть мати фізіологічну активність завдяки лікарським препаратам, що утримуються в них у вигляді компонента. Застосовують готові лікарські форми у вигляді композицій, де високомолекулярні з'єднання або відіграють роль основи-носія (очні лікарські плівки з різними препаратами – сульфапіридазином, пілокарпіном, тринітролонг, динітросорбілонг), або мають власну фізіологічну активність макромолекул – полімерні ліки, антитромбогені полімерні матеріали, штучні плазмо- і кровозамінники, ентеро- і гемосорбенти. Для біосумісних і біоактивних полімерних матеріалів використовують високомолекулярні сполуки на основі N-вінілпіролідона, акриламіду, деяких акрилатів, похідні целюлози.
1.3 Вимоги до медичних полімерів.Добре відомо, що зовсім чистих речовин практично не існує. Те ж, але в набагато більшій мірі відноситься й до полімерів. Полімери, які випускаються промисловістю, містять велику кількість різних низькомолекулярних речовин (залишки мономерів і каталізаторів полімеризації, барвники, стабілізатори, наповнювачі, які в живому організмі здатні вимиватися з полімерів і здійснювати негативний вплив на цей організм. Отже, вміст таких домішок повинен бути зведений до мінімуму, що за токсикологічними оцінками, наприклад для кремнійорганічних полімерів, повинен становити 10-5 - 10-6 %. А це вже наближається до чистоти матеріалів для мікроелектроніки.
Необхідність задоволення всіх цих численних вимог, вимагала істотної зміни культури виробництва багатьох полімерних матеріалів. У технічно розвинених країнах виникла ціла галузь промисловості, що спеціалізується на випуску таких полімерів. У більшості випадків виробництво полімерів медичного призначення й виробів на їхній основі здійснюється у стерильних умовах, що виключають найменше забруднення полімерних продуктів. Все це вимагає, звичайно, додаткових капіталовкладень у виробництво й переробку полімерів медичного призначення. Однак наявність стабільного й зростаючого збуту таких виробів, а також сам характер розв'язуваних при цьому проблем, зв'язаних зі здоров'ям людини, є головними факторами, що стимулюють розвиток виробництва таких полімерів. Так, у США в 1976, 1980, 1981 й 1982 р. у медицині було використано 535, 650, 816 й 900 тисяч тонн синтетичних смол і пластмас, що склало близько 5 % від їхнього загального споживання в країні. В останні роки медицина по обсягу споживання синтетичних пластмас займає в США четверте місце (після пакувальної промисловості, будівництва, електротехніки й електроніки).
Разом з тим зміни культури виробництва полімерів у багатьох випадках виявилося недостатньо для задоволення усе більше зростаючих вимог практичної медицини. На базі вивчення всіх аспектів взаємодії полімерів з живим організмом були успішно синтезовані зовсім нові речовини й матеріали з незвичайним комплексом властивостей, що істотно розширили області застосування синтетичних полімерів у медицині.
Недостатньо лише одержати чистий полімер, його необхідно ще переробити у виріб і простерилізувати. Часто застосовуваний для стерилізації окис етилену не тільки сорбується полімерами, але й може з деякими з них реагувати, істотно змінюючи властивості їхньої поверхні.
Імплантовані в організм на тривалий термін полімери повинні мати необхідний комплекс хімічних, фізичних і механічних властивостей для забезпечення необхідних функцій і зберігати ці властивості протягом усього часу перебування в організмі. Навпроти, якщо мова йде про тимчасовий імплантат, наприклад хірургічні нитки, то матеріал повинен повністю розкладатися в живому організмі, виконавши свої функції, без виділення токсичних продуктів.
Звичайна взаємодія полімерних речовин з фізіологічним середовищем супроводжується або розчиненням полімеру без зміни його молекулярної маси, або руйнуванням полімеру шляхом гідролізу основних зв'язків макромолекули або шляхом фагоцитарного руйнування (фагоцитоз – захисна клітинна реакція на сторонні предмети, що полягає в активному захоплюванні клітинами сторонніх часток з наступним їхнім внутрішньоклітинним перетравлюванням). При цьому біодеструкції піддаються навіть полімери вкрай інертні з хімічної точки зору. Наприклад, нейлон, що спочатку використовувався для виготовлення протезів аорти, при імплантації в кровоток втрачає свою міцність на протязі 3 років.
Руйнування полімерного імплантанта в живому організмі може бути причиною ускладнень, які виникають не відразу, а згодом, навіть при дотриманні всіх необхідних правил оперування й за умови відносної хімічної інертності самого полімеру. Якщо продукти біодеградації полімерів (а вони звичайно більш токсичні, чим вихідний полімерний матеріал) створюють дратівну дію, їхня присутність у зоні імплантації буде підтримувати вогнище хронічного асептичного запалення. Говорячи про вимоги, висунуті до полімерів медичного призначення, звичайно згадують і необхідність відсутності в них канцерогенної, мутагенної й іншої токсичної дій, хоча зараз ще не ясно, які саме властивості синтетичних полімерів визначають ці властивості.
Розділ 2. Механізми використання медичних матеріалів в біологічних системах.
Медичні полімерні матеріали широко використовуються у медичній практиці. Вище було розглянуто основні галузі їх використання. Розглянемо основні методи використання їх у медицині та пов’язані із цим проблеми.
2.1. Особливості створення та використання протезів.Загалом кажучи, всі полімерні матеріали сприймаються клітинами організму як сторонній предмет. Первинна реакція на імплантований полімер неспецифічна і є звичайною реакцією подразнення на сторонній предмет. Звичайно ця реакція являє асептичне запалення, ступінь якого визначається як хімічними, так і фізичними властивостями полімерного матеріалу. Найбільш сприятливим результатом такого запалення вважається утворення тонкої з’єднувальної капсули. Медичні аспекти поводження того або іншого матеріалу в живих тканинах досить різноманітні: в одних випадках сполучна тканина обволікає протез, в інших проростає крізь нього; серцевий клапан, протез артерії або протез жовчної протоки, навіть якщо вони виготовлені з одного матеріалу, «вживлюються» в організм по-різному – якщо вживлюються взагалі. При протезуванні м'яких тканин важливо домагатися максимальної відповідності фізико-механічних властивостей протеза і його форми аналогічним параметрам живої тканини.
Кровоносні судини пронизують весь живий організм. Саме в них циркулююча кров переносить до тканин й органів поживні речовини й кисень, видаляє продукти метаболізму, транспортує виділені залозами внутрішньої секреції гормони, які регулюють функції органів й обмін речовин, здійснює термостатування організму. Припинення припливу крові до будь-якого органа порушує процеси обміну речовин, що веде до повної або часткової його загибелі. Не вдаючись у можливі причини цього явища, відзначимо лише, що інфаркт, інсульт, тромбофлебіт, емболії, атеросклероз і багато інших хвороб часто пов'язані зі звуженням судин і зниженням кровопостачання тієї або іншої ділянки органу. Дослідження показали, що і в штучній судині і на поверхні будь-якого полімерного протеза, що омивається потоком крові, утворюються тромби, більше того, утворення тромбів другому випадку відбувається набагато швидше, ніж на поверхні матеріалу біологічного походження.
Утворення тромбу – це природна захисна реакція організму на введення чужорідного тіла. Згадаємо, що будь-який поріз супроводжується руйнуванням стінки кровоносної судини, і кров вступає в контакт із новим для неї середовищем – повітрям або зовнішніми тканинами кровоносної судини. При цьому відбувається активація присутніх у крові спеціальних факторів згортання, що приводить до перетворення розчинного білка крові - фібриногену в нерозчинний фібриновий згусток. У переплетених між собою фібринових нитках застрягають елементи крові – еритроцити, лейкоцити, тромбоцити, потік крові утрудняється, а потім і зовсім припиняється.
Аналогічне явище спостерігається й при контакті крові із синтетичними полімерами, навіть самими інертними з них. Уже в перші години, а іноді й перші хвилини на границі полімерного ендопротеза й крові відбувається утворення фібринових згустків. Щоб уникнути або хоча б сповільнити тромбоутворення на полімерній поверхні, необхідно створювати особливі, гемосумісні полімери. Але перш ніж приступитися до цього, потрібно з’ясувати, які процеси відбуваються на поверхні між кров’ю та полімерним матеріалом.
Перший акт взаємодії крові з будь-яким полімерним імплантатом полягає в адсорбції на його поверхні білків плазми й деяких інших речовин – так званих контактних факторів згортання крові. Тепер імовірність утворення тромбу залежить не стільки від властивостей самого полімеру; скільки від природи адсорбованих на поверхні білкових речовин.
Надзвичайно важливим при відбудовній пластиці є й правильний вибір розташування імплантанта відносно тканин протезованого органа. Неодмінною умовою проростання сполучною тканиною пор або комірок протеза є його розташування між шарами тканин. Якщо протез стикається із тканиною живого організму тільки з одного боку, а інша поверхня протеза звернена в просвіт порожнього органа, то не відбувається повної інкапсуляції протеза. Сполучна тканина покриває протез лише із зовнішньої сторони. Саме тому всі спроби відновлення безперервності стравоходу, сечоводів, жовчних проток звичайно закінчуються невдачею.
Говорячи про медичні полімери, не можна не згадати про можливості використання цих матеріалів у травматології й ортопедії. Серед різного роду недуг, що ведуть до смерті, травми в наш час вийшли на третє місце після серцево-судинних й онкологічних захворювань. Тому проблемам лікування травм, усунення їхніх наслідків, повернення потерпілим здатності до повноцінного життя приділяють у наш час значну увагу.
Найбільше поширення в практичній травматології й ортопедії одержали полімерні ендопротези зв'язок і сухожиль. Ці протези являють собою поліефірні стрічки або сітки, особливим способом прикріплені до суглобів. Зараз відомо більше 50 різних методів таких оперативних втручань: на колінному й тазостегновому суглобах, на стопі, верхніх кінцівках і т.д. Треба відзначити, що міцність поліефірних стрічок, що застосовуються, набагато перевершує необхідну міцність сухожиль або зв'язок. Крім того, у результаті проростання стрічки рубцевими тканинами штучна зв'язка перетворюється в рубцево-полімерний тяж, що перевершує первісну міцність зв’язок у декілька разів.
Успішно застосовуються комбіновані протези. Так, наприклад, протез тазостегнового суглоба (а у наш час у світі з такими протезами ходять близько двох мільйонів чоловік) являє собою роз’ємне з’єднання пластмасової чашки з надвисокомолекулярного поліетилену й голівки з ніжкою з спеціальної сталі. Основними показаннями до застосування таких протезів є коксартроз (відкладення солей), особливо двосторонній, асептичний некроз голівки стегна, поліартрит і т.д. Прогрес у цій області безсумнівний. Однак цей же прогрес породив і нові проблеми. Якщо їх сформулювати в загальному вигляді, то від штучних матеріалів потрібні функціональність і безпека, які для протезів повинні бути збережені, по можливості, на весь післяопераційний час життя людини, тобто протягом 20-70 років.
Якщо перша й друга вимоги можуть бути задоволені звичайними засобами хімії, техніки й медицини, то забезпечення достатньої довговічності функціонування стало центральною й найбільш важкою проблемою. Найпоширеніший й, здавалося б, логічний підхід – вибір для виготовлення протезів найбільш міцних і стійких матеріалів – звичайно приводить до серйозних невдач.
Було з'ясовано, що після імплантації поступово руйнувалися й піддавалися зношуванню самі матеріали й конструкції або несучі елементи біологічних органів і тканин. У кожному із цих випадків через кілька років відбувалися порушення опорної здатності кінцівки й різкі зміни кінематики; іншими словами, порушувалася побудова й робота тієї або іншої біомеханічної системи людини.
Всі існуючі на даний час протези ще надто недосконалі. Так, протези кістки незалежно від того, зроблені вони з титану або з поліпропілену, монолітні. У місцях контакту із природною кісткою неминуче концентруються напруги, і рано або пізно, це приводить до руйнування, причому руйнується не протез, а кістка.
Природна конструкція цих тканин на відміну від штучних завжди анізотропна. Різниця між модулями пружності уздовж кістки й впоперек відрізняється приблизно втроє. Кістка – це спіральна структура п’ятирівневої організації, а протез кістки – моноліт без якого-небудь натяку на ієрархію структур. Хоча в останній час ведуться роботи по створенню полегшених замінників кісток на основі порожнистих полімерних трубок.
2.2. Полімерні шовні матеріали та полімерні клеї медичного призначення.Для скріплення післяопераційних ран використовують шовні матеріали, виготовлені з волокон медичного призначення. Іноді користуються спеціальними медичними клеями або інертними до середовища організму металевими скріпками. Але все-таки гнучкі волокнисті матеріали дотепер займають у цій області чільні позиції.
Здавалося, виходячи з функціонального призначення шовного матеріалу, що ніяких особливих проблем при його створенні виникнути не повинно. Головне, щоб цей матеріал міцно з'єднував оперовані ділянки тканин. Виявилося, що це зовсім не так, оскільки шовний матеріал звичайно залишається в тілі на більш-менш довгий строк з усіма наслідками, що випливають звідси.
Історично першими шовними матеріалами були дріт із благородних металів, сухожилля тварин і шовкові нитки. Природно, що із появою хімічних волокон робилися спроби застосувати їх у хірургії. Промислове виробництво найпоширенішого нині поліамідного волокна було освоєно в 1940 р., а наприкінці 50-их років були випущені поліефірні, поліакрилонітрильні й поліолефінові волокна. На основі цих волокон і були створені сучасні шовні матеріали. Щоб захистити їх від проникання мікроорганізмів і зробити нитки більше зручними в роботі, їх іноді покривають гладким шаром іншого полімерного матеріалу. Для надання волокнам стійкості до дії мікроорганізмів їх модифікують антимікробними речовинами. Модифікацію здійснюють просочуванням волокон розчином, емульсією або суспензією таких речовин, введенням антимікробних речовин у прядильний розчин або розплав полімеру перед формуванням волокна або приєднанням таких речовин до полімеру хімічними зв'язками. Варіювання способу модифікації дозволяє в широких межах регулювати тривалість антимікробної дії, що обумовлене тим, що антимікробна речовина дифундує з волокна в навколишнє середовище й там діє на мікробні клітини. Аналогічним способом вдається створювати волокна, що володіють не тільки антимікробною, але й гемостатичною, анестезуючою дією. Антимікробні волокна знайшли застосування при виготовленні одягу, білизни й засобів особистої гігієни. Тканини на основі таких волокон нормалізують мікробний стан шкіри й забезпечують лікування й профілактику гнійних захворювань, викликуваних мікробною інфекцією, у клініках різного профілю, гарячих цехах, шахтах, космічних апаратах.
У світі випускають зараз більше п'ятдесяти типів різних шовних матеріалів. Деякі з них повільно розсмоктуються в організмі, інші, навпроти, маючи високу міцність у початковий період після операції, через певний час починають швидко руйнуватися й виводитися з організму у вигляді нешкідливих речовин. Синтетичні нитки, що розсмоктуються, вигідно відрізняються від ниток біологічного походження. Не уступаючи по міцності ниткам зі звичайних полімерів, вони на відміну від кетгуту й колагену не мають побічної дії, пов'язаної з відповідною реакцією організму на введений чужорідний білок.
Широкі перспективи в хірургії внутрішніх органів і тканин відкриває використання різних клейових композицій. Заміна традиційного шовного матеріалу на клеї – значний крок в удосконалюванні хірургічних методів, тому що при з'єднанні тканин за допомогою клеїв забезпечується герметичність з'єднання, можливість різкого скорочення швів, що накладають, і навіть безшовне з'єднання, прискорення операцій і скорочення часу загоєння рани. Першими представниками полімерних клеїв у медицині були сполуки на основі ефірів ціанакрилової кислоти. Ці ефіри мають високу реакційну здатність і швидко тверднуть на повітрі під впливом слідів вологи або речовин основного характеру. Клеї цієї групи застосовують для склеювання тканин живого організму при операціях на органах дихання й травлення, у серцево-судинній хірургії, хірургії печінки й т.д. Ще одним представником полімерних клеїв медичного призначення є розроблений київськими хіміками поліуретановий клей КЛ-3. Він складається із клейової основи й прискорювача полімеризації. Час його тверднення можна регулювати від трьох хвилин до півгодини. Цей клей утворює пористу й високоеластичную плівку, що створює гарні умови для її заміщення сполучною тканиною. Оскільки клей і продукти його біодеградації нешкідливі для організму, його можна використати в тих випадках, коли потрібно покрити великі по площі тканинні дефекти або заповнити патологічні порожнини. Зараз такі клеї успішно застосовують для закриття кишкових і бронхіальних свищів, при операціях на шлунково-кишковому тракті й судинах, у щелепно-лицьовій хірургії.
Непогані результати отримані при використанні поліуретанових композицій для усунення аневризм. Через порушення міцнісних властивостей стінки кровоносної судини витончена стінка не витримує тиску крові й утвориться випинання – аневризматичний мішок. При цьому різко порушується кровоток і створюється загроза розриву судини. Отож, застосування поліуретанових протекторів дозволяє зміцнити судину, сам протектор із часом (1,5-2 роки) заміщається тканинами.
2.3. Полімери у стоматології.Із всіх галузей медицини найбільше «полімероємна» - стоматологія. Ефективність стоматологічної допомоги багато в чому залежить від якості застосовуваних матеріалів, у тому числі й полімерних. У стоматології синтетичні полімери використають у якості пломбувальних матеріалів, захисних покриттів, для виготовлення зубних протезів. Досить поширений, так званий, склоіономерний цемент для пломбування передніх зубів і тріщин в емалі. Він являє собою суміш поліакрилової кислоти зі склом спеціальних складів, виготовленим з подрібненої суміші кварцу, глинозему, кріоліту, плавикового шпату й фосфату амонію або із суміші кварцу, глинозему й карбонату кальцію. Частки скла, вплавлені в полімерну матрицю, утворять композицію більше міцну, чим портландцемент.
Поступово в стоматологічних клініках світу з'являється нова група полімерних матеріалів, які тверднуть без застосування хімічних ініціаторів, які часто не відповідають токсикологічним вимогам. У нових композиціях тверднення здійснюють фотохімічно під дією ультрафіолетового випромінювання кварцової лампи.
2.4.Використання полімерних матеріалів у офтальмології.Важливим напрямком впровадження полімерних матеріалів у медицину є їхнє застосування в офтальмології. Використання в очній хірургії полімерних клеїв, у першу чергу на основі ціанакрилатів, сприяло здійсненню операцій, раніше технічно дуже важких або навіть нездійсненних через складність накладання дрібних швів. Не меншу популярність отримали контактні лінзи й штучні кришталики. Тверді лінзи, виготовлені з поліметилметакрилату, пацієнти носять обмежений час і знімають перед сном. Однак внаслідок твердості, що викликає відчуття дискомфорту, і непроникності поліметилметакрилату для кисню, що в деяких випадках приводило до розвитку кисневого голодування рогівки ока й пов'язаного з ним набряку, багато пацієнтів не можуть адаптуватися до таких лінз. В останні роки для виготовлення твердих лінз стали застосовувати ацетобутират целюлози, що добре змочується слізною рідиною й майже в сто разів більше проникний для кисню, чим поліметилметакрилат. Але й у цьому випадку потрібне періодичне знімання таких лінз.
Тому особливий інтерес представляють гідрофільні, проникні для кисню м'які контактні лінзи для тривалого носіння. Як матеріал для виготовлення таких лінз найбільше поширення одержав гідрогель на основі поліоксіетилметакрилата, що володіє хорошими оптичними й механічними властивостями й зберігає дані властивості в широкому інтервалі температур і значень рН. Внаслідок високого змісту води в гідрогелях (до 80%) вони добре сполучаються із тканинами ока, не викликаючи подразнення. Зростання виробництва м'яких контактних лінз значно випереджає зростання виробництва лінз із поліметилметакрилату. Так, у США в 1979 р. контактними лінзами користувалися 10 мільйонів чоловік, приблизно половина з них – м’якими лінзами, а в 1982 р. ці цифри склали відповідно 14 й 10 мільйонів чоловік.
До останніх досягнень в області офтальмології варто віднести створення м'яких лінз для корекції астигматизму й лінз для корекції далекозорості. Найбільш перспективними з них є біфокальні лінзи, тому що тільки в США біфокальними окулярами користуються близько 48 мільйонів чоловік. Уже створені косметичні забарвлені контактні лінзи, а також лінзи, що володіють лікувальною дією й використовуються при пересадках рогівки ока, кон’юнктивітах, вірусних захворюваннях рогівки.
Важливою областю використання полімерів в офтальмології стало виготовлення поліметилметакрилатних штучних кришталиків, які імплантуються пацієнтам після видалення власних кришталиків, уражених катарактою. Такі кришталики майже повністю відновлюють нормальний зір, причому пацієнти обходяться без допомоги окулярів або контактних лінз. Тільки в США в 1985-1987 р. число імплантацій штучного кришталика складало близько 700 тисяч у рік.
2.5 Використання полімерних кровозамінниківВідомо, що при гострій крововтраті (порядку 20-30 % циркулюючої крові) досить часті випадки так званого геморагічного шоку з летальним результатом. Найбільш результативний засіб у таких випадках – компенсація крові ззовні. Разом з тим оскільки шок викликається втратою саме обсягу крові, тобто кількісним фактором, то вивести організм із коматозного стану можна й застосуванням інших агентів, наприклад, ізотонічного розчину хлориду натрію. Однак час втримання такого замінника в кровоносних судинах невеликий. Час циркуляції в крові високомолекулярних сполук, природно, набагато більший, що й стало основою для їхнього застосування як плазмозамінників. Призначені для заміни плазми крові, вони мають протишокову дію, підвищують артеріальний тиск при гострій крововтраті, утримують рідину в кров'яному руслі, а іноді сприяють виведенню токсичних речовин. З фармакологічної точки зору для всіх плазмозамінників основним їхнім компонентом є водорозчинний полімер. Як полімери найбільше поширення одержали частково гідролізований декстран (препарати «Поліглюкін» й «Реополіглюкін»), полівініловий спирт («Полідез»), полі-1М-вініл-піролідон («Гемодез») і деякі інші.
Полімерні плазмозамінники є двох типів: протишокові й дезінтоксикаційні. Перші призначені для тривалого циркулювання в крові (порядку 1-2 діб, протягом яких відбувається фізіологічне відновлення крововтрати) і тому мають досить високу молекулярну масу. Плазмозамінники другого типу володіють більш яскраво вираженою лікарською дією; вони здатні взаємодіяти з токсинами й виводити ці токсини з організму. Отже, основними вимогами до цих полімерів повинні бути здатність реагувати з токсинами й відносно невисока молекулярна маса. У найбільш повній мері таким вимогам задовольняє полівінілпіролідон з молекулярною масою 12 – 27 тисяч. До 80 % цього препарату виводиться через нирки протягом перших чотирьох годин після вливання. Із-за цієї обставини цей препарат знаходить широке застосування при лікуванні гострих токсичних інфекцій, отруєнь.
Розділ 3. Новітні методи терапії із використанням полімерних матеріалів.
Відомо, що будь-який лікарський засіб складається із двох основних частин – активної діючої частини й компонентів лікарської форми. Роль останніх полягає в створенні сприятливих умов для прояву дії лікарської речовини в організмі. Застосовувані лікарські форми – мазі, таблетки, капсули, розчини для ін'єкцій – у більшості випадків не оптимальні з погляду виконуваних ними функцій. Вони не забезпечують тривалої й рівномірної подачі лікарської речовини в потік крові і практично не сприяють його спрямованому транспорту в хворий орган. Так, звичайні таблетки, розпадаючись у шлунку або кишечнику, подають речовини, що втримуються в них, у кровоток за дуже невеликий строк. В організмі ця речовина розподіляється відповідно до її фізико-хімічних властивостей, і тільки в деяких випадках в орган-мішень потрапляє скільки-небудь значна частка уведеної лікарської речовини (звичайно не більше 10 % від уведеної кількості).
Багато лікарських речовин досить швидко нейтралізовуються в організмі, у результаті чого тільки невелика частина їх робить корисну дію. Інша ж частина в більшості випадків шкідлива, тому що проявляє фізіологічну активність не в потрібному місці організму. Швидкий вивід лікарської речовини з організму обумовлює необхідність її нового введення.
Проміжок часу від моменту введення ліків до припинення їх лікувальної дії можна збільшити, підвищивши їх кількість у дозі, що вводиться одноразово. Але це приведе до ще більш високого піка концентрації ліків в крові й тканинах і більш яскраво вираженій побічній дії. Отже, дуже важливо, щоб концентрація лікарської речовини в організмі весь час була на певному постійному рівні.
Такого ефекту можна домогтися за допомогою принципово нової лікарської форми, так званої макромолекулярної терапевтичної системи. У таких системах використається не фізіологічна активність полімерів, а їх оригінальні фізико-хімічні властивості, такі, як здатність розчиняти в собі лікарські речовини й потім виділяти їх за рахунок дифузії.
Макромолекулярні терапевтичні системи мають розміри від часток міліметра до декількох сантиметрів. Їх можна вводити усередину організму або прикріплювати на шкірі або слизовій оболонці. У більшості випадків лікарська речовина не пов'язана з елементами системи, і її виділення являє собою фізичний процес, здійснюваний по заданій програмі. Найбільш простим типом таких систем буде розчин або суспензія лікарської речовини у твердому, біосумісному полімері, наприклад полідиметилсилоксані. У цьому випадку швидкість виділення лікарської речовини визначається швидкістю розчинення полімеру. Саме на такому принципі побудована протизаплідна макромолекулярна терапевтична система «Прогестасерт», що забезпечує попередження вагітності протягом одного року. Така система прикріплюється до матки й подає в її порожнину стероїдний контрацептив – прогестерон. Це речовина дуже нестійка – вона майже повністю руйнується в печінці при першому ж проходженні із током крові. Тому раніше доводилося користуватися таблетками із синтетичними аналогами прогестерону, більш токсичними, які викликали алергічні реакції. При новому підході такі небажані наслідки практично виключаються. Важливо знати, що дія такої системи може бути перервана в будь-який момент часу, варто тільки витягти її з порожнини організму. Однак у багатьох випадках, особливо тоді, коли система імплантована, наприклад, під шкіру, це достоїнство перетворюється в недолік. У зв'язку із цим усе більше широке поширення в наш час знаходять системи біосумісних полімерів, здатних поступово переходити в розчин при контакті з рідкими середовищами організму. Процес переходу в розчин може бути чисто фізичним розчиненням або відбуватися за рахунок розриву основних зв'язків макромолекули полімеру з утворенням розчинних низькомолекулярних продуктів. Швидкість виділення лікарської речовини в цьому випадку визначається швидкістю розпаду твердої полімерної матриці, а необхідність витягу матриці після того, як лікування завершилося відпадає по причині її розчинення.
На основі біорозчинних полімерів розроблені лікарські засоби для лікування гінекологічних, стоматологічних й інших захворювань. У промислове виробництво впроваджений новий високоефективний засіб „Тринітролонг”, що містить класичний препарат, який використовується при стенокардії,- нітрогліцерин. Строк функціонування „Тринитролонга” коливається від двох до чотирьох годин. Саме стільки часу й потрібно для надійного попередження приступу. А починає цей препарат діяти через лічені секунди.
Трохи більше складну будову мають матриці мембранного типу й осмотичні міні-насоси, основною робочою частиною яких є полімерна напівпроникна мембрана. Один з найбільш простих пристроїв цього типу запропоновано для лікування онкологічних захворювань. Безпосередньо на пухлину імплантують резервуар, одна зі стінок якого зроблена з поліоксіетилметакрилатної мембрани, проникної для лікарської речовини.
Від резервуара відходять і виводяться назовні дві тонкі трубки, через які його наповнюють різними лікарськими розчинами, що надходять через мембрану по заданій програмі до ураженого органа.
Зараз уже створені десятки різного роду пристроїв, що дозволяють тією чи іншою мірою реалізувати принципи контрольованої подачі лікарської речовини. Серед цих пристроїв найбільш універсальний тип являють собою, імовірно, нашкірні терапевтичні системи, використовувані для тривалої й безперервної подачі лікарських речовин через неушкоджену шкіру. Ці системи являють собою тонкі (порядку 1 мм) вироби, що складаються з декількох шарів. Резервуар з лікарською речовиною із зовнішньої сторони захищений непроникною металевою фольгою, а із внутрішньої – мікропористою мембраною, що регулює швидкість виділення лікарської речовини під дією градієнта концентрації, з боку мембрани, зверненої до шкіри, є адгезив для кріплення всієї системи.
Такі системи подають лікарську речовину в кровообіг й у цьому аналогічні таблеткам, ін'єкціям або мазям. Однак на відміну від них лікарська речовина подається з певною швидкістю протягом декількох діб. Мембрани для таких систем виготовляють із ефірів целюлози, поліпропілену й т.д. Їхню проникність регулюють технологічними прийомами, наприклад, зміною пористості або коефіцієнта скрученості пор.
На стадії експериментальної перевірки зараз перебувають системи, принцип дії яких у максимальному ступені відповідає фізіологічному. Добре відомо, що надходження будь-якої фізіологічно активної речовини в кровоток контролюється регуляторними системами організму. Кожна речовина з'являється в той момент й у тім місці, коли й де вона потрібна. На аналогічному принципі зворотного зв'язку побудована, наприклад, система для виділення інсуліну. Ця система створена із проникної для води, інсуліну й глюкози полімерної мембрани. У цю мікрокапсулу поміщають комплекс інсуліну з високомолекулярним білком, що у силу своїх великих розмірів не здатний проникати через мембрану. Білок підбирають таким чином, щоб міцність його зв'язку з інсуліном була невелика й комплекс міг дисоціювати під дією глюкози. Тоді з появою в зовнішньому середовищі надлишку глюкози остання проникає усередину капсули й витісняє білок з його комплексу з інсуліном. У системі з'являється вільний інсулін, кількість якого точно еквівалентна кількості глюкози, що проникла через мембрану. Таким чином, програма подачі інсуліну в кожен момент часу визначається самим організмом, тобто рівнем глюкози в крові.
Розділ 4. Створення штучних органів і тканин
У наш час все більше людей потребують протезування різноманітних органів. У якості протезів використовують органи донорів, але враховуючи зростаючі потребі в протезування донорських органів не вистачає. Тому розроблені штучні органи. Слід пояснити, що під штучними органами розуміють як певні замінники органів із полімерних композицій (суглоби, кістки, клапани серця), так і вирощені методами біотехнології замінники шкіри, хрящів, які складаються із живих клітин. Але створити складні органи – легені, серце, печінку такими методами на наш час неможливо.
Серед штучних органів одними із найпоширеніших є клапани серця. У США в період з 1961 по 1981 р. було проведено 2135 операцій по заміні клапанів серця, при цьому 12 % хворих піддавалися подвійному протезуванню. Основними елементами клапана серця є полісилоксанова кулька й політетрафторетиленове покриття опорного кільця. Хоча у наш час конструкцію клапана серця намагаються покращити.
Перший і самий головний їхній недолік – не надто хороша гемосумісність. Звичайно вона проявляється не в тім, що клапани забиваються тромбами – в умовах інтенсивного кровотоку, найчастіше турбулентного характеру, тромби, якщо вони й утворюються на поверхні клапана, змиваються кров'ю, що протікає, і надалі руйнуються ферментами крові. Кремнійорганічні полімери можуть сорбувати із крові різні речовини, що може приводити до руйнування деталей штучного клапана при тривалій експлуатації. Останнє й обумовило розробку нових полімерних матеріалів для створення деталей клапана. Зараз уже створені, випробувані й застосовуються клапани на основі стеклоподібного вуглецю, одержаного термічною обробкою деяких органічних речовин.
Другий недолік штучного клапана пов'язаний з його конструкцією. Якщо це полісилоксанова кулька, то вона розташована на опорному кільці, звичайно покритому політетрафторетиленом. Потік крові віджимає кульку від кільця, відкривається отвір, через який кров із серця спрямовується в аорту. Зворотне потік крові після серцевого скорочення неможливий, оскільки він притискає кульку до опорного кільця, і потік крові припиняється. Природний же аортальний клапан влаштований зовсім по-іншому. У штучному клапані при віджатій кульці кров обтікає її, а не рухається навпростець, як у природному клапані. Частина енергії серця (звичайно не зовсім здорового) витрачається на подолання цього непотрібного лобового опору. До того ж при обтіканні кульки виникають завихрення в потоці крові, а це не тільки збільшує додаткове навантаження на серце, але й несприятливо позначається на самій крові. Будь-яке порушення ламінарності потоку крові може викликати руйнування структурних елементів крові, ініціювати процес тромбоутворення.
Конструкції, що моделюють пристрій природного клапана, зараз уже створені. Проблема тільки в матеріалах. Пелюстки клапана повинні витримувати, і в природному клапані витримують, тривалі знакоперемінні навантаження до сотні тисяч на добу. Аналогічних синтетичних матеріалів поки ще немає, але вважається, що це будуть складні високоеластичні композиції, армовані посилюючими високоміцними полімерними волокнами із заздалегідь заданим розподілом цих волокон в обсязі полімеру.
Однієї з найпоширеніших областей застосування кремнійорганічних полімерів є мембранна технологія. Мембрана являє собою полімерний виріб будь-якої форми (плоска плівка, порожнє волокно, багатошарова конструкція, набрякла частка й т.п.), що здійснює функції поділу складної суміші шляхом затримки якого-небудь компонента або селективного його пропускання через себе. Своєю появою апарати «Штучна легеня» й «Штучне серце - штучна легеня» зобов'язані хірургії органів грудної порожнини, коли при оперативному втручанні необхідно перекрити потік крові й припинити її доступ в оперований орган, здійснюючи одночасно нормальне постачання організму кров'ю й газообмін у крові. Основними компонентами таких апаратів є система пульсуючих насосів, що забезпечують динаміку кровотоку, і оксигенатор – пристрій для насичення крові киснем і виведення з неї вуглекислого газу. Існують різноманітні конструкції мембранних оксигенаторов, у яких полімерні мембрани можуть бути плоскими, складеними в рулони, згорнутими в спіраль, у вигляді порожнього волокна або тонкої рідкої плівки.
Як полімерний матеріал для виготовлення мембран зараз в основному використовують полідиметилсилоксан, що володіє найвищою серед відомих матеріалів проникністю по кисню й вуглекислому газу. Так, проникність цього полімеру по кисню майже в 100 000 разів вище, ніж полівінілхлориду, і майже в 500 разів вище, ніж поліетилену, а по вуглекислому газу в 60 000 й 1500 разів відповідно. На жаль, у полідиметилсилоксанових каучуків дуже низькі міцнісні характеристики, і тому головний напрямок робіт у цій області полягає в зміцненні матеріалу, наприклад, введенням у його склад полікарбонатних й інших твердих фрагментів.
Близький принцип поділу складних сумішей лежить й в основі апаратів «Штучна нирка». Відомо, що основні функції нирок полягають у регулюванні електролітного балансу, кислотно-основної рівноваги й осмотического тиску крові, а також у виведенні продуктів метаболізму й інших речовин, наприклад, лікарських препаратів. Саме ці функції й можуть бути передані штучному органу. Гемодіаліз – процес позаниркового очищення крові – протікає в гемодіалізаторах, основною робочою частиною яких є напівпроникна мембрана. У світовій практиці найбільше поширення одержали гемодіализатори пластинчастого й капілярного типу.
Уперше ідею гемодіалізу в роки другої світової війни втілив у життя голландський лікар В. Кольф, що у такий спосіб очистив кров хворого при важкому пораненні з інтоксикацією сечовиною. Кров хворого він пропускав через целофанову трубку, а саму трубку поміщав у розчин для діалізу. Із цього часу й до наших днів похідні целюлози залишаються основним матеріалом для створення таких плівок. Видалення токсинів із крові за допомогою таких мембран здійснюється по «ситовому механізмі» - чим вище молекулярна маса токсину, тим нижче швидкість його проникнення через мембрани.
І все-таки діаліз не завжди задовольняє медиків: апарати досить громіздкі, швидкість виведення токсинів менше, ніж хотілося б, а сполуки з великою молекулярною масою взагалі не видаляються або видаляються дуже погано. Тому великий інтерес і медиків й інших фахівців викликав запропонований в 60-х роках принципово новий спосіб витягу шкідливих речовин з біологічних середовищ. Мова йде про процес гемосорбції – видалення із крові токсинів шляхом пропущення крові через шар із сорбентом. Використання іммобілізованих фізіологічно активних речовин виявилося перспективним і для виконання інших детоксикаційних функцій нирок. Наприклад, ту ж сечовину, що традиційно видаляють гемодіалізом, можна успішно виводити із крові в так званій штучній клітині (мал. 1). Штучна клітина складається з оболонки-мембрани, проникної для низькомолекулярних речовин і непроникної для речовин полімерного характеру. Усередині перебуває водяний розчин ферменту – уреази, здатної каталізувати руйнування сечовини, і іонообмінна смола, сорбуюча іон амонію. Уперше така штучна клітина була створена відомим біохіміком Т. Чангом. Зараз не тільки створені більше складні за будовою штучні клітини, але й у значній мірі просунулися роботи в області іммобілізації самих клітин. Уже синтезовані матеріали, у яких живі клітини нормально існують, розмножуються й виконують свої функції.
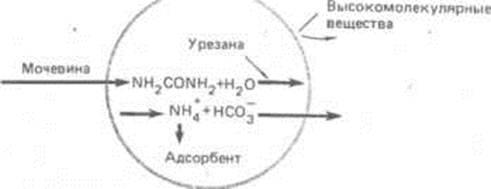
Рис. 1. Схема дії „штучної клітини”.
Говорячи про полімерні протези живих тканин, не можна не зупинитися на проблемі «штучної шкіри». Важливість цієї проблеми важко переоцінити. Число поранень й опіків навіть у мирний час дуже велике. Так, наприклад, у США щорічно госпіталізується біля двох мільйонів людей із опіками.
При травмах, опіках і взагалі при будь-яких ушкодженнях шкіри ідеальним способом лікування є реплантація шкіри того ж організму. Однак тут вступають у дію такі фактори, як місце розташування ділянки-донора, звідки можна взяти трансплантант без шкоди для організму, а також площа опіку. Нарешті, донорська ділянка назавжди залишається ушкодженою.
Очевидно, що в таких випадках різко зростає значення штучної шкіри. На думку фахівців, ідеальним полімерним покриттям на рани й опіки повинні бути властиві наступні властивості: захисні (від проникнення інфекції ззовні, від зовнішнього механічного травмування), абсорбційні і лікувальні (покриття повинні перешкоджати розвитку інфекції в рані, володіти анестезуючою й гемостатичною дією, стимулювати загоєння рани).
Класичними полімерами, що знайшли широке застосування в медицині як основний компонент перев'язочних засобів, є целюлоза й інші похідні полісахаридів. Сучасні покриття з полісахаридним абсорбентом, по суті, являють собою вдосконалені ватно-марлеві пов'язки, що мають поглинальну здатність до 3400 % води. Їхня низька вартість, гарна повітропроникність, простота стерилізації й інші переваги обумовлюють широке поширення таких перев'язочних матеріалів. Серйозним недоліком такого роду покриттів є те, що вони прилипають до рани і їхнє видалення ускладнюється настільки, що часто вимагає хірургічного втручання. У результаті процедура зміни пов'язки стає болючою та складною процедурою, а головне, при цьому відбувається травмування прилягаючих тканин. Зараз створені полімерні покриття, що не прилипають, принцип конструювання яких полягає в тім, що поверхня целюлозного або синтетичного абсорбенту, звернена до рани, покрита тонкою плівкою гідрофобного полімеру. Для того щоб пов'язка не втратила сорбуючу здатність, плівку звичайно перфорують або замість плівки застосовують сітку. Але й такі матеріали не позбавлені від недоліків. Маючи знижену швидкість всмоктування через гідрофобну поверхню й не прилягаючи щільно до рани, вони тим самим не перешкоджають скупченню під пов'язкою виділень, що викликають розвиток інфекції. У зв'язку із цим заслуговують на увагу покриття на основі природних або синтетичних полімерів, які або не мають потреби у видаленні й залишаються на рані до повного розсмоктування полімеру, або можуть бути безболісно вилучені, наприклад розчиненням у воді. Такі властивості мають полісахариди (натрієва сіль карбоксиметилцелюлози, амілоза, декстран), колаген. Загальною властивістю перерахованих матеріалів є висока гідрофільність (вони здатні поглинати до 5000% води), гарна адгезія до рани, відсутність токсичності, а також гемостатичні властивості, що дозволяють застосовувати подібні матеріали для швидкої зупинки кровотечі.
Для виготовлення штучної шкіри використовують спеціальну поліуретанову плівку, на поверхню якої нанесений шар клеючої речовини. Вона застосовується для заліковування пролежнів, закриття хірургічних розрізів і ран при пересадках шкіри (як на опіках, так і на донорських ділянках). Плівка газопроникна й лише незначно обмежує рухливість хворого, тому що може розтягуватися приблизно в 5 разів. Крім того, вона прозора, що дозволяє перевіряти стан рани, не знімаючи пов'язки. Покриття рани такою плівкою скорочує час загоєння майже на 40 %, роблячи операцію безболісною, оскільки збереження в рані рідини сприяє підтримці в ній постійної концентрації іонів натрію й калію, підвищення якої є причиною запалення нервових закінчень.
Спеціально для лікування опіків призначений багатошаровий матеріал, що представляє собою полідиметилсилоксанову мембрану у яку включена тонка поліамідна сітка, а нижня поверхня мембрани покрита високочистим колагеном. Застосування таких покриттів дозволяє рятувати людей, у яких обпалено до 85 % загальної поверхні тіла. Ще зовсім недавно опік 65 % поверхні тіла вважався смертельним.
Крім полімерних матеріалів для створення штучних органів використовують також і вирощені у спеціальних умовах живі клітини, які згодом трансплантують у організм хворого. Створення штучних органів і тканин оформилося в самостійну галузь науки біля десяти років тому. Перші досягнення цього напрямку – створення штучної шкіри й хрящової тканини, зразки яких уже проходять перші клінічні випробування в центрах трансплантації. Одне з останніх досягнень полягає в конструюванні хрящової тканини, здатної до активної регенерації. Це дійсно величезний успіх, оскільки ушкоджена суглобна тканина не регенерує в організмі. У клініках США щорічно оперують більше 500 тис. хворих з ушкодженнями суглобного хряща, але подібне хірургічне втручання лише на короткий час полегшує біль і поліпшує рух в суглобі. Учені з Ґетеборзького університету у Швеції екстрагували хондроцити (клітки хряща) із суглобів 23 пацієнтів, виростили культуру кліток, що утворила хрящову тканину, а потім імплантували її в ушкоджений колінний суглоб. Результат виявився чудовим: в 14 з 16 пацієнтів було відзначено практично повне заміщення ушкодженого хряща новою тканиною в місці її імплантації. Вирощування хрящової тканини займає, на жаль, багато часу – кілька тижнів, тому вчені намагаються розробити методики більше швидкого одержання штучних тканин. Наприклад, група експериментаторів з біотехнологічної компанії “Organogenesis” провела вирощування плівки штучної шкіри на матриці із природного колагену, що дозволяє практично відразу використати цю нову тканину в клініці. При клінічному випробуванні нового шкірного трансплантата було показано, що він поліпшує (не менш чим на 60% у порівнянні зі звичайними матеріалами) загоєння венозних ран і шкірних ушкоджень. Однак шкіра й хрящ – тканини, що складаються з одного або двох типів клітин, і вимоги до структури основи, призначеної для їхнього вирощування в штучних умовах, відносно невисокі.
З багатьма ж іншими органами справа набагато складніша. У цей час проводяться спроби вирощування в лабораторних умовах печінки. Але печінка – складно влаштований орган, що складається з різних типів клітин, що забезпечують очищення крові від токсинів, перетворення поживних речовин, що надійшли, у засвоювану організмом форму й виконує цілий ряд інших функцій. Тому створення штучної печінки вимагає набагато більш складної технології: всі ці різноманітні типи клітин повинні бути розміщені строго певним чином, тобто основа, на якій вони базуються, повинна мати високу вибірковість.
Із цією метою на таку синтетичну основу наносяться молекули, що володіють властивостями клітинної. Історія створення такої підкладки для кліток печінки може служити ілюстрацією переваг комбінованої технології. Наприклад, дослідникам з Массачусетского технологічного інституту вдалося створити підкладку, на якій закріплюються тільки клетки-гепатоцити. Добре відомо, що клітки цього типу виконують в організмі більше метаболічних функцій, чим будь-які інші. Однієї з таких функцій є видалення із кровотоку ушкоджених білків. Дослідники синтезували молекули з такою послідовністю ланок й “прикріпили” їх до штучного полиакриламидному полімеру. Згодом виявилося, що поліакриламід не може служити матеріалом для штучної печінки, оскільки викликає сильну імунну реакцію з боку організму. Необхідно було шукати якийсь інший полімер, який би не відторгався організмом, але при цьому й не адсорбував різні білки. Зрештою старання вчених увінчалися певним успіхом. Їм удалося синтезувати сітчасту підкладку з поліетиленоксиду, яка не має імунної реакції й не адсорбує білки. Таким чином, ученим пощастило вирішити одну із самих більших проблем у створенні штучних органів: сконструювати високоспецифічний клітинний акцептор. Наступним етапом стало формування тривимірної структури сітчастої підкладки. Здорова печінка складається з маси кліток, пронизаних складною мережею кровоносних судин. Для нормальної роботи печінки різні типи кліток повинні бути розташовані по відношенню друг до друга в певному порядку. Так поступово, крок за кроком, учені сподіваються створити повноцінну штучну печінку. Гібридні основи-підкладки добре зарекомендували себе й в експериментах по “вирощуванню” нервових волокон. У цьому випадку як підкладка виявився особливо ефективний тефлон – матеріал, зовсім нешкідливий для організму. З'єднання тефлонової сітки з молекулами ламініну за допомогою модифікованих іонізованим газом атомів нікелю являє собою, на думку дослідників, досить перспективну основу, на якій може відбуватися ріст відростків нервових кліток. Ламінін у цьому випадку виконує функцію регуляції й завдання напрямку росту нервів. Наступним кроком, що наближає клінічне застосування індукованого росту призначених для трансплантації нервів, повинне стати виготовлення спеціальних напрямних трубочок, які можна було б розміщати в організмі уздовж ушкоджених нервових волокон. Тефлон також давно використають у штучних кровоносних судинах. Однак дотепер з нього роблять тільки широкі (більше 6 мм у діаметрі) судини, тому що судини меншого діаметра через 1-2 роки після імплантації закупорюються тромбоцитами й клітинами гладких м’язів. Цього не відбувалося б, якби структура стінок імплантованої судини була схожа на епітелій, що вистилає, вени й артерії. Проблему можна вирішити шляхом нанесення на полімер природних епітеліальних клітин, що утворять гладку поверхню внутрішніх стінок судин, до якої не прилипають тромбоцити. Створення такого штучного епітелію і є основною проблемою конструювання кровоносних судин. До речі кажучи, аналогічне налипання кліток, і як наслідок, закупорювання судин, відбувається й у самому організмі через атеросклеротичну зміну епітелію. При вирішенні цього завдання, як і при спробах викликати спрямований ріст нервових волокон, учені користуються “послугами” білків міжклітинної адгезії: фібронектину й ламініну. Серед органів і тканин, які в цей час інтенсивно досліджуються з метою їх біотехнологічного відтворення, можна відзначити також кісткову тканину, сухожилля, кишечник, серцеві клапани, кістковий мозок і трахею. Крім робіт зі створення штучних органів і тканин людського організму вчені продовжують розробляти й методи вживляння в організм хворих діабетом людей кліток, які продукують інсулін, а людям, що страждають хворобою Паркінсона, - нервових кліток, що синтезують нейромедіатор дофамін, що дозволить позбавити пацієнтів від щоденних стомлюючих ін'єкцій.
Висновок.
Незважаючи на молодість науки про медико-біологічні полімери, з її допомогою вдалося домогтися рішення ряду принципово важливих завдань охорони здоров'я. У деяких областях медицини застосування полімерних матеріалів і виробів стало настільки звичайним, що вже важко уявити собі, як у недалекому минулому обходилися без них. І можна не сумніватися, що застосування синтетичних матеріалів у медицині буде безупинно розширюватися й будуть знайдені нові й, можливо, досить радикальні прийоми лікування з їхньою допомогою. Не слід думати, що всі наукові завдання уже вирішені. Кожна область медицини висуває свої, часто досить незвичайні вимоги до полімерів, необхідність задоволення яких, у свою чергу, стає потужним стимулом подальшого розвитку науки про полімери. Тому вчені та медики мають працювати разом над вирішенням питань покращення якості полімерних матеріалів, їх зносостійкості. Стійкості до дії агресивних речовин. Саме у такій співпраці будуть досягнуті нові результати, які покращать лікування людей.
Список використаної літератури.
1. Губський Б. І. Біологічна хімія. – К.: Вища школа, 2004. – 448 с.
2. Дорогин Ю. А. Использование полимерных материалов. – М.: Просвещение, 1991. – 212 с.
3. Платэ Н. А. Полимеры в медицинской практике. – М.: Знание, 1985. – 69 с.
4. Платэ Н. А. Полимеры в контакте с живым организмом. – М.: Знание, 1987. – 47 с.
5. П. Ф. Хвещук, А. В. Рудакова. Основы доказательной фармакотерапии. – СПб., 2000. – 235с
6. Чубарев В. Н. Фармацевтическая информация. Под ред. акад. РАМН А. П. Арзамасцева. М., 2000.
7. Химическая энциклопедия в 5 т. / под ред. И. Л. Кнунянца. – М.: Советская энциклопедия, 1990.
Похожие работы
... у змішувач. Отримане поживне середовище передають на стерилізацію та охолодження. Культивування продуцентів (Leuconostoc mesenteroides PCSIR-4) здійснюють до утворення полісахариду необхідної в’язкості (18 год) [8, 28]. Крім етапів синтезу продукту і їх очистки, технологія виробництва декстрану містить етап фракціонування. Фракціонування декстранів на виробництві проводять з використанням спирт ...
... і свідоцтва Ознака актуальності свідоцтва Дата анулювання свідоцтва 340602904614 100045659 11.06.2007 Додаток Б Декларації про прибуток підприємства ТОВ «Домосвіт – Чиста планета» за 2006–2008 роки Таблиця Б.1. Результати діяльності за 2006 рік Дата реєстрації: 08.02.2007 Відмітка про одержання (штамп ДПІ) УЗГОДЖЕНО рішенням Комітету ...
... ідження та лікування жінок, статистична обробка та аналіз одержаних даних, участь в написанні статті. АНОТАЦІЯ Безруков Г.С. Клініко-біохімічна оцінка використання застосування методики пошарового введення поліакриламідного гелю для усунення деформацій м’яких тканин обличчя. – Рукопис. Дисертація на здобуття вченого ступеня кандидата медичних наук за спеціальністю 14.01.22 – стоматологія. – ...
... і вирізаються, при цьому виконують виявлення і усунення причин браку. Якщо причиною браку виявляється низька кваліфікація зварника, то його звільняють від роботи. 5.3 Технологія будівництва поліетиленовими газопроводами з висвітленням технології зварювання поліетиленових труб в розтруб Для з'єднання труб І деталей з поліетилену низького тиску застосовують контактне теплове зварювання у стик ...


0 комментариев