Навигация
Методи гістологічного дослідження
2. Методи гістологічного дослідження.
Розвиток гістології тісно пов'язаний з удосконаленням мікроскопів та розробкою методів мікроскопічного дослідження. Сучасна гістологія має різноманітні методи дослідження, які дають змогу всебічно вивчати розвиток, будову та функцію клітин, тканин, органів. Основним об'єктом дослідження при цьому є гістологічні препарати, виготовлені із фіксованих структур. Цей метод називають ще методом класичної гістології. Препарат може являти собою мазок (мазок крові, кісткового мозку), відбиток (печінки, селезінки, тимуса тощо), плівки (плеври, очеревини, м'якої мозкової оболонки), тотальні препарати (зародки на ранніх стадіях розвитку, статеві клітини). Постійні гістологічні препарати використовують у навчальному процесі й наукових дослідженнях.
Процес виготовлення гістологічного препарату полягає в наступному.
Першим етапом у ньому є одержання матеріалу. При цьому шматочки розміром близько 1x1 см3 вирізують гострою бритвою, не травмуючи об'єкту, останній повинен бути свіжим, брати його слід одразу ж після забою експериментальної тварини.
Другим етапом цього процесу є фіксація матеріалу. Її здійснюють відразу ж після вирізування шматочка. Полягає вона в зануренні його в фіксуючу рідину. Метою фіксації є збереження гістологічних структур. Фіксатором може бути 5— 10 % розчин формаліну: він швидко проникає у тканини, добре їх фіксує, легко видаляється після промивання у воді.
Фіксаторами є оцтова, пікринова, осмієва кислоти, нейтральний 10% формалін, етиловий та метиловий спирт. При необхідності застосовують різні складні фіксуючі суміші, які містять названі компоненти у різних співвідношеннях.
Третій етап виготовлення гістологічного препарату — зневоднення фіксованого матеріалу. Для цього використовують спирти зростаючої концентрації (від 50 до 100 градусів). Після зневоднення матеріал ущільнюється. Його здійснюють у насиченому розчині рідкого парафіну в ксилолі при температурі 37° С, а потім в рідкому парафіні при температурі 55° С. У парафіні об'єкт просочується, йому дають змогу затвердіти при кімнатній температурі разом з парафіном у спеціальній формочці. Блок для електронної мікроскопії одержують ущільненням об'єкту в органічних смолах. Зрізи виготовляють на спеціальних приладах-мікротомах (для світлової мікроскопії тонкі зрізи товщиною 8 мкм, напівтонкі 0,5—1 мкм); для електронної мікроскопії ультратонкі зрізи — 0,05—0,2 мкм виготовляють на ультрамікротомах.
Забарвлюють зрізи для збільшення контрастності зображення окремих структур при розгляді їх у мікроскопі. Методи забарвлення гістологічних структур різноманітні. Вибір їх залежить від мети дослідження. Гістологічні барвники за походженням поділяють на кислі, основні та нейтральні. Кислий фарбник — еозин — забарвлює цитоплазму в рожево-жовтий колір; це синтетичний фарбник. Структури, що фарбуються кислими фарбниками, називають оксифільними. Основні фарбники забарвляюють ядра клітин і тому їх називають ядерними. Прикладом є гематоксилін — фарбник рослинного походження. Він фарбує ядро клітини в синьо-фіолетовий колір. Гістологічні структури, що здатні забарвлюватися основними барвниками, називають базофільними. Структури, що
сприймають кислі та основні барвники, є нейтральними. Вони утворюються при сполученні водних розчинів кислого і основного барвників.
У гістологічній техніці знаходять широке використання спеціальні барвники. За їх допомогою фарбують речовини певної хімічної природи. Наприклад, альціановий синій використовують для визначення кислих глікозаміногліканів. Судан III забарвлює нейтральні жирові речовини в оранжевий колір, судан чорний В — ліпіди в чорний колір. Для забарвлення нервової тканини успішно користуються методикою імпрегнації азотнокислим сріблом тощо.
Після фарбування зрізи відмивають від залишку фарбника, зневоднюють етиловим спиртом, просвітлюють ксилолом, потім вміщують в тонкий шар бальзаму між предметним та покривним скельцями. Бальзам і скельця мають майже однаковий показник заломлення світла, що запобігає розсіюванню променів при проходженні їх через товщу препарату. Основний недолік цього класичного способу виготовлення препарату — поява штучного утворення — артефакту, що може бути причиною одержання негативних результатів. Однак, знаючи закономірності фіксування та зневоднення, артефактів можна уникнути. Так, якщо матеріал довго зберігати у формаліні, у ньому можуть утворитися темні пігментні зерна. Щоб запобігти їх появі, препарат ретельно промивають у проточній воді. Інша справа, коли порушують правила виготовлення препарату, з'являються волокна тканини, якою протирають скельця, пухирці повітря при накриванні препарату покривним скельцем, осад фарб, зазубрини мікротомного ножа, складки зрізу.
Крім основного класичного методу, в гістології існує багато інших, які застосовують залежно від мети дослідження. Зокрема це такі методи:
флуоресцентна мікроскопія, яка дає змогу вивчити як власну (первинну) флуоресценцію речовин, так і вторинну, викликану фарбуванням клітинних структур спеціальними барвниками-флуорохромами. Останні, при взаємодії з різними компонентами клітини, утворюють специфічне світіння відповідних структур. Так, флуорохром — акридиновий оранжевий з ДНК дає зелене світіння, а з РНК — червоне.
Метод темнопольової мікроскопії полягає в тому, що дрібні часточки, які лежать за межами дозволеної здатності мікроскопа, стають видимими в променях, що йдуть під таким великим кутом і в об'єктив вони безпосередньо не потрапляють. В об'єктив потрапляє лише світло, відбите від цих часточок, і вони мають вигляд світлих цяточок по темному фоні. Цей метод є цінним при вивченні живих колоїдів клітини. Є інші, широко використовувані методи: гістохімічний, ауторадіографічний, імуногістохімічний.
Мікрургія клітини і фракціонування клітинних стуктур. При вивченні властивостей живої клітини значне місце належить так званій мікрургії, яка дає змогу за допомогою спеціальних мікроманіпуляторів здійснювати операції на клітині. Із застосуванням мікрургії вивчають реакції на пошкодження і вилучення її різних складових частин — ядра, ядерця, окремих хромосом.
Різновиди мікрургії вивчають локальний вплив на окремі частини хромосом вузького пучка променів (-гамма-променів, протонів, ультрафіолетових).
В цитології вивчають хімічний склад і властивості ізольованих структур та органоїдів клітин. Ізоляції їх досягають шляхом подрібнення тканин у гомогенізаторах, при цьому руйнуються клітинні оболонки. На фракції гомогенат поділяється в результаті центрифугування. Опрацьовані засоби центрифугування гомогенатів у ступінчастому градієнті щільності. При цьому у пробірці нашаровуються розчини сахарози, що спадають від дна щільності, останнім нашаровується гомогенат.
Центрифугування вмісту такої пробірки дає змогу одержати різні фракції по її вертикалі від найважчих (ядра, ядерця), які опускаються на дно і найлегших, які розміщуються ближче до поверхні (рибосоми, хромосоми, лізосоми).
Цитоспектрофотометрія дає змогу визначити кількісний вміст речовин у клітині та їх складових елементів по поглинанню ними світлових променів певної довжини хвилі.
Авторадіографія. За цим методом аналізують розміщення у клітинах і тканинах речовин, які помічено радіоактивними ізотопами. Методом авторадіографії виявляють місця синтезу певних речовин, склад білків, шляхи внутрішньоклітинного транспорту. Ізотопи, введені в клітини, відновлюють бромисте срібло фотоемульсії, що покриває зріз. Після проявлення фотоемульсії помітні зерна срібла (треки), що свідчить про розміщення в клітинах мічених речовин.
Імуноцитохімічний метод дослідження. Для вивчення деяких складових білкового обміну користуються здатністю високомолекулярних речовин-антигенів викликати в клітинах утворення захисних глобулінів (антитіл) і з'єднуватися з ними в комплекси. Приєднання до одного глобуліну флуоресціюючої речовини дає змогу виявити локалізацію іншого.
Гістохімічні методи дослідження. З їх допомогою виявляють хімічну природу складових елементів клітин і міжклітинної речовини, тканин тваринного організму. В основі гістохімічних методів застосовують специфічні хімічні реакції. За їх допомогою виявляють нуклеїнові кислоти, білки, амінокислоти, ліпіди, вуглеводи, ферменти.
Електронна мікроскопія дає змогу виявляти субмікроскопічну будову клітин. При електронній мікроскопії використовують потік електронів, джерелом яких є розжарена вольфрамова нитка-катод. Під впливом підвищеної напруги в 80 кВт електрони набувають великої швидкості і спрямовуються до аноду, в центрі якого є отвір, через який вони проходять. В сучасних трансмісійних (просвічуючих) електронних мікроскопах роздільна здатність становить 0,1—0,7 нм. Метод скануючої електронної мікроскопії забезпечує об'ємне вивчення поверхонь об'єктів дослідження.
Прижиттєве дослідження тканин. Живі тканини культивують за межами організму. Шматочки тканини об'ємом до 1 мм2, одержані стерильно при мінімальному пошкодженні, розміщують у спеціальну камеру на слюду чи покривне скельце, де міститься штучне живильне середовище з відповідною температурою. Клітини в складі тканинних культур, особливо ембріональних, зберігають життя, діляться, здатні до гістологічної диференціації.
Значно поширений спосіб одношарових культур, у якому використовують клітини, одержані при подрібненні тканини дією трипсину. Метод прижиттєвого дослідження тканин дає змогу простежити рух клітин, їх поділ, ріст, реактивні зміни на дію різних факторів. З цією метою застосовують уповільнене фотографування.
Похожие работы
... ів України. – Київ, 2003. – С.312. (Внесок дисертанта: проведено визначення каталази в крові хворих і підготовлено матеріал до друку) АНОТАЦІЯ Поліянц І.В. Патофізіологічні механізми пневмонії на різних етапах її розвитку. – Рукопис. Дисертація на здобуття наукового ступеня кандидата медичних наук за фахом 14.03.04 – патологічна фізіологія. Одеський державний медичний університет МОЗ Укра ...
... АН України. Працював у Дніпропетровському та Одеському університетах був директором Одеського ботанічного саду. Займався систематикою водоростей та типологією річок. З його ініціативи був створений Інститут гідробіології АН України. Свириденко Павло Олексійович (1893—1961). Народився в Путивлі (тепер — Сумська обл ) Закінчив Московський університет. Працював у Московському університеті, Інституті ...
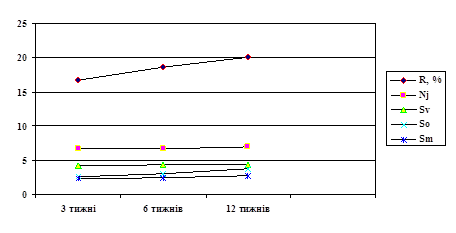
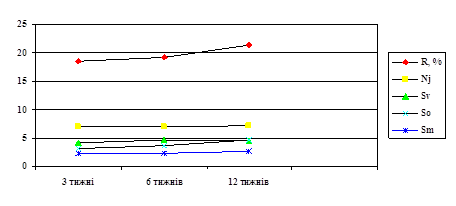
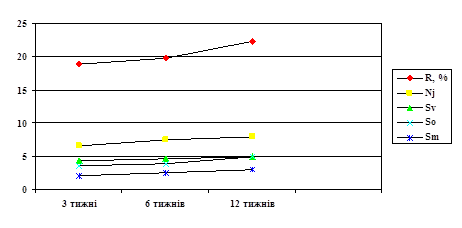
... імпрегнація досліджуваного матеріалу, проаналізовані електронограми, здійснено узагальнення усіх даних та оформлення результатів.). АНОТАЦІЯ Раскалєй Д.В. Морфологічна характеристика впливу магнітного поля та лазерного опромінення на регенерацію периферійного нерва. – Рукопис. Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю 14.03.09 – гістологія, цитологія, ...
... беременности у крыс / М. А. Волошин, О. Г. Кущ // Актуальные вопросы эволюционной, возрастной и экологической морфологии. – Белгород, 2006. – С. 34. (Самостійно проведено дослідження, обробка результатів, написання тез). АНОТАЦІЯ Кущ О.Г. Закономірності будови плаценти і лімфоїдної тканини, асоційованої з нею, протягом третього періоду вагітності (анатомо-експериментальне дослідження). – Рук
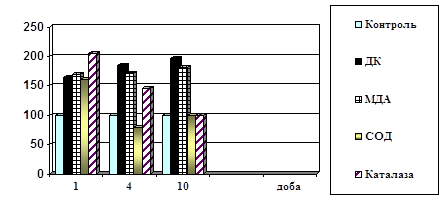
0 комментариев