Навигация
ГЛИКОГЕН КАК ВОЗМОЖНЫЙ ЭНЕРГЕТИЧЕСКИЙ ИСТОЧНИК В ГОЛОВНОМ МОЗГЕ
3. ГЛИКОГЕН КАК ВОЗМОЖНЫЙ ЭНЕРГЕТИЧЕСКИЙ ИСТОЧНИК В ГОЛОВНОМ МОЗГЕ
Сопоставление данных содержания глюкозы в мозге разных животных и скорости ее потребления мозговой тканью показывает, сколь незначительны собственные ресурсы этого метаболита в мозге, и объясняет отмеченную зависимость функциональной активности головного мозга от поступления углеводов с кровью. Возникает вопрос, в какой мере уровень глюкозы в мозге может поддерживаться за счет гликогена.
Уровень этого полисахарида в мозговой ткани разных животных составляет в среднем 2,5–4,5 мкмоль/г. Общее содержание гликогена в мозге эмбрионов и новорожденных животных значительно выше, чем в мозге взрослых. Например, в мозге у новорожденных мышей гликогена в 3 раза больше, чем в мозге взрослых животных. По мере роста и дифференцировки мозга, а также возрастания зависимости функционального состояния мозга от скорости дыхания концентрация гликогена быстро снижается и далее в мозге взрослого животного поддерживается относительно постоянной. Эти изменения связывают с быстрой активацией фосфорилазной системы в первые дни постнатального развития и с повышением ее чувствительности к различным регуляторным воздействиям, в частности к гормональной регуляции.
Гликоген в качестве субстрата участвует в энергетическом обмене. В экспериментах, выполненных на кошках, к перфузионной жидкости добавляли глюкозу 1–6С. Анализ С02 в оттекающей от мозга крови показал разбавление С02, образующегося из меченой глюкозы, нерадиоактивной углекислотой, источником которой служил окисляющийся гликоген мозга. Расчеты показывают, что лишь до 7–10% энергетических потребностей головного мозга могут покрываться за счет расщепления гликогена.
В качестве энергетического источника используется свободная фракция гликогена, на долю которой приходится около 20–25% от общего содержания углевода в мозге. Остальная часть гликогена находится в связанном состоянии – это наиболее интенсивно обновляющаяся фракция гликогена. Именно за счет связанного гликогена происходит пополнение фонда расщепляющейся свободной фракции. Особенно важное значение этот субстрат имеет в головном мозге при экстремальных состояниях, когда уменьшается поступление в мозг глюкозы крови. Однако из-за небольших размеров пула гликогена в мозге полное расщепление его до глюкозы с последующим окислением может произойти в течение 5–7 мин.
Таким образом, собственные углеводные запасы в нервной ткани относительно невелики и не могут обеспечить энергетические потребности нормально функционирующего головного мозга в течение длительного времени. Это обстоятельство наряду с отмеченной ограниченной способностью мозга использовать другие субстраты окисления лежит в основе характерной для нервной ткани зависимости от постоянного поступления глюкозы из крови-
Для того чтобы понять, каким образом в головном мозге обеспечивается высокий уровень энергетического обмена, за счет чего глюкоза используется почти полностью именно в реакциях окисления и для обеспечения энергетических потребностей ткани, а не в других метаболических процессах, необходимо более детально рассмотреть вопросы регуляции скоростей основных путей окисления – гликолиза и цикла трикарбоновых кислот.
4. АЭРОБНОЕ ОКИСЛЕНИЕ ГЛЮКОЗЫ В ГОЛОВНОМ МОЗГЕ И МЕХАНИЗМЫ ЕГО РЕГУЛЯЦИИ
В последние годы в литературе появились сведения о специфичности регуляторных механизмов, контролирующих метаболизм глюкозы в функционально различных органах и тканях в условиях интактного организма. Особое внимание исследователей сосредоточено на изучении соотношения активностей и механизмов контроля над теми ферментами, которые конкурируют за использование субстратов, стоящих в точках перекреста нескольких метаболических путей. Имеются лишь единичные публикации, посвященные исследованию механизмов, обеспечивающих высокую интенсивность энергетического обмена мозга in vivo, а также регуляции метаболизма мозга. Это объясняется сложной и гетерогенной структурой, наличием ГЭБ и рядом других причин, затрудняющих интерпретацию экспериментальных данных и экстраполяцию результатов, полученных in vitro, на мозг интактного животного. Многие аспекты этой важной и сложной проблемы требуют дальнейших углубленных нейрохимических исследований.
Пути утилизации глюкозы в мозге; гликолиз и механизмы, контролирующие его скорость
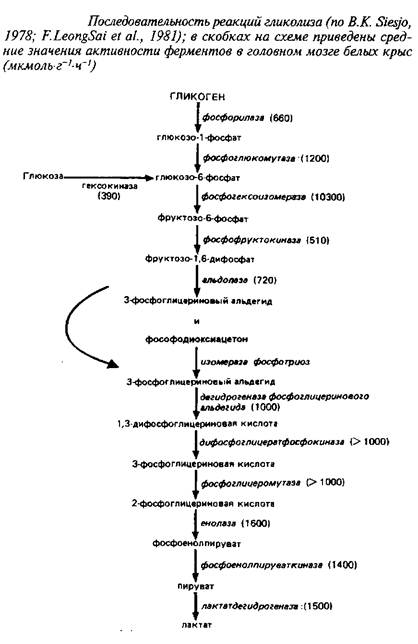
Последовательность реакций аэробного гликолиза, а также средние значения активностей ферментов, катализирующих отдельные стадии, приведены на схеме 1.
Из сопоставления активностей ферментов видно, что наиболее медленными реакциями, которые могут лимитировать скорость потока метаболитов по гликолитической цепи, являются гексокиназная и фосфофруктокиназная реакции.
Представление о количественном соотношении промежуточных компонентов гликолиза дают следующие средние результаты определения уровня метаболитов в головном мозге крыс:
| Гликоген | 1,9 – | 3,8 |
| УДФ-глюкоза | 0,08 – | 0,17 |
| Глюкоза | 1,52 – | 3,70 |
| Глюкозо-6-фосфат | 0,039- | 0,049 |
| Фруктозо-б-фосфат | 0,017- | 0,023 |
| Фруктозо – 1,6 – дифосфат | 0,010- | 0,017 |
| Дигидроацетонфосфат | 0,024 | |
| 2-Глицероальдегидфосфат | 0,021- | 0,046 |
| З-Фосфоглицерат | 0,100- | 0,085 |
| 2-Фосфоглицерат | 0,010- | 0,016 |
| Фосфоенол п ируват | 0,035- | 0,097 |
| Пируват | 0,120- | 0,190 |
| Лактат | 1,26 – | 1,70 |
Гексокиназная реакция. Первым этапом на пути вовлечения свободной D-глюкозы, поступающей в мозг из крови, в разнообразные метаболические превращения служит реакция фосфорилирования, катализируемая гексокиназой. Для регуляции энергетического метаболизма в головном мозге гексокиназная реакция имеет особое значение, так как она является основным поставщиком глюкозо-6-фосфата, необходимого для дальнейших превращений. В других тканях, таких как печень, сердечная и скелетная мышцы и др., источником большей части глюкозо-6- фосфата служит реакция расщепления гликогена или реакции глюконеогенеза.
Гексокиназная реакция является доминирующим путем пополнения пула метаболитов гликолиза в мозге, поскольку, как уже упоминалось, глюкоза представляет собой основной энергетический субстрат в этой ткани. Окисление иных энергетических субстратов и ввод компонентов в гликолитическую цепь через другие реакции в нервной ткани не имеет существенного значения.
Все это позволяет рассматривать гексокиназную реакцию как первый пункт контроля над скоростью энергетического обмена в головном мозге. Лишь в экстремальных ситуациях – при резкой гипогликемии или в условиях чрезвычайно интенсивного гликолиза при кислородной недостаточности – лимитирующим этапом может стать транспорт глюкозы через ГЭБ.
Активность гексокиназьг мозга относительно невелика, особенно по сравнению с активностью других ферментов гликолиза; в среднем она составляет 350–450 мкмоль субстратаг-ч~. Эта величина в 5–10 раз превышает среднюю скорость поступления глюкозы в мозг. Более того, при сопоставлении активности фермента в различных тканях максимальные величины получены рядом авторов именно в экспериментах с головным мозгом.
Распределение фермента в нервных клетках неравномерно; с помощью гистохимических, иммунохимических методов, а также при исследовании обогащенных препаратов установлена более высокая активность гексокиназы в нейронах, особенно в си-наптических окончаниях, по сравнению с олигодендроглией.
Интересная особенность отмечена при изучении распределения фермента между компартментами клетки: в отличие от ряда других тканей в мозге основная часть гексокиназы сосредоточена не в цитоплазме, а в митохондриях. В связывании фермента с внешней митохондриальной мембраной участвует специфический белок, детальные исследования свойств которого указывают на идентичность его с белком, формирующим поры. На прочность взаимодействия гексокиназы с мембранным белком оказывает влияние фосфолипидный компонент мембраны. Причины такого своеобразного внутриклеточного распределения гексокиназы в мозге пока не совсем ясны, но имеются предположения, что такая локализация обеспечивает более быстрое и эффективное фосфорилирование глюкозы за счет АТФ, синтезированного в митохондриях.
Необходимо отметить, что из четырех известных изофеоментов гексокиназы – ГКГ, ГКП, ГКШ, ГК1У в мозге встречается лишь первые два, причем на долю ГКТ приходится около 90% суммарной активности. Именно для этих двух изоферментов наиболее выражена способность связываться с внешней митохондриальной мембраной.
Связывание гексокиназы – обратимый процесс; на соотношение между связанной и солюбилизированной формами фермента влияет рад факторов, в первую очередь – отношение АТФ/АДФ, концентрация неорганического фосфата и глкжо-зо-6-фосфата, а также уровень свободных: жирных кислот. Действие указанных факторов проявляется в пределах их физиологических концентраций; это дало Вильсону основание предположить, что изменение субклеточного распределения гексокиназы служит важным механизмом регуляции активности фермента in vivo.
Такое предположение очень интересно, поскольку мембранно-связанная гексокиназа более активна, чем цитоплазматическая форма: значение Км для АТФ митохондриального фермента в 3 раза ниже, чем у солюбилизированного. Кроме того, связанная форма гексокиназы в меньшей степени ингибируется глюкозо-6-фосфатом. Установлено, что значение Kj солибилизированной формы гексокиназы равна в среднем 10~М, а митохондриальной – 10~*М; для сравнения можно привести средние значения концентрации глю-козо-6-фосфата в цитоплазме, где в основном сосредоточен этот метаболит – -10~М.
Накопление в клетках аденозинтрифосфата и возрастание отношения АТФ/АДФ приводит к усилению солюбилизации гексокиназы, что вызывает замедление скорости фосфорилирования глюкозы и, следовательно, торможение гликолиза. Напротив, при уменьшении уровня АТФ в клетке происходит новое связывание фермента с ионами магния в митохондриальной мембране, которое вследствие указанной разницы значений ведет к освобождению фермента от ингибирования глюкозо-6-фосфатом и повышению скорости реакции фосфорилирования субстрата.
В мозге интактных животных гексокиназа находится преимущественно в ингибированном состоянии. Исследования, выполненные in vivo, показали резкое повышение количества связанного фермента при усилении гликолиза и, напротив, возрастание доли солюбилизированной гексокиназы при снижении скорости гликолиза в условиях анестезии.
Таким образом, быстрые взаимопереходы солюбилизированной и связанной с митохондриями гексокиназы обеспечивают значительный «запас мощности» фермента, позволяя быстро менять скорость фосфорилирования глюкозы при сдвигах в энергетическом балансе мозга без изменения скорости синтеза фермента. Этот механизм контроля активности гексокиназы, чутко реагирующий на сдвиги таких балансовых показателей энергетического обмена, как отношение АТФ/АДФ, уровень неорганического фосфата, несомненно, играет большую роль в регуляции энергетического метаболизма мозга.
Соотношение путей метаболизма глюкозо-б-фосфата в мозге. Как известно, глюкозо-6-фосфат, образующийся в гексокиназной реакции, может быть использован в качестве исходного субстрата в нескольких метаболических путях: гликолиз, пентозофосфатный путь, синтез гликогена и др. Интенсивность использования его в той или иной последовательности реакций определяется соотношением активностей ферментов, конкурирующих за глюкозо-6-фосфат.
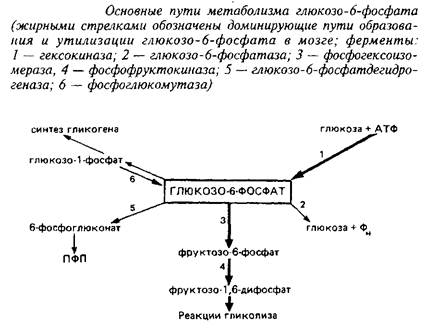
В табл. 2 приведены данные об интенсивности основных путей метаболизма глюкозо-6-фосфата в мозге и печени крыс, рассчитанные на основании экспериментов с С-глюкозой и анализа активностей ферментов. Несмотря на то, что эти расчеты весьма приблизительны, они все же дают наглядное представление о значительных отличиях в метаболизме глюкозо-6-фосфата в головном мозге и печени. Исследования альтернативных путей метаболизма глюкозо-б-фосфата/я vivo с помощью препаратов меченой глюкозы, содержащей С в разных положениях, а также результаты математического моделирования подтвердили, что вовлечение глюкозо-6-фосфата в реакции гликолиза с последующим окислением в ЦТК доминирует над другими путями использования этого субстрата в мозге взрослых животных.
Таблица 2. Интенсивность отдельных путей метаболизма глюкозо-6-фосфата в головном мозге и печени крыс
| Метаболический путь | Доля глюкозо-6-фосфата, вовлекаемого в реакции, % | |
| мозг | печень | |
| 1. Окисление до С (Х и Н20 в ходе аэробного гликолиза и ЦТк | 80–90 | Около 20 |
| 2. Синтез гликогена | 5–7 | 20–25 |
| 3. Расщепление в глюкозо-6-фосфатазной реакции до свободной глюкозы | Следы | До 50 |
| 4. Пентозофосфатный путь | 5–15 | |
| 5. Другие реакции | Менее 5 | 5–10 |
Преимущественное использование глюкозо-6-фосфата в реакциях гликолиза является характерной чертой энергетического метаболизма; оно обусловлено значительным превышением активности фосфогексоизомеразы и фосфофруктокиназы над активностью других ферментов, конкурирующих за общий субстрат. Относительная роль минорных путей метаболизма глюкозо-6-фосфата заметно меняется в мозге х возрастом животного, прежде всего это относится к пентозофосфатному пути.
Как известно, интенсивность использованиятлюкозо-6-фосфата в реакциях пентозофосфатного пути в-значительной степени определяется активностями ферментов, катализирующих начальные, наиболее медленные стадии: глюкозо-6-фосфатде-гидрогеназы и 6-фосфоглюконатдегадрогеназы.
Установлено, что активности этих ферментов в головном мозге молодых животных в 1,5–2 раза выше, чем у взрослых. Максимальные значения активностей отмечаются исследователями в период наиболее интенсивной миелинизации; у крыс этот период соответствует 20–30 дням постнатального развития. Более высокая активность найдена в головном мозге растущих животных и для ферментов неокислительной части пентозофосфатного пути: трансальдолазы, тракскетолазы, фосфопентоизомеразы и др. Все эти данные свидетельствуют о том, что такой путь метаболизма глюкозо-6-фосфата играет в развивающейся нервной ткани большую роль, чем в окончательно сформировавшемся мозге взрослых животных.
Определение скорости ПФП в экспериментах с глюкозой, содержащей С в положении «1» или «6», позволило рассчитать, что в мозге растущих животных в ПФП используется до 10–15% поступающей в мозг глюкозы, в то время как в мозге взрослых животных – лишь 2–3%.
В ходе окончательной дифференцировки и созревания структур головного мозга у новорожденных и молодых животных особенно интенсивно протекают процессы синтеза специфических липидов, в частности липидов миелиновых оболочек. Заканчивается деление и пролиферация различных типов нервных клеток. Такие морфологические изменения в ходе созревания мозга требуют повышенного образования восстановительных эквивалентов для реакций биосинтеза липидов, а также фосфопентоз как предшественников нуклеиновых кислот. Именно эти потребности покрываются за счет реакций ПФП. После окончания процессов миелинизации и пролиферации нервной ткани интенсивность этого пути метаболизма глюкозо-6-фосфата в головном мозге заметно снижается. Напротив, в ряде других тканей, где у взрослых животных идут интенсивные процессы липогенеза, относительная доля ПФП среди реакций метаболизма глюкозо-6-фосфата постепенно возрастает.
Сопоставление активности ферментов пентозофосфатного пути в различных типах клеток взрослого мозга позволило сделать вывод о разной его интенсивности в нейронах и нейроглии. Гистохимическими методами, а также при прямом определении в нейроглии в отличие от нейронов найдены более высокие значения активности глюкозо-6-фосфатдегидрогеназы, 6-фосфоглюконатдегидрогеназы, транскетолазы и других энзимов ПФП. Таким образом, в нейроглии пентозофосфатный путь является существенным путем метаболизма глюкозо-6-фосфата, в то время как в нейронах доминирует аэробный гликолиз, сопряженный с последующими реакциями цикла трикарбоновых кислот.
Фосфофруктокиназная реакция. Как уже упоминалось, основная масса глюкозо-6-фосфата в головном мозге используется в реакциях аэробного гликолиза. Важнейшим этапом гликолитической цепи, с точки зрения возможности контроля над скоростью гликолиза, является фосфофруктокиназная реакция. Активность фосфофруктокиназы в головном мозге и многих других тканях заметно ниже активности остальных ферментов гликолиза, в силу чего эта реакция может лимитировать общую скорость потока метаболитов по гликолитической цепи.
В отличие от гексокиназы запас каталитической мощности фосфофруктокиназы относительно невелик; увеличение активности этого фермента под действием кинетических регуляторных механизмов происходит в ограниченных пределах. Поэтому при ряде экстремальных воздействий скорость потока метаболитов по гликолитической цепи ограничивается именно на реакции фосфорилирования фруктозо-6-фосфата.
Фосфофруктокиназа имеет тетрамерную субъединичную структуру и состоит из комбинаций протомеров: мышечной, печеночной и мозговой или тромбоцитарной форм.
В головном мозге, как и в других тканях, в регуляции скорости фосфорилирования фруктозо-6-фосфата принимают участие одновременно несколько механизмов, однако их относительная роль в том, или ином органе различна. Фосфофруктокиназа представляет собой поливалентный аллостерический фермент активность которого подавляется АТФ и цитратом и стимулируется АДФ. Действие этих основных регуляторных факторов дополняется другими. В частности, АМФ и неорганический фосфат снимают ингибирующее действие АТФ; аналогичным образом влияет продукт реакции – фруктозодифосфат.
Изоферменты фосфофруктокиназы отличаются по чувствительности к регуляторным факторам: B-форма наиболее, а М-форма наименее чувствительна к ингибированию АТФ; В-форма сильно активируется фруктозодифосфатном, в то время как М-форма почти не активируется. Определенную роль в регуляции активности фермента в мозге играет кальмодулинзависимое фосфор илирование; в последние годы установлено участие в этом процессе нейроспецифического белка S-100.
Таким образом, рост отношения АТФ/АДФ как аллостерических эффекторов и компонентов цикла фосфорилирования – дефосфорилирования фермента приводит к снижению фосфофруктокиназной активности, а уменьшение отношения АТФ/ АДФ, напротив, повышает скорость реакции. По-видимому, этот механизм регуляции является ведущим в системе множественного контроля над активностью фосфофруктокиназы в головном мозге.
Необходимо подчеркнуть, что отношение АТФ/АДФ одновременно с фосфофруктокиназой контролирует и активность гексокиназы, причем направленность изменений – стимуляция или ингибирование – одинакова для обеих киназ. Это дало основание У. Лоури и соавторам рассматривать гексокиназу и фосфофруктокиназу в мозге как единый функциональный комплекс.
Двойной контроль над активностью важнейших энзимов гликолиза со стороны компонентов энергетического обмена является характерной особенностью головного мозга. Наличие синхронной регуляции одним и тем же фактором активности двух ведущих ферментов гликолитической цепи позволяет быстро и эффективно изменять скорость окисления глюкозы в клетках головного мозга в зависимости от изменений энергетического баланса.
Еще один механизм контроля над активностью фосфофруктокиназы, а именно – ингибирование фермента цитратом, в головном мозге играет, по всей вероятности, значительно меньшую роль, чем в других тканях. Это может быть обусловлено особенностями метаболизма лимонной кислоты в мозге.
Как известно, основным источником цитрата в мозге служит ацетилКоА, образующийся при окислительном декарбоксилировании пирувата. В то же время в других тканях значительные количества ацетилКоА для синтеза цитрата образуются при окислении жирных кислот, т.е. имеет место конкуренция между гликолизом и липолизом. Кроме того, в головном мозге взрослых животных лимонная кислота быстро окисляется в том же компартменте, где синтезируется, – в митохондриях, в силу чего концентрация этого метаболита в цитоплазме обычно не достигает значений, близких к К фосфофруктокиназы.
Конечные этапы гликолиза в головном мозге. Реакции, следующие за образованием фрустозо – 1,6 – дифосфата, в головном мозге катализируются ферментами, активность которых достаточно высока и в 5–10 раз превышает активность гексокиназы и фосфофруктокиназы. Поэтому ни скорость расщеплення фруктозо– 1,6–дифосфата, ни последующие этапы превращения фосфотриоз обычно не лимитируют общую скорость аэробного гликолиза в мозговой ткани.
Рассматривая ферментативные превращения фосфотриоз, необходимо отметить характерную для нервной ткани локализацию изоферментов енолазы. В глиальных клетках обнаружен гомодимер аос, идентичный енолазе печени, в то время как изоформа встречается только в нейронах. Установлена идентичность нейрональной формы енолазы и нейроспецифического кислого белка 14–3–2, описанного Б. Муром.
Как уже указывалось, в отличие от многих органов с интенсивным липолизом или интенсивно протекающим пентозофосфатным циклом в мозге взрослых животных дополнительный поток в пул метаболитов гликолиза трехуглеродных фрагментов имеет весьма ограниченное значение. Результаты экспериментов с различными предшественниками показывают, что на долю промежуточных компонентов гликолиза, образовавшихся из С-глицерата, в мозге приходится не более 2–5%. Это еще раз показывает важность для метаболизма головного мозга гексокиназной реакции, которая служит основным путем ввода углеродных компонентов в гликолитическую цепь.
Конечным продуктом аэробного гликолиза является пировиноградная кислота, основные пути метаболизма которой приведены на схеме 3. Рассматривая их, необходимо учитывать, что цитоплазматический пируват с помощью протонзависимой переносящей системы легко проникает через митохондриальные мембраны и включается в метаболические превращения в обоих клеточных компартментах.
Что касается реакций образования пирувата из аминокислот серина, глицина, треонина, цистина и цистеина, протекающих в цитоплазме, то они наиболее интенсивно осуществляются в печени и почках. В головном мозге они играют весьма малую роль в пополнении пула пирувата из-за низкой активности ферментов и очень плохой проницаемости ГЭБ для этих аминокислот.
Три реакции связывают пируват с ЦТК: пируеатдегидрогеназная, пируваткарбоксилазная и НАДФ-малатдегидрогеназная; если две первые протекают исключительно в митохондриях, то реакция, катализируемая НАДФ-малатдегидрогеназой, так называемым «маликэнзимом», протекает как в митохондриях, так и в цитоплазме. Основным путем включения углеродного скелета пировиноградной кислоты в ЦТК в мозге служит пируватдегидрогеназная реакция, тогда как в других тканях – печени, сердечной и скелетных мышцах, почках и др. – большее значение имеют реакции карбоксилирования пирувата, в первую очередь пируваткарбоксилазная реакция.
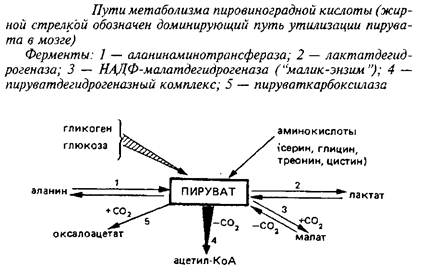
Легко обратимая аланинаминотрансферазная реакция протекает в митохондриальном и цитоплазматическом компартментах; в связи с тем, что активность соответствующего фермента невелика, эта реакция играет относительно небольшую роль в метаболизме пирувата в мозге. Эксперименты с С-предшественниками позволили рассчитать, что лишь около 2% пирувата превращается в аланин в физиологических условиях.
Однако участие в трансаминировании двух важнейших метаболитов нервной ткани – глутамата и а-кетоглутарата – заставило исследователей более внимательно изучить этот минорный путь метаболизма пирувата. Высказано предположение, что иитоплазматическая АлАТ может участвовать в регуляции конечных этапов гликолиза и утилизации глутамата.
Среди конечных этапов гликолиза и реакций, в которых участвует пировиноградная кислота, определенный интерес представляет лакташдегидрогеназная реакция. Подавляющая доля лактатдегидрогеназы в большинстве тканей связана с цитоплазмой. Однако в головном мозге до 10% от общей лактатдегидрогеназной активности клеток обнаруживается в митохондриях. В других тканях митохондриальной лактатдегидрогеназы значительно меньше; в печени, например, менее 1%. Предполагается, что это способствует более полному использованию конечных продуктов гликолиза в митохондриях.
ЛДГ и ее изозимы неравномерно распределяются между основными типами клеток мозга. Общая активность ЛДГ при расчете на 1 мг белка в глиальных клетках выше, чем в нейронах. На обогащенных фракциях и на культурах клеток показано преобладание «анаэробного» изофермента ДДГ5в глиальных клетках, в то время как для нейронов характерен «аэробный» изофермент ЯДГу Эти наблюдения, а также данные о меньшей скорости поглощения кислорода глиальными клетками по сравнению с нейронами хорошо согласуются со сделанным Х. Хиденом заключением о том, что нейронам свойственен аэробный обмен, тогда как метаболизм нейроглии адаптирован и к анаэробным условиям.
ЛДГ-реакция служит практически единственным путем метаболизма молочной кислоты в тканях животных, и лактат поэтому можно рассматривать как резервный фонд пирувата. Высокая активность ЛДГ, легкая обратимость этой окислительно-восстановительной реакции определяют ее важную роль в поддержании red-ox состояния пиридиновых нуклеотидов в клетке, в обеспечении динамического равновесия в системе пируватлактат.
Пировиноградная кислота, образующаяся в мозге в ходе реакций гликолиза, интенсивно используется для дальнейших метаболических превращений. Наглядно свидетельствует об этом сопоставление данных о скорости утилизации мозгом глюкозы и пирувата. Так, в экспериментах на белых крысах установлено, что скорость утилизации глюкозы составляет 0,65–0,70 мкмоль/мин», а пирувата – 1,30–1,40 мкмоль/мин» в расчете на 1 г ткани. Для сравнения можно указать, что скорость утилизации пирувата в печени заметно ниже и равна в среднем 0,35–0,40 мкмоль/мин» на 1 г ткани.
Представление о соотношении активностей ферментов, катализирующих основные пути метаболизма пирувата в митохондриях тканей крыс, дают результаты, приведенные в табл. 3.
Оценивая относительное значение каждого из основных метаболических превращений, в которых участвует пировиноградная кислота, необходимо подчеркнуть важную роль именно пируватдегидрогеназной реакции. Активность остальных ферментов, конкурирующих за пируват в митохондриях и вовлекающих этот субстрат в дальнейшие метаболические превращения, значительно ниже.
Таблица 3. Активность ферментов, участвующих в метаболизме пировиноградной кислоты в митохондриях головного мозга, печени и сердце крыс
| Ферменты | Кора больших полушарий головного мозга | Печень | Сердце |
| Пируватдегвдрогеназа | 752±40 | 405±56 | 544±43 |
| Пируваткарбоксил аза | 160+21 | 530±45 | 485±37 |
| Лактатдегидрогеназа | 480±35 | 170±9 | 104±19 |
| Аланинаминотрансфераза | 71±5 | 383±29 | 784±31 |
| НАДФ-малатдегидрогеназа | 85±7 | 78±4 | 9Ш1 |
Суммируя приведенные сведения, необходимо еще раз подчеркнуть следующие специфические для мозга особенности реакций гликолиза и их регуляции in vivo:
1. особую важность для энергетического метаболизма мозга гексокиназной реакции как основного пути ввода окисляемых субстратов в гликолитическую цепь;
2. однонаправленную и синхронную регуляцию адениновыми нуклеотидами скорости наиболее медленных этапов гликолиза – гексокиназной и фосфофруктокиназной реакций, что позволяет объединить эти два фермента в единый функциональный комплекс;
3. специфическую для мозга внутриклеточную локализацию лактатдегидрогеназы не только в цитоплазме, но и в митохондриях, что дает возможность более полно использовать лактат и пируват в дальнейших превращениях в митохондриях.
5. ЦИКЛ ТРИКАРБОНОВЫХ КИСЛОТ И МЕХАНИЗМЫ, КОНТРОЛИРУЮЩИЕ ЕГО СКОРОСТЬ В МОЗГЕ
Цикл трикарбоновых кислот является универсальным окислительным механизмом клетки. Он представляет собой сложную амфиболическую систему, имеет несколько возможных путей ввода окисляемых метаболитов и оттока отдельных продуктов реакций, основные из которых представлены на схеме 4.
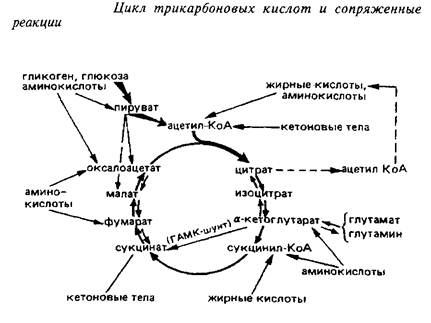
Пути пополнения пула метаболитов ЦТК в мозге
Источники образования ацетил-КоА. Важнейшим соединением, за счет которого постоянно пополняется пул компонентов ЦТК в большинстве тканей, служит ацетил-КоА – один из субстратов цитратсинтазной реакции. Это вещество может образовываться в целом ряде метаболических превращений. В митохондриях головного мозга основным поставщиком ацетилКоА для окисления его в ЦТК служит реакция окислительного декарбоксилирования пировиноградной кислоты под действием пируватдегидрогеназного комплекса.
В головном мозге взрослых животных до 80–90% пирувата подвергается окислительному декарбоксилированию с последующим окислением образующегося ацетил-КоА в ЦТК. В печени в этой реакции используется не более 15–20% субстрата, но активно функционирует другой механизм ввода пировиноградной кислоты в ЦТК – карбоксилирование ее под действием пируваткарбоксилазы до щавелевоуксусной кислоты.
Важным является и то, что в митохондриях головного мозга при самых разнообразных воздействиях сохраняется доминирование пируватдегидрогеназной реакции над остальными путями метаболизма пирувата, несмотря на то, что скорость отдельных реакций обмена субстрата может меняться. Например, было показано явное преобладание окислительного декарбоксилирования пировиноградной кислоты при таких экстремальных состояниях, резко нарушающих энергетический баланс, как гипоксия, разобщение окислительного фосфорилирования, тяжелая форма гипертиреоза.
Напротив, в митохондриях печени, сердечной и скелетных мышц, почках и других органах при изменении функционального состояния, при метаболических сдвигах разной природы преобладающим может стать любой из основных путей метаболизма пирувата. Например, в митохондриях печени в условиях интенсивного глюконеогенеза или при голодании скорость реакции карбоксилирования пирувата в 5–10 раз и более превышает скорость ПДГ-реакции.
Таким образом, окислительное декарбоксилирование пировиноградной кислоты, осуществляющее ввод этого метаболита в ЦТК, играет в головном мозге особо важную роль.
Большое значение ПДГ-реакции для метаболизма нервной ткани подтверждается также более высокой по сравнению с другими тканями чувствительностью ее к недостатку тиамина. Нарушение образования тиаминпирофосфата при В у-авитаминозе вызывает значительное угнетение окислительного декарбоксилирования пирувата, особенно резко проявляющееся в головном мозге и приводящее к нарушениям его функциональной активности.
Регуляция активности сложного мультиэнзимного пируватдегидрогеназного комплекса осуществляется несколькими путями. В настоящее время наиболее детально исследован механизм ковалентной химической модификации фермента. Этот механизм включает АТФ-зависимое фосфорилирование с помощью ПДГ-киназы, приводящее к образованию неактивного комплекса, и дефосфорилирование, катализируемое специфической фосфатазой, которое приводит, напротив, к образованию активной формы комплекса. Реакциям фосфорилирования-дефосфорилирования подвергается лишь один из компонентов ПДГкомплекса, а именно пируватдекарбоксилаза.
Фосфатазная реакция, т.е. активирование ПДГ-комплекса, стимулируется высокими концентрациями ионов Mg+, низкими – Са». Реакция фосфорилирования, т.е. инактинация ПДГ-комплекса, усиливается в присутствии высоких концентраций АТФ и ионов магния, но тормозится при возрастании уровня АДФ, который конкурирует в реакции с АТФ, т.е. важным фактором в регуляции взаимопревращений активной инеактивной форм ЦДХ-комплекса является внутримитохондриальное отношение АТФ/АДФ.
Во многих тканях это отношение сильно зависит от функционального состояния и прежде всего от типа преимущественного субстрата окисления. Например, в печени, почках, сердечной мышце при усилении окисления свободных жирных кислот резко возрастает уровень длинноцепочечных ацил КоА. Эти соединения нарушают перенос АТФ и АДФ через митохондриалъные мембраны с помощью адениннуклеотидтранслоказы, что приводит к повышению интрамитохондриального отношения АТФ/АДФ. В свою очередь, это способствует образованию неактивной фосфорилированной формы ПДГ-комплекса. Так, по данным П. Виланда и соавторов, после 24-часового голодания доля активной формы ПДГ в 2,5–5 раз снижалась во всех тканях крыс, кроме головного мозга, где она оставалась практически неизменной.
Большое значение ПДГ-реакции в обеспечении энергетического обмена в мозге, а также то, что максимальная активность ПДГ-комплекса лишь немногим выше средней скорости потока пирувата в мозге взрослого интактного животного, указывает на существование в нервной ткани тонкой и эффективной системы регуляции ПДГ-комплекса. Установлено, что доля активной дефосфорилированной формы ПДГ в мозге значительно выше, чем во многих других тканях: в мозге активная форма составляет около 70% от общей активности фермента в ткани; в сердие – 40–60, в печени, жировой ткани – около 20%.
Недавно высказана гипотеза о том, что регуляция фосфорилирования ПДГ-комплекса играет существенную роль в модуляции пластичности синапсов, поскольку обнаружена тесная корреляция между степенью фосфорилирования ПДГ и процессами тренировки и обучения.
Значительный вклад в регуляцию скорости окислительного декарбоксилирования пирувата вносят изменения концентрации конечных продуктов реакции – ацетил-КоА и НАДН, накопление которых в митохондриях ведет к торможению ПДГ-реакции Следует отметить, что действие этих факторов включает как непосредственное ингибирование фермента продуктом реакции, так и влияние НАДН и ацетил-КоА на взаимопревращения Фосбооилированной и дефосфорилированной форм ПДГ.
АцетилКоА и НАДН являются конкурентными ингибиторами фермента по отношению к свободному КоА или НАД+ соответственно. Наряду с этим оба метаболита служат положительными эффекторами ПДГ-киназы, катализирующей переход фермента в неактивную фосфорилированную форму.
Относительная роль этих факторов в регуляции ПДГ-реак-ции в мозге неодинакова. Концентрация НАДН, а точнее – отношение НАД+/НАДН является весьма лабильной величиной, особенно в митохондриях тканей с высокой интенсивностью окислительно-восстановительных процессов. Поэтому этот фактор участвует в контролировании скорости ПДГ-реакции как в головном мозге, так и в других тканях. Напротив, регуляторная роль другого продукта реакции – ацетилКоА – в головном мозге меньше, чем в других тканях, которые способны к окислению больших количеств свободных жирных кислот и, следовательно, к значительным изменениям в концентрации ацетилКоА.
Таким образом, в митохондриях головного мозга доминирующий путь метаболизма пировиноградной кислоты – окислительное декарбоксилирование – контролируются главным образом изменением отношения АТФ/АДФ и НАД+/НАДН в митохондриях. Опыты с 2С-пируватом показали, что скорость использования образующегося в ПДГ-реакции ацетилКоА для синтеза цитрата в головном мозге в 3,0–4,5 раза выше, чем в печени, почках и сердце.
Свободные жирные кислоты и кетоновые тела как источники ацетилКоА в мозге. Образование ацетилКоА для цитратсинтазной реакции может происходить также в реакциях окисления свободных жирных кислот или кетоновых тел, а также в ходе метаболических превращений ряда аминокислот. Однако оба эти пути пополнения фондов ацетилКоА, имеющие большое значение для многих тканей, в мозге взрослых животных играют весьма скромную роль.
Например, в экспериментах с С глюкозой и, С пальмитиновой кислотой, выполненных на срезах мозга кролика, установлено, что до С02 и Н20 окисляется 385±15 нмоль глюкозы и лишь 0,02–0.04 нмоль жирной кислоты в расчете на I г ткани за 1 ч. Такая колоссальная разница в скорости утилизации двух энергетических субстратов объясняется низкой активностью ферментов, лимитирующих окисление свободные жирных кислот в мозге взрослых животных, в первую очередь – низкой активностью апилКоА-синтазы.
Напротив, в головном мозге растущих животных свободные жирные кислоты и особенно кетоновые тела окисляются гораздо интенсивнее, чем у взрослых. Это обусловлено несколькими факторами. Во-первых, более высокой концентрацией кетоновых тел в крови в неонатальный период, когда животное получает в основном молочную пищу. Во-вторых, с возрастом, по мере формирования гематоэнцефалического барьера, уменьшается скорость поглощения мозгом кетоновых тел из крови. Так, при одинаковой концентрации кетоновых тел в крови артериовенозная разница для мозга 16–20-дневных крысят в 3–4 раза выше, чем у взрослых.
Еще одним важным обстоятельством, обусловливающим более интенсивное использование кетоновых тел мозгом растущих животных, является высокая активность ферментов, лимитирующих скорость этого процесса: 3-р-окси-бутиратдегидрогеназы, КоА-трансферазы р-кислот и ацетоадетил – КоА-тиолазы Активность первых двух энзимов обнаруживается в мозте уже при рождении, достигает максимума к 20–25-му дню, а затем резко снижается. У 20–25-дневных крыс активность этих ферментов в 2–3 раза выше, чем у взрослых животных. Аналогичный характер имеют возрастные изменения активности митохондриальной формы ацетоацетил-КоА-тиолазы. Однако общая активность фермента в нервных клетках наиболее высока у новорожденных животных, а затем постепенно снижается. Ранняя постнатальная индукция «ключевых» ферментов метаболизма кетоновых тел контрастирует со значительно более медленным возрастанием активности лимитирующих ферментов гликолиза, ЦТК, а также пируватдегидрогеназного комплекса. Из-за значительного преобладания активности ацетилКоА-тиолазы над активностью ПДГ в мозге растущих животных ацетилирование свободного TCoA-SH происходит главным образом в тиолазной реакции а у взрослых – в пируватдегидрогеназ-ной.
В головном мозге растущих животных ацетилКоА, образующийся в ходе метаболизма кетоновых тел, расходуется не только на окисление в ЦТК, но в значительной мере идет на процессы биосинтеза специфических липидов мозга. Интенсивное окисление кетоновых тел характерно именно для периода миелинизации, роста аксонов и дендритов и образования функциональных синаптических комплексов.
Использование кетоновых тел в качестве источника ацетилКоА, но уже не для биосинтетических реакций, а для окисления в ЦТК, т.е. в виде энергетических субстратов, возможно и в мозге взрослых животных при ряде экстремальных состояний; в частности, это имеет место при длительном голодании, когда на фоне исчерпания углеводных ресурсов организма резко возрастает концентрация кетоновых тел в крови за счет распада и окисления липидов из жировых депо. Аналогичные ситуации наблюдаются также при тяжелых формах диабета или гипертиреоза. Но даже в этих условиях за счет окисления свободных жирных кислот и кетоновых тел покрывается не более 20% энергетических потребностей мозга.
Аминокислоты как источники ацетилКоА. Реакции превращения свободных аминокислот, ведущие к образованию ацетилКоА, у взрослых животных наиболее интенсивно протекают в печени и почках, где они могут эффективно пополнять пул этого метаболита. В головном мозге роль такого пути образования ацетилКоА весьма незначительна.
Превращения этих аминокислот, а также кетоновых тел в мозге взрослых животных сосредоточены главным образом в «малом» компартменте, где особенно ярко проявляется анаболическая функция ЦТК. Морфологически этот компартмент приурочен к глиальным клеткам. Напротив, катаболическая, энергетическая функция ЦТК наиболее четко проявляется в «большом» компартменте мозга, где интенсивно протекают реакции аэробного окисления глюкозы.
Скорости метаболических потоков для мозга мышей составляют: 1,25 мкмоль субстрата или 0,30 мкмоль субстрата за 1 мин в расчете на 1 г сырой массы ткани для «большого» и «малого» компартментов соответственно. Обмен метаболитов между компартментами осуществляется относительно медленно; скорость потока в данном случае составляет в среднем 0,14 мкмоль субстрата/ мин в расчете на 1 г ткани.
Использование аминокислот в качестве предшественников компонентов ЦТК Свободные аминокислоты, а также аминокислоты, образующиеся при расщеплении белков, могут претерпевать окисление и превращения их в различные компоненты ЦТК Как известно, существует несколько путей вхождения аминокислот в ЦТК, причем относительная роль их в пополнении пула метаболитов UTK различна в разных тканях.
Наиболее интенсивно метаболизм аминокислот протекает в печени, где эти соединения играют значительную роль в энергетическом обмене. В мозге взрослых животных свободные аминокислоты, плохо проникающие через ГЭБ, не могут рассматриваться как важные энергетические источники. Исключение в этом отношении составляют аминокислоты глутаминовой группы. Для головного мозга характерны высокое содержание аминокислот этой группы и значительная активность ферментов их обмена в митохондриях.
Активность аспартатаминотрансферазы в митохондриях мозга взрослых крыс составляет в среднем 30–35 мкмоль субстра-тамин- в расчете на 1 г ткани, что в 7–10 раз превышает активность фермента в мозге новорожденных животных и значительно выше, чем в митохондриях печени. Высокая активность трансамисназ и глутаматдегидрогеназы в митохондриях головного мозга, а также результаты опытов с С-аминокислотами указывают на возможность использования аминокислот этой группы в качестве дополнительного энергетического источника, что особенно важно при различных экстремальных состояниях, когда повышаются энергетические потребности мозга или замедляется поступление в мозг глюкозы.
Таблица 4. Средние данные о содержании аминокислот глутаминовой группы в головном мозге и печени крыс
| Аминокислоты | Содержание в целой ткани» мкмоль/г | Содержание в обогащенных фракциях коры больших полушарий мозга, нмоль/г белка | ||
| мозг | печень | нейроны | нейроглия | |
| Глутаминовая кислота | 7,3–9,5 | 1,5–1,7 | 14,2±2Д | 23,0±2,9 |
| Глутамин | 3,8–4,7 | 1,8–2,3 | 6,9±1,4 | 4,8±0,6 |
| Аспарагиновая кислота + аспарагин | 4,8–5,8 | 0,4–0,7 | 6,0±1,5 | 6,3±0,8 |
| ГАМ К | 1,9–2,4 | Следы | 3,1 + 1,1 | 4,1±0,4 |
Из других путей метаболизма аминокислот, которые играют относительно небольшую роль в энергетическом метаболизме головного мозга, можно упомянуть превращение аспартата и аспарагина в оксалоацетат, а также аланина и серина – в пируват. Очень невелико и значение аминокислот как предшественников компонентов ЦТК – суклинил-KoA и фумарата.
Итак, основным путем ввода окисляемых субстратов в ЦТК в головном мозге служит образование ацетилКоА в пируватдегидрогеназной реакции. Дополнительным источником для пополнения пула метаболитов ЦТК могут быть аминокислоты глутаминовой группы, в то время как кетоновые тела и свободные жирные кислоты интенсивно окисляются лишь в мозге растущих животных.
Промежуточные компоненты ЦТК для разнообразных синтетических реакций в мозге в отличие от других тканей используются в незначительных количествах. Именно этим объясняется, что интенсивность потока метаболитов через ЦТК в головном мозге прямо пропорциональна потреблению кислорода тканью.
При рассмотрении особенностей регуляции ЦТК в головном мозге прежде всего следует остановить внимание на тех его неравновесных стадиях, которые являются лимитирующими. В табл. 5,5 приведены значения активностей ферментов ЦТК
Таблица 5. Содержание основных компонентов и активность ферментов ЦТК в головном мозге и печени крыс
| Компоненты ЦТК | Содержание, мкмоль/г ткани | Ферменты ЦТК | Активность ферментов в митохондриях, мкмоль субстрата • мг белка за 1 мин | ||
| мозг | печень | мозг | печень | ||
| Ацетил-КоА* | 11,0±0,9 | 4,0–5,0 | Цитратсинтаза | 8,210,3 | 6,410,3 |
| Оксалоацетат | 7,4910,35 | 9,01±0,40 | |||
| Цитрат | 320±12 | 228±9 | Аконитаза** | 46,013,1 | – |
| Изоцитрат | 27,313,5 | 24,013,0 | НАД- изоцитратдегидрогеназа | 28,312,2 | 5,610,4 |
| НАДФ-изоцитратдегидрогеназа | 19,611,5 | 32,012,4 | |||
| а – Кетоглутарат | 125±10 | 114±9 | а – Кетоглутаратдегидрогенеза | 58,913,7 | 64,514,9 |
| Сукцинат | 791±26 | 804±24 | Сукцинатдегидрогеназа | 106,0115,7 | 145,2120,1 |
| Фумарат | – | – | Фумараза | – | – |
| Малат | 356121 | 420128 | НАД-малатдегидрогеназа | 407,0135,5 | 385,0140,2 |
содержание основных компонентов ЦТК в головном мозге печени крыс. Видно, что к наиболее медленным этапам, которые могут лимитировать скорость потока субстратов через цикл в мозге, как и в других тканях, относятся реакции синтеза и окисления цитрата.
Похожие работы
... и постоянным для каждого индивидуума. Кровоснабжение головного мозга В норме кровоснабжение головного мозга осуществляется двумя парами - сонных и позвоночных, которые широко анастомозируют между собой концевыми ветвями, образуя на основании мозга Велизиев круг. Клинические проявления недостаточности мозгового кровообращения можно понять через сопоставление величины кровоснабжения мозга и ...
... снижение уровня неметаболического излишка СО2 и ЧСС. Итак, применение нетрадиционных природных биологически активных веществ является одним из эффективных методов дифференциро ванного повышения энергетических потенций организма спортсменов. При использовании растительных пищевых добавок в практике спорта могут быть рекомендованы следующие показания и схемы их приема: - курсовой прием продуктов ...
... нервные «приборы», посредством которых человек осуществляет анализ раздражений. Любой анализатор состоит из трех основных частей: рецептора, проводящих нервных путей и центра в коре больших полушарий головного мозга. Основной функцией рецептора является превращение энергии действующего раздражителя в нервный процесс. Вход рецептора приспособлен к приему сигналов определенной модальности (вида) – ...
... в понимание таких проблем, как соотношение духа и материи, объект-субъектный дуализм, объективность знания, редукционизм и другие. Те проблемы философско-методологическо-го характера, которые ставятся и обретают свое решение в контексте нейробиологической конструктивистской эпистемологии, Рот формулирует в виде парадоксов. Ниже приведены основные из них. ''Первый касается недостающего мира и ...
0 комментариев