Навигация
Елюати з інсулінового сорбенту, які не зв’язались з білком G;
3. Елюати з інсулінового сорбенту, які не зв’язались з білком G;
4. Білки, елюйовані з сорбенту білок G-сефароза 4В (антитіла до інсуліну).
З даних електрофореграм видно, що застосування білок G-сефарози дає змогу розподілити БЗІ, отримані з інсулінового сорбенту, на дві фракції. Одна з них, за всіма ознаками, належить до білків імуноглобулінової природи – важких і легких ланцюгів IgG, з молекулярною масою близько 60 та 30 kДa. До складу другої фракції входять інші БЗІ. Електрофореграми білків, здатних зв’язуватись з інсуліном, але не реагувати з білком G (який має властивість з’єднуватись з Fc-фрагментом IgG), налічує значну кількість смуг, найвиразніша з яких розташована в зоні білків з молекулярною масою, притаманною альбумінам (66 kДa). Ще одна смуга, розташована над альбуміновою зоною, відповідає зоні трансферину (78 kДa). З даних літератури відомо, що у хворих на ЦД саме ці білки зазнають змін у кількісному відношенні [T. Sundsten et al., 2005]. Можна також припустити, що окрему групу БЗІ складають фрагменти a-субодиниць інсулінового рецептора з молекулярною масою біля 70 кДа. Що стосується інших БЗІ, які не сорбуються на білок G-сефарозі, то їх ідентифікація потребує подальших досліджень, оскільки для висновку щодо належності окремих смуг у всіх представлених електрофореграмах до певного типу білків необхідні додаткові дослідження їх і перш за все – імуноблотинг з використанням, наприклад МКА до альбуміну, трансферину, окремих фрагментів імуноглобулінів (Fc, Fab) та до інших білків.
Враховуючи те, що значна частина виділених БЗІ за всіма ознаками належить до імуноглобулінів, які відіграють суттєву роль при різноманітних патофізіологічних станах, ми вважали за доцільне дослідити їх детальніше. Це спонукало нас до опрацювання власного методу ІФА для визначення ІА та ІАА в сироватках крові людей. У подальшому цей метод планувалось використати для визначення їх вмісту в усіх білкових фракціях, виділених методом поетапної афінної хроматографії з сироваток крові здорових людей та хворих на ЦД.
При відпрацюванні початкового етапу – зв’язування антигену з твердою фазою, були апробовані планшети типів “PoliSorp”, “MediSorp” та “MaxiSorp” виробництва фірм “Dynatech” і “Nunc”. Ми дійшли висновку, що для нашої мети найбільш придатні планшети типу “MediSorp” і всю подальшу роботу проводили з використанням саме цих носіїв.
Для розведення сироваток та блокування неспецифічного зв’язування сироваткових білків із вільними від інсуліну місцями на планшеті використовували розчин знежиреного молока в 0,1 М фосфатно-сольовому буферному розчині з додаванням твіну 20.
При визначенні оптимальної концентрації інсуліну, необхідної для сорбції на твердій фазі, використовували кристалічний напівсинтетичний інсулін людини виробництва фірми “Hoechst”. Показано, що застосування розчину інсуліну з концентрацією 25 мкг / мл є найбільш вдалим, оскільки в цьому випадку співвідношення ОГ всіх позитивних за вмістом ІА сироваток (0,423) до ОГ всіх негативних (0,051) – найкраще (табл. 1). Збільшення концентрації інсуліну в розчинах для сорбції (50 мкг / мл) не призводило до суттєвого поліпшення результатів. Проте, використання інсуліну в високих концентраціях може призвести до нашарування молекул гормону, які під час відмивання зсуваються й частково видаляються разом із промивним розчином (0,1 М фосфатно-сольовий буферний розчин з 0,05 % тритоном Х-100).
Незважаючи на те, що при використанні розчинів з меншим вмістом інсуліну реєструються вищі значення ОГ, існує можливість отримати хибно-позитивні результати за рахунок сорбції ІgG сироватки крові з “вільними” місцями в лунках планшетів (див. результати визначення вмісту ІА в сироватках № 482 і № 468).
Таблиця 1
Результати визначення антиінсулінових антитіл у сироватках крові здорових людей та хворих на цукровий діабет при використанні різних концентрацій напівсинтетичного інсуліну людини (“Hoechst”) у розчині для сенсибілізації планшетів “Dynatech”
| Сироватки №№ | Концентрація інсуліну (мкг/мл) | ||||||
| 0,5 | 1,0 | 5,0 | 10,0 | 25,0 | 50,0 | ||
| Здорові люди | 7 | 0,058 | 0,037 | 0,022 | 0,022 | 0,021 | 0,022 |
| 185 | 0,321 | 0,290 | 0,157 | 0,101 | 0,052 | 0,046 | |
| 482 | 0,769 | 0,774 | 0,182 | 0,099 | 0,068 | 0,061 | |
| 468 | 0,476 | 0,499 | 0,135 | 0,078 | 0,063 | 0,061 | |
| М ± m | 0,406 ± 0,15 | 0,400 ± 0,16 | 0,164 ± 0,04 | 0,075 ± 0,02 | 0,051 ± 0,01 | 0,048 ± 0,01 | |
| Хворі на ЦД | 10 | 0,203 | 0,206 | 0,266 | 0,326 | 0,449 | 0,536 |
| 14 | 0,642 | 0,595 | 0,285 | 0,286 | 0,286 | 0,288 | |
| 171 | 0,120 | 0,095 | 0,281 | 0,352 | 0,508 | 0,508 | |
| 423 | 0,320 | 0,389 | 0,469 | 0,501 | 0,455 | 0,445 | |
| М ± m | 0,321 ± 0,23 | 0,321 ± 0,22 | 0,325 ± 0,10 | 0,366 ± 0,09 | 0,423 ± 0,10 | 0,444 ± 0,11 | |
| Тло | 0,014 | 0,010 | 0,013 | 0,011 | 0,010 | 0,012 | |
Примітки: тло – проба без сироватки; жирним шрифтом позначено ОГ, що перевищує граничне значення; курсивом позначено ОГ, що знаходиться в межах граничних значень; результати представлено в одиниця ОГ.
При опрацюванні методу проводились експерименти, мета яких полягала у з’ясуванні можливості використання інсулінів різного походження та виробництва різних фірм для сенсибілізації твердої фази. Це мало суто практичний інтерес, бо дає змогу, у разі потреби, замінити інсулін людини фірми “Hoechst”, на інший – з таким же ефектом. Для цього відібрали кристалічні інсуліни людини та свині, лікарські форми інсулінів, а для порівняння – А21-монодезамідоінсулін (табл. 2).
Як видно з табл. 2, при визначенні вмісту ІА в одних і тих самих сироватках, отримано подібні результати (ОГ/ГЗ негативних зразків від 0,021 до 0,028; ОГ/ГЗ позитивних зразків від 2,61 до 3,61) при використанні всіх інсулінів, крім А21-монодезамідоінсуліну (ОГ/ГЗ негативних зразків 0,013, а позитивних – 0,99), що можна пояснити наявністю в нього специфічних антигенних детермінант.
Таблиця 2
Вміст антитіл до інсуліну у відібраних позитивних та негативних сироватках крові людей за умов сенсибілізації планшетів різними інсулінами
| Зразки | ІНСУЛІНИ (25 мкг/мл) | |||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | |
| В-к | 0,09 | 0,10 | 0,09 | 0,11 | 0,06 | 0,09 | 0,09 | 0,09 | 0,09 | 0,06 |
| М-ко | 0,11 | 0,09 | 0,08 | 0,06 | 0,10 | 0,08 | 0,12 | 0,12 | 0,51 | 0,06 |
| 46 | 0,55 | 0,66 | 0,61 | 0,63 | 0,53 | 0,48 | 0,53 | 0,60 | 0,50 | 0,33 |
| 449 | 0,17 | 0,23 | 0,24 | 0,14 | 0,21 | 0,25 | 0,19 | 0,19 | 0,16 | 0,10 |
| 470 | 0,19 | 0,16 | 0,21 | 0,16 | 0,21 | 0,20 | 0,18 | 0,21 | 0,16 | 0,13 |
| 79 | 0,23 | 0,22 | 0,24 | 0,18 | 0,25 | 0,21 | 0,25 | 0,33 | 0,28 | 0,11 |
| М ± m | 0,22 ± 0,07 | 0,24 ± 0,09 | 0,25 ± 0,08 | 0,21 ± 0,09 | 0,23 ± 0,07 | 0,22 ± 0,06 | 0,23 ± 0,06 | 0,26 ± 0,08 | 0,28 ± 0,07 | 0,13 ± 0,04 |
| 102 | 1,63 | 1,43 | 1,60 | 1,24 | 1,70 | 1,52 | 1,36 | 1,67 | 1,82 | 0,27 |
| 151 | 3,32 | 3,08 | 3,35 | 2,99 | 2,95 | 3,45 | 4,02 | 3,15 | 4,30 | 1,03 |
| 171 | 2,93 | 2,96 | 2,86 | 2,99 | 3,02 | 4,33 | 3,93 | 3,25 | 3,95 | 1,07 |
| 423 | 2,63 | 1,86 | 2,05 | 1,71 | 2,24 | 2,81 | 2,90 | 2,87 | 1,66 | 0,62 |
| 506 | 1,23 | 1,23 | 1,37 | 1,30 | 1,22 | 1,91 | 1,85 | 1,71 | 1,37 | 0,38 |
| 554 | 6,74 | 5,96 | 6,76 | 5,45 | 5,64 | 7,34 | 6,88 | 7,57 | 8,53 | 2,57 |
| М ± m | 3,08 ± 0,80 | 2,75 ± 0,71 | 3,00 ± 0,81 | 2,61 ± 0,65 | 2,80 ± 0,64 | 3,56 ± 0,86 | 3,49 ± 0,81 | 3,37 ± 0,89 | 3,61 ± 1,11 | 0,99 ± 0,34 |
Примітки:
1. Результати представлені як співвідношення ОГ/ГЗ, де ОГ – оптична густина проби, ГЗ – граничне значення в системі.
2. Жирним шрифтом виділено значення, які перевищують граничні.
3. Сироватки: В-к, М-ко, 46 – здорових людей; 449, 470, 79 – хворих на ЦД (негативні за вмістом антитіл до інсуліну); 102, 151, 171, 423, 506, 554 – хворих на ЦД (позитивні за вмістом антитіл до інсуліну).
4. Використані інсуліни: біосинтетичний кристалічний інсулін людини: 1 – “Lilly” (США), 2 –“Novo Nordisk” (Данія); напівсинтетичний кристалічний інсулін людини “Hoechst” (Німеччина) – 3; біосинтетичний інсулін людини “Актрапід НМ” (“Novo Nordisk”) – 4; напівсинтетичний інсулін людини “Інсуман Рапід” (“Індар”, Україна); інсулін свині кристалічний (“Hoechst”) – 6; інсулін свині “Актрапід МС” (“Novo Nordisk”) – 7, “Моноінсулін МК” (“Індар”) – 8; аналог інсуліну людини “NovoRapid” (“Novo Nordisk”) – 9; кристалічний A21-монодезамідоінсулін людини (“Novo Nordisk”) – 10.
Важлива умова успішного проведення ІФА – підбір кон’югату вторинних антитіл до Іg людини з ферментом та його концентрації, оскільки при високій концентрації кон’югату спостерігається надлишкове неспецифічне зв’язування його з носієм, а при низьких концентраціях – чутливість аналізу може знижуватись в результаті уповільненого перетворення субстрату на продукт ферментативної реакції. До такого ж висновку дійшли й інші дослідники [А.В. Масяго, 2002; Н.В. Іванська, 2003].
У процесі роботи ми випробували не тільки МКА до ІgG людини, мічені пероксидазою хрону, але й поліклональні антитіла (ПКА) до всіх класів імуноглобулінів, одержані шляхом імунізації кіз (Всеросійський інститут сільськогосподарських технологій, Москва). Розведення кон’югату з МКА становило 1: 100 000, з ПКА – 1:10 000 (табл. 3).
Таблиця 3
Вміст ІА та ІАА в сироватках крові хворих на цукровий діабет
з використанням різних кон’югатів
| Досліджувані зразки | Кон’югат | |
| МКА-Пх | ПКА-Пх | |
| Тло | 0,035 | 0,043 |
| 34 | 1,627 | 0,895 |
| 38 | 0,230 | 0,947 |
| 42 | 0,566 | 0,409 |
| 99 | 0,612 | 1,188 |
| 482 | 0,904 | 1,144 |
| 6 | 0,687 | 0,496 |
| 10 | 0,815 | 0,513 |
| 14 | 0,732 | 0,698 |
| 423 | 0,633 | 0,435 |
Примітки:
1. Тло – проба без внесення сироватки.
2. МКА-Пх – моноклональні антитіла до імуноглобулінів людини класу G, мічені пероксидазою хрону.
3. ПКА-Пх – поліклональні антитіла до імуноглобулінів людини класу G, мічені пероксидазою хрону.
Як видно з представлених даних, реакція деяких сироваток (34, 42, 6, 10, 423) в ІФА була інтенсивніша з МКА, ніж з ПКА; з іншими сироватками (38, 99, 482) отримано протилежні результати. Пояснення цьому може полягати як в гетерогенності ІА та ІАА в цих зразках щодо їхньої спорідненості, так і в належності їх до різних підкласів IgG. ПКА, навіть проти однієї – єдиної антигенної детермінанти, гетерогенні як за структурою активного центра, так і за фізико-хімічними властивостями. У тому випадку, коли антиген полівалентний, як наприклад інсулін, в сироватці крові утворюються антитіла, які направлені проти кожної окремої детермінанти (епітопа); це призводить до ще більшого урізноманітнення антитіл. Усі ці фактори впливають на гетерогенність антитіл та обумовлюють певні труднощі при дослідженні їх структури та визначенні вмісту в крові [А.М. Егоров, 1991].
На початкових етапах розробки імуноферментного методу як хромоген використовували ОФД, який потребує дотримання особливих умов безпеки, пов’язаних з канцерогенними властивостями цієї речовини. Хоча ОФД і досі включають у деякі комерційні імуноферментні набори, та все ж останнім часом більш безпечним хромогеном вважають ТМБ, оскільки він сам та його метаболіти не проявляють мутагенної та канцерогенної дії [Н.В. Іванська, 2003]. З даних порівняльного аналізу хромогенів ОФД та ТМБ випливає, що при використанні обох хромогенів різниці в отриманих результатах практично немає, тому в подальшому застосовували ТМБ.
Розроблений імуноферментний метод використано для обстеження дорослих хворих на ЦД та донорів (табл. 4). Отримані результати значною мірою збігаються з даними, які наводяться в літературних джерелах [Ueno H. et al., 1994; Schloot N.C. et al., 1997; Zigler A.G. et al., 1999;].
Таблиця 4
Результати виявлення антитіл до інсуліну в сироватках крові дорослих людей опрацьованим імуноферментним методом
| Групи людей | Кіль-кість осіб | Співвід-ношення чоловіки / жінки | Середній вік (від і до), роки | Середня тривалість захворю- вання (від і до), роки | Середня тривалість інсулінотерапії (від і до), роки | % осіб, у сироватках крові яких виявлено ІА або ІАА |
| Донори | 194 | - | 18 - 52 | - | - | 0,52 |
| Хворі на ЦД-1 | 438 | 152/286 | 36,47±0,61 (17-68) | 13,61±0,49 (0,5-42) | 13,61±0,49 (0,5-42) | 10,96* |
| Хворі на ЦД-2 (+Iнс.) | 188 | 83/105 | 59,36±0,64 (37-83) | 14,20±0,62 (0,5-43) | 5,40 ± 1,17 (0,5-27) | 4,26* |
| Хворі на ЦД-2 (-Iнс.) | 104 | 41/63 | 60,01±0,82 (38-81) | 9,13±0,73 (0,5-36) | - | 1,92 |
Примітки: 1) +Iнс. – хворі на ЦД-2, які отримували препарати інсуліну; 2) -Iнс. – хворі на ЦД-2, які не отримували препарати інсуліну; * – достовірно стосовно групи донорів (за критерієм ч 2).
Опрацьований метод використали також для визначення вмісту ІА та ІАА в сироватках крові різних груп дітей. У жодної здорової дитини не було виявлено ІАА, в той час як у групі ризику захворювання на ЦД-1 ІАА були наявні в 5,71 % дітей. Серед дітей, хворих на ЦД-1, ІА та ІАА знайдено в 16,67 % осіб. Таким чином, показано, що розроблений імуноферментний метод придатний для визначення ІА та ІАА в сироватках крові дорослих і дітей.
Основні діагностичні характеристики будь-якого методу, які свідчать про його надійність – це чутливість, специфічність та відтворюваність отримуваних результатів.
Встановлено, що специфічність розробленого імуноферментного методу становить 90,9 %, а чутливість – 82,4 %; внутрішньосерійний коефіцієнт варіації складає 9,09 % для негативних зразків і 3,53 % для позитивних, а міжсерійний – 4,34 % для негативних зразків і 5,5 % для позитивних.
На основі розробленого твердофазного імуноферментного методу для визначення вмісту антитіл до ендогенного або екзогенного інсулінів у співавторстві з працівниками НВК “Діапроф-Мед” було створено тест-систему, яку назвали “ІФА-АТ-інс”.
Розроблену систему “ІФА-АТ-інс” порівнювали з комерційною імуноферментною тест-системою “ORG-520” (“ORGentech”, Німеччина). Деяка різниця в результатах визначення ІА обома методами може бути зумовлена різними способами оцінки граничної зони та особливостями застосованих кон’югатів.
Підсумовуючи отримані результати, можна зробити висновок, що тест-система “ІФА-АТ-інс” подібна до імуноферментної комерційної “Anti-insulin ORG-520”, відповідає вимогам, поставленим до тест-систем на основі ІФА для визначення ІА та ІАА і може бути використана для виявлення їх у сироватках крові людей.
Тест-систему “ІФА-АТ-інс” порівнювали також з комерційним радіоімунним набором “IA-AIA CIS biointernational” (Франція). При цьому проведено дві серії досліджень. Для першої серії експериментів відібрали сироватки крові 10 донорів та 79 хворих на ЦД, серед яких 48 хворих на ЦД-1 і 31 – на ЦД-2. Для другої серії відібрали сироватки від 92 хворих на ЦД-1 та ЦД-2.
У першій серії експериментів при дослідженні 48 сироваток крові від хворих на ЦД-1 методом ІФА зафіксовано 14 позитивних сироваток, 32 негативні і два сумнівних зразки. Аналіз тих же сироваток методом РІА виявив 11 позитивних та 20 негативних зразків, у 15 сироватках зв’язування міченого інсуліну з ІА становило або було менше за 20 %, тобто ІА містились в низьких титрах. З 31 сироватки крові від хворих на ЦД-2 методом ІФА визначено 2 позитивних і 29 негативних зразків, а методом РІА – 2 і 27 сироваток, відповідно. Останнім методом виявлено також 2 сироватки з низькими титрами ІА. При дослідженні донорських сироваток розбіжностей між отриманими результатами не виявлено.
Постановка другої серії експериментів принципово не відрізнялась від першої. Після визначення ІА у сироватках крові хворих на ЦД невідповідні результати отримано в 5 зразках.
Таким чином, після дослідження сироваток крові хворих на ЦД тест-системою “ІФА-АТ-інс” та “IA-AIA CIS biointernational” виявилось, що у деяких випадках отримані результати не співпадають. Подібні розбіжності спостерігали й інші дослідники [L.Nell et al., 1989; K.F. Federlin, 1993; D. Devendra et al., 2003, 2004]. Пояснення цього може полягати в тому, що визначення антитіл проведено методами, які суттєво відрізняються один від одного. При застосуванні РІА, в якому використовують поліетиленгліколь, крім ІА та ІАА можуть осаджуватись й інші БЗІ, і тим самим призводити до завищення вмісту визначених ІА та ІАА. Цим можна пояснити і значну кількість сироваток з невеликим (7-20) відсотком зв’язування з 125І-інсуліном, які, згідно з інструкцією, слід відносити до позитивних.
Існують певні труднощі в інтерпретації результатів визначення ІА та ІАА у людей з ЦД. Вони полягають у тому, що в цієї категорії хворих, в залежності від віку, тривалості інсулінотерапії, типу ЦД, а також особливостей імунного статусу організму, утворюються ПКА з високою або низькою афінністю проти різних епітопів інсуліну. Слід також брати до уваги, що ендогенний або екзогенний інсулін, який міститься в сироватці хворих, здатен зв’язуватись з ІА та ІАА, утворюючи комплекси інсулін-антитіло, і тим самим змінювати кількість ІА або ІАА при визначені різними методами.
Оскільки при порівнянні тест-системи “ІФА-АТ-інс” з комерційною радіоімунною “Cis biointernational” результати визначення ІА та ІАА у частині зразків крові хворих на ЦД не співпадали, то для з’ясування можливих причин розбіжності та для більш детального дослідження БЗІ застосовували поетапну афінну хроматографію таких сироваток на сорбентах з інсуліном та білком G.
Методом поетапної афінної хроматографії з сироваток крові різних хворих на ЦД і здорових людей було виділено білкові фракції, що мають властивість зв’язуватись з інсуліном. Для цього були проаналізовані зразки сироваток крові хворих на ЦД, де кількість ІА та ІАА, визначених методами ІФА та РІА, суттєво відрізнялась (табл. 5).
Таблиця 5Кількість білка, виділеного методом поетапної афінної хроматографії
з 1 мл сироватки крові хворих на ЦД та донорів
| Сироватки крові хворих на ЦД-1 | Кількість білка (мг), виділеного з інсулінового сорбенту | Кількість білка (мг), виділеного на сорбентах з білками А або G |
| 1) Ф-в | 0,686 | 0,086 |
| 2) Т-ч | 1,210 | 0,203 |
| 3) М-я | 0,079 | Н/д |
| 4) Б-в | 0,017 | Н/д |
| 5) Т-в | 0,028 | Н/д |
Примітка: Н/д – не досліджувалось
Загальна особливість перших трьох таких сироваток (Ф-в, Т-ч, М-я) така, що при дослідженні вмісту ІА та ІАА методом ІФА вони визначені як негативні, а при використанні РІА – як позитивні. З певною пересторогою можна вважати за контрольні дві інші сироватки хворих на ЦД-1 (Б-в, Т-в), в яких не знайшли ІА та ІАА обома застосованими методами.
З одержаних даних витікає, що в досліджених зразках крові міститься різна кількість БЗІ, проте не всі вони належать до білків імуноглобулінової природи.
Однак ці результати свідчили тільки про різницю в кількості білків, виділених на обох типах сорбентів з сироваток крові хворих на ЦД та донорів; фракції, вимиті з названих сорбентів, не були досліджені на вміст ІА. Ми вважали за доцільне провести аналогічні дослідження окремих сироваток, в яких при проведенні РІА і ІФА була розбіжність щодо вмісту ІА. Використання поетапної афінної хроматографії для таких зразків з подальшим аналізом отриманих фракцій методом ІФА дало можливість обґрунтованіше стверджувати про наявність або відсутність ІА та ІАА у нативних сироватках. Результати проведених досліджень наведено в табл. 6.
Таблиця 6
Вміст ІА у фракціях, одержаних після поетапного розподілу методом афінної хроматографії сироваток крові хворих на ЦД-1 на сорбентах інсулін-сефароза та білок G-сефароза
| Сироват-ки крові хворих на ЦД-1 | % зв’язування 125І-Iнс. з БЗІ (метод РІА) | Оцінка позитив-ності | Сорбенти | ОГ фракцій (l=280 нм) | V фракцій (мкл), в ІФА | ОГ фракцій в ІФА | |
| РІА | ІФА | ||||||
| 1. П-ко | 35,7 - 49,0 | + | + | Інсулін-агароза Білок G-сефароза | 0,370 0,085 | 50 50 | 2,819 1,214 |
| 2. С-н | 8,4 – 16,1 | + | + | Інсулін-агароза | 0,085 | 25 | 1,590 |
| 3. Ф-в | 18,0 – 40,3 | + | ± | Інсулін-агароза Білок G-сефароза | 0,270 Н/д | 50 50 | 0,076 0,072 |
| 4. М-я | 79,7 – 80,7 | + | - | Інсулін-агароза | 0,390 | 25 | 0,034 |
| 5. Т-ч | 12,4 – 24,1 | + | - | Інсулін-агароза Білок G-сефароза | 0,970 0,360 | 50 40 | 0,022 0,086 |
| 6. Гр.-й | 1,6 – 5,3 | - | - | Інсулін-агароза Білок G-сефароза | 0,380 0,290 | 15 50 | 0,018 0,029 |
| 7. Б-в | 1,8 – 6,8 | - | - | Інсулін-агароза | 0,135 | 50 | 0,020 |
Примітка: Iнс. – інсулін, + – позитивний зразок; ± – сумнівний зразок; - – негативний зразок за вмістом ІА, визначених даними методами.
Отримані дані можна проаналізувати таким чином. Якщо у разі визначення ІА та ІАА в сироватках крові людей методами РІА та ІФА результати визначення вмісту цих антитіл збігаються (сироватки від хворих П-ко, Гр-й, Б-в, С-н), то після розподілу сироваток крові на зазначених сорбентах та визначенні в них ІА та ІАА цей висновок залишається незмінним. В іншому ж випадку, коли нефракціоновані сироватки, за даними РІА, вважались позитивними (сироватки Т-ч, М-я), а за методом ІФА – негативними, то визначення вмісту ІА та ІАА в окремих фракціях, елюйованих з обох типів сорбентів, дало змогу впевненіше стверджувати про відсутність їх в таких сироватках крові. Так, у фракціях сироваток крові хворих Т-ч та М-я навіть при досить значному вмісті білка, ІА не були виявлені (для порівняння див. дані хроматографії сироватки хворого П-ко).
Заслуговують на увагу також результати хроматографічного розподілу білків сироватки крові хворого С-н. При дослідженні такої нефракціонованої сироватки методом РІА зв’язування її білків з 125І-інсуліном було незначне (8,4-16,1 %), а при дослідженні методом ІФА вона вважалась позитивною. Останнє підтвердилось результатами поетапної хроматографії цієї сироватки крові: при незначній кількості білка в елюаті з інсулін-агарози (ОГ при l = 280 нм становила 0,085) у зразку чітко визначались ІА. Ці результати ще раз підтвердили, що при використанні методу РІА, враховуючи його особливості, існує ймовірність осадити разом з антитілами всі БЗІ, для виділення та дослідження яких слід застосувати спеціальні методичні підходи.
Таким чином, в результаті проведеної роботи з’ясовано, що використовуючи метод поетапної афінної хроматографії на сорбентах з інсуліном і білками А або G з сироваток крові донорів і хворих на ЦД можна виділити і дослідити низку білків, які мають властивість зв’язуватись з інсуліном. Запропонований спосіб може бути використаний для визначення співвідношень білків, що зв’язують інсулін у крові хворих на ЦД; та разом з визначенням ІА та ІАА опрацьованим імуноферментним методом це сприятиме глибшому розумінню можливої природи різних ускладнень, що виникають у хворих на ЦД в процесі лікування препаратами інсуліну.
Висновки
1. Вперше застосовано метод поетапної афінної хроматографії на сорбентах з інсуліном та білком А (або G) і продемонстровано його придатність для відокремлення антитіл до інсуліну від інших білків, що зв’язують інсулін в сироватках крові хворих на ЦД та здорових людей. Показано, що вміст білкових чинників, причетних до зв’язування інсуліну, в сироватках хворих на ЦД в 2,5 – 3 рази вищий, ніж у здорових людей.
2. Вперше в Україні розроблено метод гетерогенного твердофазного імуноферментного аналізу для визначення вмісту антитіл до ендогенного та екзогенного інсулінів у крові людей. Доведено його ефективність для виявлення ІА та ІАА, як в цільній сироватці крові людей, так і у складі білкових фракцій, виділених методом поетапної афінної хроматографії з цих сироваток.
3. Встановлено, що специфічність розробленого імуноферментного методу становить 90,9 %, а чутливість – 82,4 %; внутрішньосерійний коефіцієнт варіації складає 9,09 % для негативних зразків і 3,53 % для позитивних, а міжсерійний – 4,34 % для негативних зразків і 5,5 % для позитивних.
4. На основі розробленого методу створено вітчизняну імуноферментну тест-систему “ІФА-АТ-інс” та показано її придатність для виявлення ІА та ІАА при обстеженні здорових людей та хворих на ЦД.
5. За допомогою розробленої тест-системи проведено визначення антитіл до ендогенного та екзогенного інсулінів в сироватках крові здорових людей, та хворих на ЦД-1 і ЦД-2, які приймали таблетовані цукрознижуючі препарати, ін’єкції інсуліну або його аналогів. Відсоток осіб, у крові яких виявлено ІА або ІАА, у групі хворих на ЦД-1 дорівнював 10,96; у хворих на ЦД-2, лікованих інсуліном – 4,26; хворих на ЦД-2, які не отримували інсулін – 1,92. Серед донорів ІАА виявлено у однієї особи (0,52 % від загальної кількості обстежених).
6. Проведене порівняльне дослідження тест-системи “ІФА-АТ-інс” з імуноферментною комерційною системою “Anti-insulin ORG-520” виробництва фірми “ORGentech” (Німеччина), засвідчило її ефективність при визначенні антитіл до екзогенного (або ендогенного) інсуліну.
Список опублікованих праць за темою дисертації
Статті в наукових спеціалізованих виданнях
1. В.В. Корпачев, С.В. Мельниченко, Р.Г. Лукашова, Н.В. Іванська, Г.Є. Раєвська. Опрацювання методу імунофентного аналізу для визначення антитіл до інсуліну у сироватці крові здорових людей та хворих на цукровий діабет // Ендокринологія, 2003, Т. 8, №1, С.24-30 (Автором самостійно здійснювався аналіз літератури, підбір хворих, експериментальні дослідження (підбір оптимальних умов проведення імуноферментного аналізу), статистична обробка та узагальнення матеріалів, написання статті).
2. В.В. Корпачев, С.В. Мельниченко, П.М. Карабун, Р.Г. Лукашова, Н.В. Іванська. Порівняння розробленої імуноферментної тест-системи (“ІФА-АТ-інс”) з комерційними наборами для виявлення антиінсулінових антитіл у сироватках крові людей // Ендокринологія, 2003, Т. 8, №2, С.158-168 (Автор самостійно здійснювала аналіз літератури, проводила порівняльні дослідження розробленої імуноферментної тест-системи „ІФА-АТ-інс” з комерційними наборами: імуноферментною тест-системою “Anti-insulin ORG-520” та радіоімунною – “Cis biointernational”).
3. В.В. Корпачев, Н.М. Гуріна, С.В. Мельниченко, Р.Г. Лукашова, А.А. Шупрович. Білки, що зв’язують інсулін, та контррецепторні білки сироватки крові хворих на цукровий діабет і здорових людей // Ендокринологія. - 2004.-Т.9.-№2.-С.221-235 (Автором здійснювалось написання фрагменту статті на підставі власних експериментальних досліджень сироваткових чинників, що блокують дію інсуліну (афінна хроматографія, електрофорез в поліакриламідному гелі).
4. В.В. Корпачев, С.В. Мельниченко, Р.Г. Лукашова, П.М. Карабун, Н.В. Іванська. Антигенність інсуліну та методи визначення антитіл до нього в сироватках крові здорових людей та хворих на цукровий діабет // Ендокринологія. - 2005.-Т.10.-№2.-С.206-223 (Автором самостійно здійснювався пошук літератури за темою, експериментальні дослідження (імуноферментне визначення вмісту антитіл), статистична обробка та узагальнення матеріалів, написання статті. ).
Статті в наукових виданнях
1. Р.Г. Лукашова, С.В. Мельниченко. Методы определения антител к инсулину. // В кн. В.В Корпачева: Инсулин и инсулинотерапия.- Киев, РИА «Триумф», 2001.- С.309-322 (Пошук літератури та її аналіз, оформлення).
2. В.В. Корпачев, С.В. Мельниченко, Р.Г. Лукашова, П.М. Карабун, Н.В. Іванська. Дослідження цукрознижувальної та антигенної властивостей Новорапіду – аналога людського інсуліну ультракороткої дії // Клінічна ендокринологія та ендокринна хірургія, 2004, №3 (8), С.46-52 (Автором здійснювались: аналіз літератури, експериментальні дослідження (визначення вмісту антитіл до інсуліну), участь у написанні статті).
3. С.В. Мельниченко, Н.В. Іванська, В.В. Корпачев. Патогенетичне значення антитіл до ендогенного та екзогенного інсулінів // Сімейна медицина. – 2005.- №3.- С.45-47 (Аналіз літератури, написання статті).
Тези доповідей на наукових конференціях і з’їздах
1. С.В. Мельниченко, В.В. Корпачев, Р.Г. Лукашова, О.А. Шевчук, Н.В. Іванська. Розробка методу визначення антитіл до інсуліну в сироватці крові людей на основі твердофазного імуноферментного аналізу // Ендокринологія, 2001, Т.6 (додаток), С. 194.
2. В.В. Корпачев, С.В. Мельниченко, Н.В. Иванская, Г.А. Раевская, Р.Г. Лукашова. Разработка иммуноферментной тест-системы для выявления антител к инсулину в сыворотках крови людей // Материалы I съезда аллергологов Украины, 2002, С. 79.
3. В.В. Корпачев, Н.В. Иванская, С.В. Мельниченко, Р.Г. Лукашова, Г.Е. Раевская. Разработка иммуноферментной тест-системы для выявления антител к инсулину // Укр. біохім. ж., 2002, 74, 4а (додаток 1), С.101-102.
4. С.В. Мельниченко. Розробка тест-системи для визначення антитіл до інсуліну в сироватці крові людей на основі твердофазного імуноферментного аналізу // Ендокринологія, 2002, Т. 7, №1, С.142.
5. В.В. Корпачев, Н.М. Гурина, С.В. Мельниченко. Нарушение толерантности к глюкозе у крыс после введения инсулинсвязывающих белков из сыворотки крови интактных животных // Укр. біохім. журнал.- 2002.- Т.74, №4а (додаток 1).- С.147.
6. С.В. Мельниченко. Выделение и анализ инсулинсвязывающих белков сывороток крови больных сахарным диабетом // Укр. биохим. журнал.- 2006.- Т.2, (спец.выпуск).- С.88.
7. В.В. Корпачев, Н.В. Іванська, Р.Г. Лукашова, С.В. Мельниченко. Розробка та апробація імуноферментної тест-системи для виявлення антитіл до інсуліну // Вісник Вінницького держ. Мед. університету.- 2003.- №1-2.- с.57.
8. В.В. Корпачев, Р.Г. Лукашова, С.В. Мельниченко, П.М. Карабун. Визначення вмісту антитіл до інсуліну та дослідження інших інсулінзв’язуючих білків в сироватці крові хворих на цукровий діабет // Ендокринологія. - 2007.-Т.12 (додаток).-С.122.
Патент
1. В.В. Корпачев, Р.Г. Лукашова, С.В. Мельниченко, О.А. Шевчук, Н.В. Іванська, Г.Є. Раєвська, В.Г.Пилипенко. “Тест-система для виявлення аутоантитіл до ендогенного або антитіл до екзогенного інсулінів в сироватках та плазмі крові людей (ІФА-АТ-інс)” // Деклараційний патент на винахід 57640 А “Тест-система для виявлення аутоантитіл до ендогенного або антитіл до екзогенного інсулінів в сироватках та плазмі крові людей (ІФА-АТ-інс)” 16.06.2003.- бюл. №6.
Анотація
Мельниченко С.В. Виділення та характеристика білкових чинників, що зв’язують інсулін в крові людей, хворих на цукровий діабет. – Рукопис.
Дисертація на здобуття наукового ступеня кандидата біологічних наук за спеціальністю 14. 01. 14 – ендокринологія. – Інститут ендокринології та обміну речовин ім. В.П. Комісаренка АМН України, Київ, 2007 р.
Дисертаційну роботу присвячено дослідженню білкових чинників (БЗІ), які здатні зв’язувати інсулін в крові людей, хворих на цукровий діабет, і визначенню антитіл до ендогенного (ІА) або екзогенного (ІАА) інсулінів у складі цих білків.
Білки, що зв’язують інсулін в сироватках крові людей, виділяли методом афінної хроматографії на сорбенті інсулін-сефароза 4В. Отриманий матеріал в подальшому фракціонували на сорбенті білок G-сефароза 4В, відокремлюючи при цьому ІА та ІАА від інших білків, що блокують дію інсуліну. Всі отримані білкові фракції досліджували методом електрофорезу в поліакриламідному гелі. Вміст ІА та ІАА, як в нативних сироватках, так і в отриманих фракціях, визначали розробленим гетерогенним твердофазним імуноферментним методом. В результаті проведення поетапної афінної хроматографії сироваток крові хворих на ЦД та донорів показано, що кількість білкових фракцій в елюатах (як від донорських сироваток, так і від хворих на ЦД) коливається від 8 до 10. Співвідношення білків в окремих зразках різні, але кількість фракцій не залежить від того, з яких сироваток – від здорових людей чи від хворих на ЦД – виділено ці білки.
На основі опрацьованого гетерогенного твердофазного імуноферментного методу визначення ІА та ІАА створено тест-систему “ІФА-АТ-інс”. Проведено порівняльне дослідження тест-системи “ІФА-АТ-інс” з імуноферментною комерційною системою “Anti-insulin ORG-520” виробництва фірми “ORGentech” (Німеччина) засвідчило її ефективність при виявленні антитіл до екзогенного (або ендогенного) інсуліну як у нативних сироватках, так і в складі білкових фракцій, виділених методом поетапної афінної хроматографії з сироваток крові людей. Використання методу поетапної афінної хроматографії і дослідження вмісту ІА та ІАА в отриманих елюатах дозволило пояснити розбіжності в результатах визначення цих антитіл методами імуноферментного та радіоімунного (РІА) аналізів. Причиною такого явища може бути те, що в РІА, для вилучення комплексів 125І-інсуліну з ІА або ІАА використовують поліетиленгліколь. Останній, крім антитіл до інсуліну, здатен осаджувати також й інші БЗІ і тим самим, призводити до завищення результатів визначення ІА та ІАА.
Ключові слова: цукровий діабет, інсулін, антитіла до інсуліну; білки, що зв’язують інсулін, імуноферментний аналіз.
Аннотация
Мельниченко С.В. Выделение и характеристика белковых факторов, связывающих инсулин в крови людей, больных сахарным диабетом. – Рукопись.
Диссертация на соискание ученой степени кандидата биологических наук по специальности 14. 01. 14 – эндокринология. – Институт эндокринологии и обмена веществ им. В.П. Комиссаренко АМН Украины, Киев, 2007 г.
Диссертационная работа посвящена выделению и исследованию белков, связывающих инсулин в крови больных сахарным диабетом и доноров, а также определению содержания антител к эндогенному (ИА) или экзогенному (ИАА) инсулину, входящих в состав этих белков.
Одной из причин снижения эффективности инсулинотерапии при лечении больных сахарным диабетом (СД) может быть блокирование связывания инсулина с его рецептором веществами, имеющими сродство к инсулину. Наиболее известны среди них ИА и ИАА. Роль других факторов, участвующих в этом процессе, изучена недостаточно. В работе предложен методический подход, обеспечивающий извлечение из сывороток крови людей различных фракций инсулинсвязывающих белков и анализ этих белков.
Исследуемые белки выделяли методом поэтапной аффинной хроматографии сывороток крови на сорбенте, содержащем инсулин-сефарозу 4В, с последующим фракционированием полученного материала на сорбенте белок G-сефарозе 4В. Применение последнего направлено на отделение ИА и ИАА от других белков, блокирующих действие инсулина в крови людей. Все выделенные белковые фракции исследовали методом электрофореза в полиакриламидном геле. Содержание ИА и ИАА как в полученных фракциях, так и в цельных сыворотках, определяли разработанным методом гетерогенного твердофазного иммуноферментного анализа. Показано, что количество белковых фракций в элюатах полученных с инсулинового сорбента колеблется (8-10) и, что существует разница в количественном соотношении белков в отдельных образцах.
На основе разработанного иммуноферментного метода определения ИА и ИАА создана тест-система “ИФА-АТ-инс”. Сравнение ее с иммуноферментной коммерческой тест-системой “Anti-insulin ORG-520” производства фирмы “ORGentech” (Германия) показало ее эффективность.
Использование метода поэтапной аффинной хроматографии и определения содержания ИА и ИАА в полученных элюатах позволило объяснить несоответствия при определении содержания антител к инсулину в отдельных сыворотках крови больных СД при исследовании их методами иммуноферментного и радиоиммунного анализов. Причиной этого, может быть то, что в радиоимунных наборах, для извлечения комплексов 125І-инсулина с ИА и ИАА используют полиэтиленгликоль. Последний, кроме антител к инсулину, способен осаждать также и другие инсулинсвязывающие белки и тем самым, приводить к завышению результатов определения ИА и ИАА.
Тест-система “ИФА-АТ-инс” использована для определения содержания ИА и ИАА в сыворотках крови 438 больных СД типа 1 (СД-1), 188 больных СД типа 2 (СД-2), леченных инсулином, 104 больных СД-2, не получавших инсулин, и 194 доноров. В группе больных СД-1 ИА и ИАА выявлены у 10,96 % лиц; среди больных СД-2, леченных инсулином – 4,26 %; у больных СД-2, не получавших инсулин – 1,92 %. В группе доноров ИАА выявлены у одного человека (0,52 % от общего количества обследованных). Кроме того, тест-систему “ИФА-АТ-инс” использовали для обследования 110 детей в возрасте от 5 до 18 лет. Среди них 35 детей входили в группу риска заболевания СД-1 (СД у них болели ближайшие родственники), 30 детей болели СД-1 и 65 здоровых детей, соответствующего возраста. ИАА выявлены у 5,71 % детей, входящих в группу риска, ИА – у 16,67 % детей, болеющих СД-1. У здоровых детей ИАА не выявлены.
Ключевые слова: сахарный диабет, инсулин, антитела к инсулину, инсулинсвязывающие белки, иммуноферментный анализ.
Summary
Melnychenko S. V. – Isolation and characterization of insulin-binding protein factors in blood of diabetic patients. – Manuscript.
The thesis for scientific degree of the Candidate of Biological Sciences in specialty 14.01.14 - endocrinology. - V.Р. Komisarenko Institute of Endocrinology and Metabolism, Academy of Medical Sciences of Ukraine, Kyiv, Ukraine, 2007.
The thesis deals devoted to studying of serum factors participating in insulin binding process in blood of diabetic patients as well as the investigating of antibody levels against endogenous (IA) and exogenous (IAA) insulin which is present among these factors.
Insulin-binding proteins (IBP) of human blood serum were obtained by using an affine chromatography approach. Sepharose 4B-insulin was used as a sorbent. Preparations from this sorbent were then fractioned on protein G-Sepharose sorbent which permitted to separate the IAA from other insulin-blocking proteins. Both IAA levels as native serum as obtained fractions were evaluated by a heterogenic solid-phase enzyme-linked immunoassay approach (ELISA) elaborated by the author. The results of step-by-step chromatography of blood serum from diabetic patients and donors showed that the quantity of fractions in both groups was the same (8-10), but ratios of insulin-binding components in these fractions were different in these preparations.
A new ELISA-based IAA-evaluating test-system – “IFA-AT-ins” – was elaborated. The author performed a comparative study of the “IFA-AT-ins” and a popular commercial test-kit “Anti-insulin ORG-520” (ORGentech, Germany). The results obtained without any doubt that demonstrate the “IFA-AT-ins” has a high effectiveness for estimation of both IA and IAA levels in native human serum as well as in protein fractions isolated by using the step-by-step chromatography. The last approach permitted to explain the absence of concordance in blood serum samples of patients with diabetes IA and IAA levels estimation of some in following study of the same samples using the ELISA and radioimmune assay.
Key words: diabetes mellitus, insulin, insulin-binding proteins, insulin antibodies, insulin autoantibodies, ELISA, radioimmune assay.
Перелік умовних позначень
| БЗІ | білки, що зв’язують інсулін; |
| ГЗ | граничне значення в системі; |
| ІА | антитіла до екзогенного інсуліну; |
| ІАА | антитіла до ендогенного інсуліну; |
| Iнс. | інсулін; |
| ІФА | імуноферментний аналіз; |
| КВ | коефіцієнт варіації. |
| МКА | моноклональні антитіла; |
| ОГ | оптична густина; |
| ОФД | о-фенілендіамін; |
| ПААГ | поліакриламідний гель; |
| ПКА | поліклональні антитіла; |
| РІА | радіоімунний аналіз; |
| ТМБ | 3,3’,5,5’-тетраметилбензидин; |
| ЦД | цукровий діабет; |
| ЦД-1 | цукровий діабет 1-го типу; |
| ЦД-2 | цукровий діабет 2-го типу; |
Похожие работы
... виявляється в середині або в кінці першої доби після початку захворювання Таблиця 1. Диференціально-діагностична таблиця для розпізнавання основних форм судинних захворювань головного мозку Симптом Крововилив у головний мозок Ішемічний інфаркт мозку Тромбоз мозкових судин Емболія мозкових судин Вік хворого Середній, ...
... болю і знеболення, регуляції поведінки й вегетативних інтегративних процесів. На функцію ендокринних залоз через гіпоталамус впливають різні структури ЦНС. Так, центральна регуляція гіпоталамо-гіпофізарної системи здійснюється центрами, які локалізуються в преоптичній ділянці, лімбічній системі, у нейронах стовбура головного мозку ( довгастому, середньому і мосту ), аж до кори великого мозку. В ...
... чного впливу по розвитку дотикового сприйняття досягається значна компенсація втраченої зорової функції у сліпої дитини [8]. Діти з особливими потребами мають відхилення від нормального фізичного чи психічного розвитку, зумовлені вродженими чи набутими вадами. 3. Сутність поняття діти з відхиленнями у стані здоров’я У практиці фізичного виховання здорових дітей корекційні завдання відносять ...
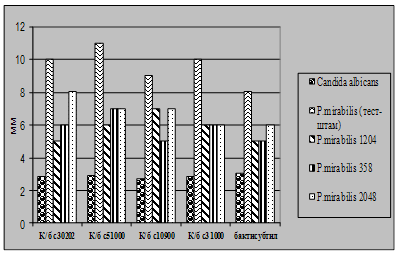
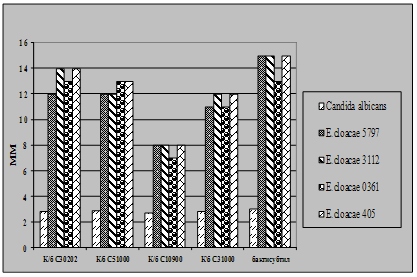
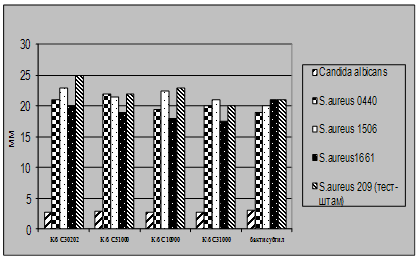
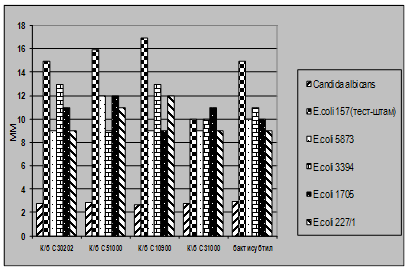
... і декстрин. Температурний оптимум росту 30°С, оптимум рН 7 –9,5 Виробничий штам повинен володіти антагоністичною активністю по відношеню до патогенних та УПМ, які використовуються при контролі пробіотиків. 3.2 Дослідження антагоністичної активності пробіотичних штамів по відношенню до стандартних тест-штамів та клінічних ізолятів Пробіотики відіграють позитивну роль у підвищенні загальної ...
0 комментариев