Навигация
Программа и тематическое планирование уроков химии в 10 классе (базовый уровень)
2.1 Программа и тематическое планирование уроков химии в 10 классе (базовый уровень)
Для реализации данной программы используется учебник «Химия 10» авторов О.С. Габриеляна, Ф.Н. Москаева, С.Ю. Пономарёва, В.И. Теренина. – М.: Дрофа, 2000 [35]. Рассматриваемая программа создана на основе стандарта среднего (полного) общего образования для общеобразовательных школ. Планирование является примерным и может быть скорректировано учителем в конкретных условиях. Планирование курса химии 10 класс составлено из расчёта 2 часа в неделю, всего 64 часа.
| № урока | Раздел | Тема урока | Количество Часов |
| 1 | Введение в органическую химию. | Введение. Особенности органической химии. | 1 |
| 2 | Классификация органических соединений. | 1 | |
| 3 | Химическая связь в органических соединениях (Образование связи). | 1 | |
| 4 | Химическая связь в органических соединениях (Геометрия молекулы). | 2 | |
| 5 | Теория строения органических соединений. | 1 | |
| 6 | Предельные углеводороды. | Строение алканов. | 1 |
| 7 | Физические и химические свойства алканов. | 1 | |
| 8 | Циклоалканы. Получение алканов и циклоалканов. | 1 | |
| 9 | Непредельные углеводороды. | Строение алкенов. | 1 |
| 10 | Свойства алкенов. | 1 | |
| 11 | Получение алкенов. | 1 | |
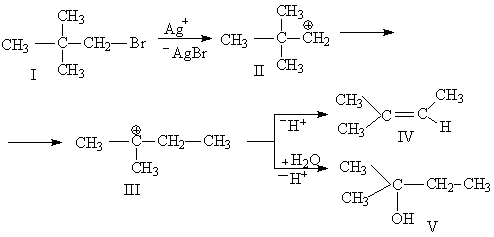
| 12 | Практическое занятие № 1: «Получение дибромэтана». | 1 | |
| 13 | Алкадиены. | 1 | |
| 14 | Алкины. | 1 | |
| 15 | Арены. | 1 | |
| 16 | Газ, нефть, уголь. | Углеводороды в природе. Применение. | 1 |
| 17 | Обобщение и систематизация знаний, умений, навыков по темам 1 – 4. | 1 | |
| 18 | Контрольная работа № 1 по темам 1 – 4. | 1 | |
| 19 | Производные углеводородов. | Введение. | 1 |
| 20 | Галагенопроизводные углеводородов. | 1 | |
| 21 | Нитросоединения. | 1 | |
| 22 | Амины. | 1 | |
| 23 | Спирты, фенолы, простые эфиры, оксиды. | Строение и классификация спиртов. | 1 |
| 24 | Физические свойства спиртов и фенолов. | 1 | |
| 25 | Химические свойства спиртов и фенолов. Получение и применение спиртов. | 2 | |
| 26 | Практическое занятие № 2: «Получение бромэтана из этанола, очистка продукта реакции, определение практического выхода». | 1 | |
| 27 | Простые эфиры и оксиды. | 1 | |
| 28 | Альдегиды и кетоны. | Карбонильные соединения. | 2 |
| 29 | Карбоновые кислоты и сложные эфиры. | Состав, классификация, строение, физические свойства карбоновых кислот. | 1 |
| 30 | Химические свойства карбоновых кислот. Получение и применение карбоновых кислот. | 1 | |
| 31 | Практическое занятие № 3: «Получение карбоновых кислот и изучение их свойств». | 1 | |
| 32 | Мыла. | 1 | |
| 33 | Практическое занятие № 4: «Получение мыла из жира». | 1 | |
| 34 | Практическое занятие № 5: «Гидролиз мыла. Гидролиз ацетилсалициловой кислоты (аспирина), определение выхода салициловой кислоты». | 1 | |
| 35 | Сложные эфиры. | 1 | |
| 36 | Практическое занятие № 6: «Получение этилового эфира уксусной кислоты (этилацетата)». | 1 | |
| 37 | Жиры. | 2 | |
| 38 | Обобщение и систематизация знаний, умений, навыков по темам 5 – 8. | 1 | |
| 39 | Контрольная работа № 2 по темам 5 – 8. | 1 | |
| 40 | Полифункциональные соединеия. | Галагенозамещенные кислоты. | 1 |
| 41 | Оксикислоты. | 1 | |
| 42 | Аминокислоты. | 1 | |
| 43 | Белки. | 1 | |
| 44 | Гетероциклические соединения. | Углеводы. | 1 |
| 45 | Полисахариды. | 1 | |
| 46 | Практическое занятие № 7: «Анализ пищевых продуктов». | 1 | |
| 47 | Азотистые основания. | 1 | |
| 48 | Практическое занятие № 8: «Исследование свойств органических веществ. Доказательства генетических связей между органическими веществами». | 1 | |
| 49 | Обобщение и систематизация знаний, умений, навыков по темам 9, 10. | 1 | |
| 50 | Высокомолекулярные вещества. | Понятие о высокомолекулярных веществах. | 1 |
| 51 | Строение высокомолекулярных веществ. | 1 | |
| 52 | Физические свойства высокомолекулярных веществ. | 1 | |
| 53 | Практическое занятие № 9: «Исследование свойств пластмасс». | 1 | |
| 54 | Практическое занятие № 10: «Исследование свойств синтетических волокон в сравнении с натуральными и искусственными». | 1 | |
| 55 | Практическое занятие № 11: «Распознавание пластмасс и волокон». | 1 | |
| 56 | Срез знаний, умений, навыков учащихся по темам 9, 10, 11. | 1 | |
| 57 | Практическое занятие № 12: «Итоговое практическое занятие по решению экспериментальных задач на получение и распознавание органических веществ». | 1 | |
| 58 | Обобщение и систематизация знаний, умений, навыков по темам по курсу химии 11 класса. | 1 | |
| 59 | Срез знаний, умений, навыков учащихся по курсу химии 11 класса. | 1 | |
| 60 | Подведение итогов. | 1 | |
| Всего | 64 ч. |
2.2 Программа и тематическое планирование уроков химии в 10 классе (профильный уровень)
Рабочая программа по химии 10 класс (профильный уровень) составлена по учебнику Новошинского И.И., Новошинской Н.С. «Органическая химия» Москва, «Русское слово», 2008 г. Допущено Министерством образования и науки РФ 21.02.2005. Всего 105 часов, из них 4 часа резервного времени.
| Раздел | Тема урока | Количество часов |
| 1. Введение в органическую химию. | 1. Предмет органической химии. Особенности органических соединений и реакций | 5 |
| 2. Теория химического строения органических соединений | ||
| 3. Вывод химической формулы вещества по ее относительной плотности и массовым долям химических элементов | ||
| 4. Вывод химической формулы веществ по продуктам сгорания | ||
| 5. Классификация реакций в органической химии. | ||
| 2. Предельные углеводороды. | 6. Электронное и пространственное строение алканов на примере метана. | 11 |
| 7-8. Гомологический ряд, номенклатура и изомерия алканов. Решение задач на нахождение формул вещества по общей формуле алканов. | ||
| 9-10. Свойства алканов. | ||
| 11. Применение алканов | ||
| 12. Получение алканов. | ||
| 13.Практическая работа №1 «Изучение качественного состава органических веществ» | ||
| 14-15. Решение задач по теме «Алканы» | ||
| 16. Обобщение знаний учащихся по темам1и2. Контроль знаний учащихся. | ||
| 3. Непредельные углеводороды. | 17. Электронное строение молекулы этилена. | 14 |
| 18. Алкены. Гомологический ряд, номенклатура и изомерия. | ||
| 19. Получение и физические свойства алкенов. | ||
| 20. Химические свойства алкенов, применение (реакции присоединения. | ||
| 21. Химические свойства алкенов, применение (реакции окисления и полимеризации) | ||
| 22. Полимеры. Реакция полимеризации. Термопластичные пластмассы. | ||
| 23.Алкадиены | ||
| 24. Натуральный и синтетический каучук. | ||
| 25. Электронное строение молекулы ацетилена. | ||
| 26. Алкины. Гомологический ряд, номенклатура, изомерия. | ||
| 27-28. Свойства, применение, получение алкинов. | ||
| 29. Решение расчетных задач по теме «непредельные углеводороды» | ||
| 30. Обобщение знаний учащихся по теме «Непредельные углеводороды». Контроль знаний учащихся. | ||
| 4. Циклические углеводороды. Природные источники углеводородов.(8ч) | 31. Циклоалканы.. | 8 |
| 32. Ароматические углеводороды. Строение молекулы бензола. Химические свойства и применение бензола. | ||
| 33. Химические свойства, получение и применение гомологов бензола на примере толуола. | ||
| 34. Генетическая взаимосвязь углеводородов. Решение расчетных задач по теме «Циклические углеводороды» | ||
| 35. Обобщение и систематизация знаний по теме углеводороды. | ||
| 36. Контрольная работа по разделу «Углеводороды» | ||
| 37-38. Природные источники углеводородов. | ||
| 5. Галогенопроизводные углеводородов. | 39. Строение галогенопроизводных углеводородов. | 3 |
| 40. Химические свойства, получение и применение галогенопроизводных. | ||
| 41. Генетическая связь между классами органических веществ. | ||
| 6. Спирты. Фенолы. (9ч) | 42. Предельные одноатомные спирты. Гомологический ряд, номенклатура и свойства. | 9 |
| 43. Химические свойства предельных одноатомных спиртов. | ||
| 44. Получение и применение предельных одноатомных спиртов. | ||
| 45-46. Многоатомные спирты. | ||
| 47. Фенолы. | ||
| 48. Генетическая связь между органическими веществами. | ||
| 49. Практическая работа №2 «Спирты». | ||
| 50. Обобщение знаний по теме. Контроль знаний учащихся. | ||
| 7. Карбонильные соединения. | 51. Альдегиды и кетоны. Состав, номенклатура, изомерия. | 5 |
| 52-53. Физические и химические свойства карбонильных соединений. Реакции поликонденсации. Получение фенолформальдегидной смолы. | ||
| 54.Получение и применение карбонильных соединений. | ||
| 55. Расчетные задачи по материалам темы. | ||
| 8. Карбоновые кислоты и их производные. | 56. Карбоновые кислоты. Состав, номенклатура, классификация. | 6 |
| 57. Физические и химические свойства карбоновых кислот. | ||
| 58. Особенности строения и свойств муравьиной кислоты. | ||
| 59. Получение и применение карбоновых кислот. | ||
| 60. Практическая работа №3. Изучение свойств карбоновых кислот. | ||
| 9. Эфиры. | 61. Простые эфиры. Сложные эфиры. | 8
|
| 62-63. Жиры. | ||
| 64. Мыла и синтетические моющие средства. | ||
| 65. Практическая работа №4 «Решение экспериментальных задач» | ||
| 66. Решение задач по материалам темы. | ||
| 67. Обобщение знаний по теме. | ||
| 68.Контрольно-обобщающий урок по разделу «Функциональные производные углеводородов» | ||
| 10. Азотсодержащие соединения. | 69. Нитросоединения. | 5 |
| 70. Амины. Номенклатура, получение, физические и химические свойства. |
| |
| 71. Анилин. |
| |
| 72. Сравнительная характеристика органических и неорганических оснований. |
| |
| 73. Решение задач по материалам темы. |
| |
| 11. Аминокислоты. Белки. (5ч) | 74.Аминокислоты. | 5 |
| 75. Химические свойства аминокислот. | ||
| 77. Белки. Структура белковой молекулы. Синтез белков. | ||
| 78. Белки. Физические и химические свойства. | ||
| 79. Роль белков в живых организмах. | ||
| 12. Углеводы. | 80-81.Моносахариды. Состав, строение молекулы. Свойства и применение глюкозы. | 8 |
| 82. Биологическая роль глюкозы. Фруктоза, рибоза, дезоксирибоза. | ||
| 83. Дисахариды. Сахароза, ее состав, свойства, нахождение в природе и применение | ||
| 84. Полисахариды. Крахмал и целлюлоза как природные полимеры. | ||
| 85. Искусственные и синтетические волокна. | ||
| 86. Практическая работа №5 «Углеводы». | ||
| 87. Практическая работа №6 «Решение экспериментальных задач» | ||
| 13. Азотсодержащие гетероциклические соединения. | 88.Пиррол. | 3 |
| 89. Пиридин. | ||
| 90.Нуклеиновые кислоты. | ||
| 14. Биологически активные вещества. | 91. Ферменты. | 4 |
| 92. Витамины. | ||
| 93. Гормоны. | ||
| 94. Лекарственные препараты. | ||
| 15. Обобщение знаний по курсу органическая химия. | 95. Электронное строение органических веществ. | 7 |
| 96. Изомерия и номенклатура органических соединений | ||
| 97.Классификация органических соединений. | ||
| 98. Высокомолекулярные соединения. | ||
| 99.Генетическая связь между классами органических соединений. | ||
| 100. Решение расчетных задач разных типов по органической химии | ||
| 101. Контрольная работа за курс органической химии. | ||
| Резерв: 4 часов. Всего 105 ч. | ||
Глава 3. Экспериментальная часть
3.1 Методические разработки
Урок 1. Урок – игра «Русское лото»
Условия игры: в игре участвуют пять команд. Каждая команда получает карточку, в которой указаны номера десяти вопросов. Учитель или ведущий игры достает из мешка бочонок с номерами. Команда, у которой в карточке есть этот номер, получает право на ответ. Если ответ верный, то команда получает бочонок и ставит его на соответствующий номер в карточке. Если команда не смогла правильно ответить на вопрос, то бочонок остается у ведущего и право ответа получает другая команда, которая получает за правильный ответ жетон. За этот жетон можно выкупить тот бочонок, который был вынут из мешка, но остался у ведущего. Побеждает та команда, которая первой поставит бочонки на все номера карточки. Эту игру можно проводить на уроках обобщающего повторения или по всему курсу.
Урок – игра «Аукцион».
На торги выносятся задания по какой-либо теме, причем учитель заранее договаривается с ребятами о теме игры. В игре участвуют 3 – 5 команд. С помощью кодоскопа на экран проецируется лот № 1 – пять заданий на данную тему (можно задания заранее написать на доске, на плакате, или использовать готовые, распечатанные тексты) Первая команда выбирает задание и назначает ему цену от 1 до 5 баллов. Если цена этой команды выше тех, что дают другие, она получает задание и выполняет его. Остальные задания должны купить другие команды, Если задание решено верно, команде начисляются баллы (или часть их) снимаются. Достоинства этой простой игры в том, что при выборе задачи учащиеся сравнивают все пять задач и мысленно прокручивают ход их решения.
Урок – игра «Лабиринт».
( смотр знаний по теме, разделу, и т. д.)
Класс разбивается на 3 – 5 команд, причем каждая команда создается из ребят разных способностей, чтобы команды были равные по силам. В классе расставлены столы, количество которых зависит от количества выбранных тем. На столах лежат номера столов, задания для каждого игрока по разным темам, причем задания 3-х уровневые по способностям учащихся, задания в конверте пронумерованы и каждый ученик знает свой номер задания. (Можно делать задания делать задания по 3-х уровневым тестам, разложить распечатанные тесты на столах и заранее объявить учащимся задания какого уровня он решает).
Ребята тянут жребий, кто с какого стола, по какой теме начинает работать, в каком порядке. За каждым столом сидит эксперт (им может быть сильный ученик данного класса или старшеклассник, который проверяет правильность решения задачи.) Контрольная карта с решением задач должна быть у каждого эксперта за каждым столом начисляет количество баллов за каждую решенную задачу в индивидуальные карточки каждому ученику, ставя свою роспись и баллы в фонд команды, ставя их в карточку команды.
Побеждает команда, набравшая большее количество баллов и каждому ученику выставляется средняя оценка в журнал по их индивидуальным карточкам.
Урок 2. Урок-игра «Брейн-ринг» (X класс)
Место урока в учебном плане. Эту игру можно провести на заключительном уроке по теме «Спирты» в X классе, когда учащимися усвоены основные понятия данной темы. Цели урока: повторить пройденный материал органической химии и систематизировать основные теоретические положения темы, повысить интерес школьников к курсу химии.
Оборудование: эмблемы команд и жюри, набор вопросов, плакаты с заданием, секундомер, карандаши, бумага, игрушки-пищалки, гонг, призы игрокам.
Подготовительный этап. Класс заранее делится на три группы. Командам дается домашнее задание: подготовить эмблему своей команды, сделать заготовку итоговой таблицы.
Ход игры
Ведущий зачитывает вопрос игры, и, для того чтобы ответить на него, у каждой команды есть 1 минута. Та команда, у которой готов ответ, подает сигнал и с разрешения ведущего отвечает. Если ответ, данный командой, неверен, а минута не закончилась, у остальных двух команд есть возможность продолжить обсуждение и попробовать ответить правильно. Если верный ответ так и не будет дан ни одной из команд, вопрос снимается. Каждый ответ приносит команде 1 балл.
Вопросы игры
1. Карболовая кислота. (Фенол)
2. Трехатомный спирт. (Глицерин)
3. Шестиатомный спирт, продукт восстановления глюкозы. (Сорбит)
4. Чем обусловлена хорошая растворимость в воде первых членов гомологического ряда спиртов? (Образованием межмолекулярой водородной связи)
5. Сложные эфиры глицерина и жирных карбоновых кислот. (Жиры)
6. Спирт, который получается гидратацией пропилена. (Пропанол-2)
7. Твердые вещества, которые образуются при действии на спирты щелочных металлов и других активных металлов. (Алкоголяты)
8. Вещества, которые образуются при межмолекулярной дегидратации спиртов при t > 140 °С. (Простые эфиры)
9. Этот спирт называют древесным спиртом. (Метанол)
10. Диол с двумя атомами углерода. (Этиленгликоль)
11. Вещества, которые образуются при окислении вторичных спиртов. (Кетоны)
12. Реакция образования сложных эфиров в результате взаимодействия спиртов с кислотами. (Этерификация)
13. Правило, в соответствии с которым происходит образование спиртов из алкенов. (Правило Марковникова)
14. Общее название одноатомных спиртов. (Алкоголи, алканолы)
15. Особый вид связи, возникающий за счет атома водорода функциональной группы –ОН и электроотрицательного атома в спиртах. (Водородная связь)
16. Сравнительно высокая температура кипения спиртов объясняется… (...ассоциацией молекул)
17. Какое соединение получается при дегидратации бутанола-2? (Бутен-2)
18. Расположите спирты в ряд по увеличению их способности вступать в реакцию этерификации с уксусной кислотой: этиловый, изопропиловый, 2-метилбутанол-2.
19. Расположите спирты в порядке уменьшения их кислотности: этанол, метанол, бутанол. (Метанол, этанол, бутанол)
20. Расположите спирты в порядке увеличения кислотности: метанол, глицерин, третичный бутиловый. (Третичный бутиловый, метанол, глицерин)
Подведение итогов.
При разработке урока использована литература [36-38].
Урок 2. Урок–викторина «Счастливый случай»
Место урока в учебном плане. Урок-викторину можно провести на заключительном уроке по разделу «Кислородсодержащие органические соединения» в Х классе.
Цель урока: систематизация и обобщение знаний.
Оборудование: лото с бочонками, плакат «Счастливый случай».
Подготовительный этап. Класс делится на две команды (например, команда мальчиков и команда девочек). Каждая команда получает задание: придумать название команды, выбрать капитана, подготовить эмблему и вопросы команде-противнику.
Викторина проводится по аналогии с одноименной телевизионной игрой.
Гейм 1. «Дальше, дальше…»
В течение двух минут каждой команде задаются вопросы. При оценивании подсчитывается количество правильных ответов.
Примеры вопросов гейма:
1. Простейший альдегид. (Муравьиный)
2. Трехатомный спирт. (Глицерин)
3. Тип гибридизации углеродного атома карбонильной группы в альдегидах. (sp2)
4. Спирты, которые образуются при восстановлении альдегидов. (Первичные)
5. Эта реакция используется для очистки альдегидов и кетонов и выделения их из смесей. (Реакция присоединения гидросульфита натрия)
6. Жидкость с резким запахом зеленой листвы, получают из ацетилена по реакции Кучерова. (Уксусный альдегид)
7. Сложные эфиры глицерина и высших карбоновых кислот. (Жиры)
8. Окисление альдегидов аммиачным раствором оксида серебра. (Реакция «серебряного зеркала»).
9. Кислота, которая образуется при окислении масляного альдегида. (Масляная кислота).
10. Функциональная группа альдегидов. (Карбонильная группа).
Гейм 2. «Темная лошадка»
«Темная лошадка» задает три вопроса. На обсуждение каждого вопроса дается 30 секунд, отвечает команда, которая быстрее находит правильный ответ. Если «темная лошадка» считает ответ неверным, отвечает вторая команда, а в случае неправильного ответа второй команды - отвечают зрители.
Гейм 3. «Домашнее лото»
Капитаны команд по очереди вытаскивают из мешочка бочонки с номерами. В мешочке 10 бочонков, бочонок со значком «Счастливый случай» - задание на построение моделей молекул. Команды отвечают на вопросы по соответствующим номерам.
Примеры вопросов гейма:
1. «Счастливый случай»: постройте модель молекулы уксусного альдегида.
2. Вычислите молекулярную массу этилового спирта.
3. Составьте уравнение реакции окисления пропионового альдегида аммиачным раствором оксида серебра.
4. «Счастливый случай»: постройте модель молекулы метилового спирта.
5. Как называют соли уксусной кислоты?
6. Какие изомерные спирты состава СНО можно приготовить гидрированием альдегидов?
7. «Счастливый случай»: постройте модель молекулы этилового спирта.
8. Какие спирты невозможно получить гидрированием альдегидов?
9. Какими органическими веществами можно воспользоваться вместо альдегидов для проведения реакции «серебряного зеркала»?
10. «Счастливый случай»: постройте модель молекулы изопропилового спирта.
Гейм 4. «Ты - мне, я - тебе»
Команды задают по пять вопросов друг другу (вопросы должны быть подготовлены командами заранее).
Гейм 5. «Гонка за лидером»
Ведущий задает вопросы командам в течение определенного времени. Сначала ответы дает проигрывающая команда. За отведенное время команды стремятся дать как больше правильных ответов.
Вопросы для команды 1
1. Жидкость с резким запахом зеленой листвы, получают из ацетилена по реакции Кучерова.
(Ответ: уксусный альдегид. 1 балл)
2. Запах гвоздики обусловлен этим веществом. Оно не реагирует с аммиачным раствором оксида серебра, а при каталитическом гидрировании образует гептанол-2.
(Ответ: гептанон-2. 2 балла)
3. Муравьи для подачи сигнала тревоги выделяют это вещество. Это вещество взаимодействует с синильной кислотой, при каталитическом гидрировании образует 4-метилгексанала-3.
(Ответ: 4-метилгексанон-3. 3 балла)
4. Этот альдегид находится в эвкалиптовом масле и обладает запахом лимона. При взаимодействии с бромом образует 2,3,6,7-тетрабром-3,7-диметилдиметилоктанола-1.
(Ответ: 3,7-диметилоктадиен-2,6-аль-1. 4 балла)
Вопросы для команды 2
1. Эта кислота содержится в выделениях муравьев, в соке крапивы.
(Ответ: муравьиная кислота. 1 балл)
2. Эта кислота входит в виде эфира с глицерином в состав сливочного масла. В промышленном масштабе получают окислением бутилового спирта.
(Ответ: масляная кислота. 2 балла)
3. Эта кислота широко используется в синтезе различных солей, ангидридов, эфиров, красителей, лекарственных и душистых веществ, в пищевой промышленности как консервирующее и вкусовое вещество. В промышленных масштабах ее получают из ацетилена путем его гидратации по реакции Кучерова с последующим окисление альдегида кислородом воздуха.
(Ответ: уксусная кислота. 3 балла)
4. Эта кислота входит в состав облепихового масла, у этой кислоты низкая температура плавления, поэтому на морозе ягоды облепихи остаются мягкими. Эта кислота обесцвечивает бромную воду, при этерификации с глицерином образует жидкий жир.
(Ответ: олеиновая кислота. 4 балла)
Подведение итогов.
При разработке урока использовалась литература [40,41].
Урок 3. Урок-игра «Своя игра»
Эту игру можно проводить на обобщающем уроке в конце учебного года. В ней участвуют по три человека из каждой команды. Правила те же, что и в телевизионной игре. Заранее нужно изготовить два стенда (красный - для красного раунда и синий - для синего раунда) с названиями секторов и числами баллов. Игроки получают таблички, которыми они оповещают о готовности к ответу. Счетная комиссия ведет учет баллов, набранных каждым игроком.
Цели урока: повторить пройденный материал органической химии и систематизировать основные теоретические положения предмета; повысить интерес школьников к курсу химии.
Красный раунд
| Углеводороды | Спирты | Альдегиды | Карбоновые кислоты |
| 1 | 1 | 1 | 1 |
| 2 | 2 | 2 | 2 |
| 3 | 3 | 3 | 3 |
| 4 | 4 | 4 | 4 |
Сектор «Углеводороды»
1. При горении этого углеводорода в кислороде развивается очень высокая температура (около 3000 °С), поэтому он широко применяется для автогенной сварки и резки металлов. Исходным сырьем для его получения являются карбид кальция и метан.
(Ответ: ацетилен. 1 балл)
2. Этот углеводород входит в состав феромона тревоги у муравьев-древоточцев. При крекинге этого углеводорода образуются пентан и пентен.
(Ответ: декан. 2 балла)
3. Этот углеводород образуется при дегидратации бутанола-2.
(Ответ: бутен-2. 3 балла)
4. Бесцветный газ, почти без запаха, горит более ярким пламенем, чем метан, так как содержание углерода в нем больше, чем в метане. Смесь этого углеводорода с воздухом взрывоопасна. Находит применение как исходное вещество для синтеза этиленгликоля и др.
(Ответ: этилен. 4 балла)
Сектор «Спирты»
1. Этот спирт в промышленном масштабе получают гидратацией этилена в кислой среде при температуре 3000 °С и давлении 8 МПа.
(Ответ: этиловый спирт. 1 балл)
2. Это вещество используют пчелы рода Trigona для разметки территории. При каталитическом дегидрировании этого вещества образуется гептанон-2. (Ответ: гептанол-2. 2 балла)
3. Его получают сухой перегонкой отходов древесины. Поэтому его иногда называют древесным спиртом. Токсичен, в малых количествах вызывает слепоту.
(Ответ: метиловый спирт. 3 балла)
4. Пчела, отыскав источник пищи, выделяет этот спирт, привлекающий других рабочих пчел. При бромировании этот спирт образует 2,3,6,7-тетрабром-3,7-диметилоктанола-1.
(Ответ: 3,7-диметилоктадиен-2,6-ол-1. 4 балла)
Сектор «Альдегиды и кетоны»
1. Жидкость с резким запахом зеленой листвы, получают из ацетилена по реакции Кучерова.
(Ответ: уксусный альдегид. 1 балл)
2. Запах гвоздики обусловлен этим веществом. Оно не реагирует с аммиачным раствором оксида серебра, а при каталитическом гидрировании образует гептанол-2.
(Ответ: гептанон-2. 2 балла)
3. Муравьи для подачи сигнала тревоги выделяют это вещество. Это вещество взаимодействует с синильной кислотой, при каталитическом гидрировании образует 4-метилгексанала-3.
(Ответ: 4-метилгексанон-3. 3 балла)
4. Этот альдегид находится в эвкалиптовом масле и обладает запахом лимона. При взаимодействии с бромом образует 2,3,6,7-трибром-3,7-диметилдиметилоктанола-1.
(Ответ: 3,7-диметилоктадиен-2,6-аль-1. 4 балла)
Сектор «Карбоновые кислоты»
1. Эта кислота содержится в выделениях муравьев, в соке крапивы.
(Ответ: муравьиная кислота. 1 балл)
2. Эта кислота входит в виде эфира с глицерином в состав сливочного масла. В промышленном масштабе получают окислением бутилового спирта. (Ответ: масляная кислота. 2 балла)
3. Эта кислота широко используется в синтезе различных солей, ангидридов, эфиров, красителей, лекарственных и душистых веществ, в пищевой промышленности как консервирующее и вкусовое вещество. В промышленных масштабах ее получают из ацетилена путем его гидратации по реакции Кучерова с последующим окисление альдегида кислородом воздуха.
(Ответ: уксусная кислота. 3 балла)
4. Эта кислота входит в состав облепихового масла, у этой кислоты низкая температура плавления, поэтому на морозе ягоды облепихи остаются мягкими. Эта кислота обесцвечивает бромную воду, при этерификации с глицерином образует жидкий жир.
(Ответ: олеиновая кислота. 4 балла)
Синий раунд
| Фенолы | Сложные эфиры | Моносахариды | Полисахариды |
| 1 | 1 | 1 | 1 |
| 2 | 2 | 2 | 2 |
| 3 | 3 | 3 | 3 |
| 4 | 4 | 4 | 4 |
Сектор «Фенолы»
1. Карболовая кислота.
(Ответ: фенол. 1 балл)
2. Какие вещества образуются при взаимодействии фенола со щелочными металлами
(Ответ: феноляты. 2 балла)
3. Взрывчатое вещество, которое образуется при взаимодействии фенола с азотной кислотой.
(Ответ: тринитрофенол. 3 балла).
4. Мыльный раствор смеси изомеров, часто применяемый для дезинфекции в медицине и ветеринарии.
(Ответ: лизол-смесь о-, м-, п-крезолов (метилфенолов). 4 балла)
Сектор «Сложные эфиры»
1. Сложные эфиры глицерина и высших карбоновых кислот.
(Ответ: жиры. 1 балл)
2. Пищевой продукт, получаемый из твердого гидрогенизированного жира.
(Ответ: маргарин. 2 балла).
3. Бесцветная прозрачная жидкость с запахом абрикосов. Получают реакцией этерификации этилового спирта с масляной кислотой.
(Ответ: этиловый эфир масляной кислоты -- этилбутират. 3 балла)
4. Этот сложный эфир обладает запахом слив. При его гидролизе образуются муравьиная кислота и изоамиловый спирт.
(Ответ: изоамилформиат. 4 балла)
Сектор «Моносахариды»
1. Какой из сахаров самый сладкий?
(Ответ: фруктоза. 1 балл).
2. Какой спирт образуется при спиртовом брожении глюкозы.
(Ответ: этиловый. 2 балла)
3. Каким моносахаридом можно воспользоваться вместо альдегидов для проведения реакции серебряного зеркала?
(Ответ: глюкозой, в молекуле которой имеется альдегидная группа. 3 балла)
4. Какой спирт образуется при восстановлении глюкозы?
(Ответ: сорбит. 4 балла)
Сектор «Полисахариды»
1. Этот полисахарид представляет собой белое порошкообразное вещество зернистого строения. С иодом он дает характерное синее окрашивание. (Ответ: крахмал. 1 балл)
2. Этот углевод содержится во всех растительных материалах: в хлопке ее до 95--98 %, в льне и конопле -- до 85 %, в хвойных деревьях -- до 60 % по массе.
(Ответ: целлюлоза. 2 балла)
3. Полисахарид представляет собой волокнистое вещество белого цвета, без вкуса и запаха, растворяется в водно-аммиачном растворе гидроксида меди.
(Ответ: целлюлоза. 3 балла)
4. Уксусная кислота образует с этим веществом сложный эфир, который является ценным продуктом для изготовления кинопленки и ацетатного шелка.
(Ответ: целлюлоза. 4 балла)
Подведение итогов. При разработке урока использовалась литература [42,43].
Похожие работы
... и закрепление знаний учащихся; - умение наблюдать химические явления; - развитие интеллектуальных способностей и формирование абстрактного мышления. [4] 3. Дидактические подходы при изучении темы «Молекулярные перегруппировки» Дидактика – область педагогики, разрабатывающая общую теорию образования и обучения и занимающаяся содержанием образования, закономерностями процесса обучения, ...
... материала и часто примёняются на семинарских, лабораторных занятиях, зачетах, экзаменах. Однако роль вопросов в учебном процессе этим не исчерпывается. Путем задавания вопросов можно организовать активную познавательную деятельность студентов на лекциях, семинарских и других занятиях. При помощи вопросов можно направить познавательную деятельность студентов на определение сходства и различия в ...
... ходом процесса. Через 3 минуты внесите в одну из пробирок раствор хлорида натрия. Что вы наблюдаете? Проведите анализ опытов а) и б). Глава 2. Методика изучения растворов. Теория растворов – одна из ведущих теорий курса химии. Причины важности темы кроется не только в том, что она имеет большое практическое значение, но и прежде всего ...
... и слюноотделения находятся в одном и том же отделе головного мозга. Глава III Практическое применение высоких интеллектуальных технологий 3.1 Исследование эффективности использования интеллектуальных технологий при изучении раздела «Человек» в курсе биологии средней школы Для выявления эффективности разработанной методики на уроках биологии раздела «Человек» на завершающем этапе ...
0 комментариев