Навигация
Хімічні рівняння та їх типи
1.1 Хімічні рівняння та їх типи
Хімічне рівняння – це короткий спосіб опису хімічної реакції. Символи, що позначають речовини, які вступають в реакцію, – знаходяться в лівій частині рівняння, а позначення продуктів реакції – в правій:
![]()
- де в дужках вказаний агрегатний стан, Q – тепловий ефект реакції. Це рівняння описує хімічну реакцію між натрієм і хлором з утворенням хлориду натрію (куховарська сіль). Натрій – метал, бурхливо реагуючий з водою, хлор – отруйний газ, але, з'єднуючись один з одним, ці елементи утворюють цілком нешкідливу речовину, необхідну для життя. Це приклад реакцій приєднання.
Відомі також хімічні реакції:
- заміщення, обміну, розкладання та інші;
- реакції можуть бути оборотні, іонні, окислювально-відновні, ядерні;
- залежно від принципу класифікації реакцій: по формальній ознаці, по механізму реакцій, по термодинамічних або кінетичних параметрах і т.д.
Реакції приєднання X + У ? XY
Приклади:
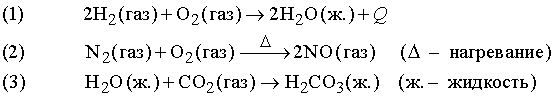
Число атомів даного елемента в лівій частині рівняння рівно числу цих атомів в правій частині, іншими словами, речовина в ході хімічної реакції не виникає з нічого і не знищується. Хімічна реакція, в якій виділяється тепло, наприклад реакція (1), називається екзотермічною, а реакція, яка протікає тільки при підводі тепла ззовні, наприклад реакція (2), – ендотермічної. Майже всі хімічні реакції супроводяться виділенням або поглинанням тепла, але в рівняннях це часто не указують, якщо тільки не розглядаються термодинамічні аспекти процесу.
Реакції заміщення:
![]()
або
![]()
Приклади:
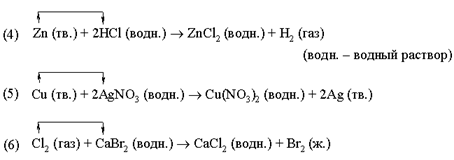
В реакції (4) металевий цинк заміщає водень в соляній кислоті. В реакції (5) мідь заміщає срібло в нітраті срібла. В реакції (6) хлор заміщає бром в броміді кальцію.
Реакції обміну (подвійного заміщення):
XY + UV ? XV + UY
Приклади:
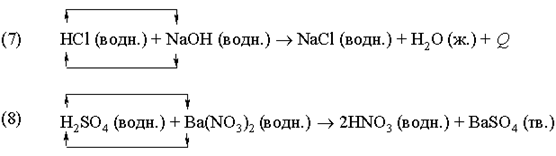
Реакція (7) – типовий приклад кислотно-основної реакції (реакції нейтралізації), продуктами якої є сіль і вода. В реакції (8) в результаті взаємодії іона барія Ba2+, що належить нітрату барія Ba(NO3)2, з сульфат-іоном ![]() сірчаної кислоти утворюється осад сульфату барія BaSO4. В реакціях (7) і (8) реагуючі речовини обмінюються катіонами.
сірчаної кислоти утворюється осад сульфату барія BaSO4. В реакціях (7) і (8) реагуючі речовини обмінюються катіонами.
Реакції розкладання (розщеплювання):
![]()
Приклади:
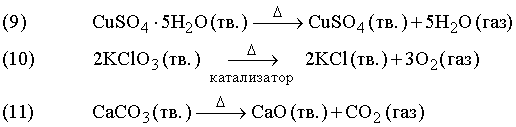
В реакції (9) сині кристали гідратованого сульфату міді розкладаються при нагріванні, при цьому гідратна вода перетворюється на пару. Реакція (10) протікає при відносно невисокій температурі у присутності каталізатора – діоксиду марганцю. Каталізатор прискорює хімічну реакцію, залишаючись при цьому незмінним. Реакція (11) застосовується в промисловості: вапняк (карбонат кальцію CaCO3) при інтенсивному нагріванні розкладається, утворюючи негашене вапно (оксид кальцію CaO) – важливу складову частину цементу.
Оборотні реакції:
![]() або
або ![]()
Стрілки в прямому і зворотному напрямах указують, що продукти реакції взаємодіють з утворенням початкових реагентів, іншими словами, реакція йде в обох напрямах. Систему, в якій протікає оборотна реакція, можна уподібнити двом водоймищам, сполученим вузькою протокою, в яких мешкають два або декілька видів риб. Риби безперешкодно перепливають з одного водоймища в іншій, так що врешті-решт кожне водоймище виявляється заселеним змішаною популяцією постійного складу. Це і є стан рівноваги.
Приклади:
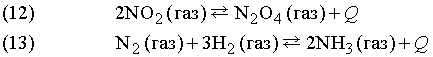
Кількості початкових речовин і продуктів реакції сильно залежать від тиску, температури і концентрації реагуючих речовин.
Іонні реакції. Хімічні рівняння можна записувати з вказівкою заряду початкових речовин і продуктів реакції (+, –, 0 означають позитивний, негативний і нульовий електричні заряди відповідно; їх поміщають вгорі праворуч від символу хімічного елемента).
Члени рівняння в правій і лівій його частинах, відповідаючі групам атомів однакового складу, несучих однаковий заряд, можна скорочувати, як це прийнято в рівняннях алгебри:
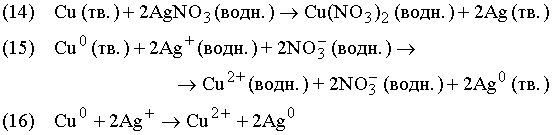
Іон срібла Ag+несе один позитивний заряд; отже, на кожний атом міді, створюючий двохзарядний позитивний іон, повинне доводитися два іони срібла, оскільки суми зарядів в лівій і правій частинах рівнянь повинні бути однаковий. Після скорочення однакових членів в обох частинах рівняння одержуємо рівняння (16), яке виражає хімічні перетворення, що відбулися в реакції. Приведені вище рівняння – це три різні способи представлення однієї і тієї ж хімічної реакції: її молекулярна форма, повна і скорочена іонні форми.
Ядерні реакції. Ядерні реакції можна віднести до хімічних лише вельми умовно, оскільки в них елемент перетворюється на ізотоп того ж елемента або інший елемент. Іноді якась частина речовини в ядерній реакції зникає, і цей процес супроводжується тим, що вивільняється величезної кількості енергії; такі процеси відбуваються при вибуху атомної бомби або в ядерному реакторі. Звичайно в рівняннях ядерних реакцій фігурують нейтрони (![]() ), протони (
), протони (![]() ), електрони (
), електрони (![]() ) ?-частицы (
) ?-частицы (![]() ) ?-лучи (
) ?-лучи (![]() ) і позитрони (
) і позитрони (![]() ). Верхній лівий індекс позначає масу частинки, а нижній лівий – її заряд. Приведемо рівняння типових ядерних реакцій:
). Верхній лівий індекс позначає масу частинки, а нижній лівий – її заряд. Приведемо рівняння типових ядерних реакцій:
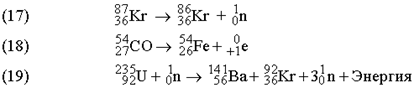
Суми верхніх індексів в лівій і правій частинах рівняння повинні бути однаковими; те ж саме відноситься до нижніх індексів. Може показатися, що маса речовини в ході ядерних реакцій (17)–(19) не змінюється. Насправді ж унаслідок взаємодії елементарних частинок в ядрі і зміни їх маси спокою у продуктів маса може виявитися трохи менше ніж у початкових речовин. Саме із зникненням цієї незначної кількості речовини, яка перетворюється на енергію згідно рівнянню Ейнштейна Е = mc2, і зв'язана руйнівна сила ядерного вибуху. Протікаюча при цьому реакція описується рівнянням (19). В рівнянні (17) ![]() ((криптон ) випускає нейтрон з утворенням ізотопу з тим же атомним номером (36), але масою, меншою на одиницю.
((криптон ) випускає нейтрон з утворенням ізотопу з тим же атомним номером (36), але масою, меншою на одиницю.
Окислювально-відновні реакції. В ході окислювально-відновної реакції міняється заряд елементів (їх ступінь окислення), що і враховується при написанні рівняння. Втрата електрона називається окисленням, а придбання – відновленням.
Число відданих і набутих в ході реакції електронів повинне бути однаковим, і виходячи з цього встановлюються співвідношення між всіма учасниками реакції.
Розглянемо реакцію:

Наведемо складніший приклад – окислювально-відновну реакцію між міддю і концентрованою азотною кислотою:
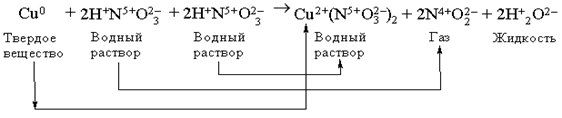
В ході цієї реакції Сu0 втрачає 2 електрони, перетворюючись на іон Сu2+, а N5+ приймає 1 електрон, перетворюючись в N4+. Щоб зрівняти число відданих електронів з числом придбаних, вводимо коефіцієнт 2 перед NO2 в правій частині, а щоб число атомів азоту при цьому залишилося колишнім, умножаємо HNO3 в лівій частині на 2. Cu(NO3)2 в правій частині містить два іони ступінь окислення N в яких рівний +5. Щоб зберегти число іонів в лівій частині з тим же ступенем окислення, додаємо в лівій частині 2 молекули HNO3. Далі, щоб зрівняти 4H+, що містяться в молекулах HNO3, записуємо в правій частині 2H2O. В лівій частині маємо 3?4 = 12 іонів кисню, що містяться в кислоті. Ці 12 іонів кисню присутні і в правій частині: 2 у воді, 4 в NO2 і 6 в нітраті міді Cu(NO3)2. Аналогічним чином можна записувати будь-кого, складніші рівняння.
Застосування. Хімічні рівняння використовуються хіміками-технологами при розрахунку характеристик виробничих процесів. Так, з їх допомогою визначається кількість реагентів (сировини), необхідне для отримання даної кількості продукту.
Похожие работы
... розрахункових задач слід використовувати аналітико-синтетичний шлях, тобто той шлях, який використовують самі учні. Спираючись на дані аналізу методичної літератури, свої спостереження за учнями процес розв’язування розрахункових задач ми представили як ряд взаємних етапів. Перший етап: уважно прочитати текст задачі. Якщо текст задачі сформульований автором задачника не зовсім зрозумілий, можна ...
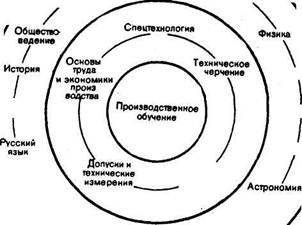
... дування відкритих уроків, спільного планування уроків і т. д. Вчитель географії з врахуванням загально шкільного плану навчально – методичної роботи розробляє індивідуальний план реалізації міжпредметних зв’язків в курсах географії. Методика творчої роботи вчителя включає ряд етапів: 1. Вивчення опорних тем і підручників інших предметів, читання додаткової наукової, науково – популярної і ...
... прийоми їх реалізації на уроках - один з аспектів загальної проблеми удосконалювання методів навчання в сучасній школі [23, 27, 28]. 3.2. Методика впровадження міжпредметних зв’язків при підготовці трактористів-машиністів Для здійснення міжпредметних зв’язків на практичних заняттях необхідно в умови задач включати конкретні чисельні данні про параметри та характеристики технічних об’єктів, ...
... . Лише за наявності відповідної математичної підготовки слід вимагати від учнів запис та формулювання законв заломлення світла. У новій програмі з фізики для 12 – річної школи багато уваги приділено розв’язуванню фізичних задач. Так, підкреслено , що задачі потрібно ефективно використовувати на всіх етапах засвоєння фізичного знання : для розвитку інтересу, творчіх здібностей і мотивації учнів ...


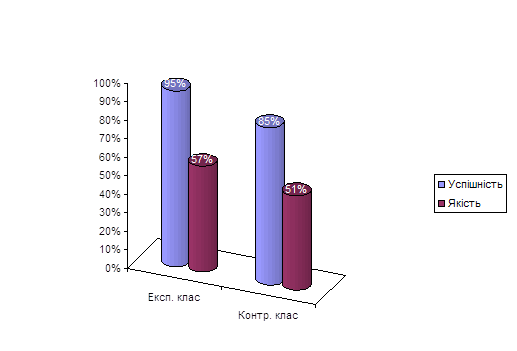
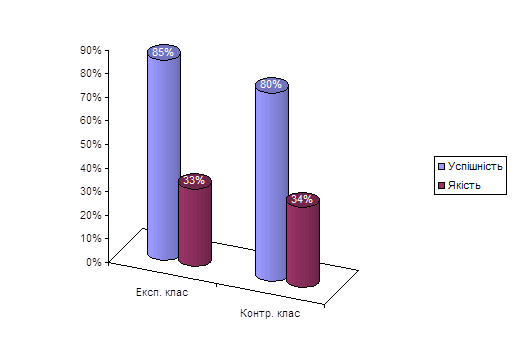
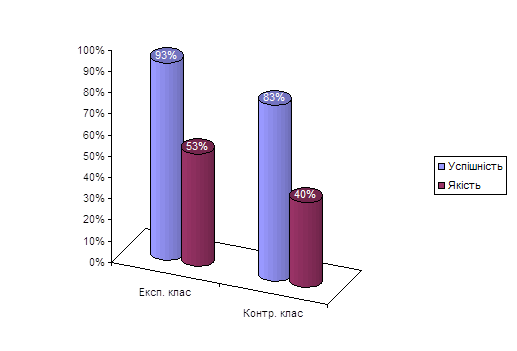
0 комментариев