Навигация
Математичні методи в аналітичній хімії
1.2 Математичні методи в аналітичній хімії
Хімія аналітична, – це наука про методи визначення хімічного складу речовин. Рішення аналітичних задач включає декілька стадій:
Постановка задачі. Ця неістотна на перший погляд стадія насправді дуже важлива. Припустимо, потрібно визначити кількість ртуті у водоймищі. А що саме мається на увазі під словом «ртуть»? Це може бути вся ртуть, незалежно від конкретної хімічної форми, або всі органічні сполуки ртуті (наприклад, диметилртуть), або всі її неорганічні з'єднання, або вся ртуть певною мірою окислення, або ідентифікація всіх ртутних з'єднань і визначення їх кількості. Аналогічним чином йде справа і з «водоймищем». Чи слід обмежити визначення розчиненою ртуттю або розглянути зважені у воді тверді частинки, мул на дні водоймища, що мешкають у воді тварин і рослини? Потрібно врахувати і тривалість аналізу: чи достатньо одиничне визначення, або буде потрібно розрахувати середню величину з результатів декількох вимірювань, зроблених протягом одного дня, а може бути, і цілого року. Відповіді на ці питання визначать характер всього аналізу.
Вибір методу. Метод аналізу вибирають виходячи з поставленої задачі, розмірів об'єкту і зразка, змісту визначуваних речовин, наявності домішок, необхідної точності результатів і наявного устаткування; враховують також можливу тривалість і вартість аналізу. Розглянемо, наприклад, два випадки визначення свинцю. В першому – за наслідками аналізу встановлюють вартість переробки руди, яка залежить від змісту свинцю. Є великий зразок, концентрація свинцю в ньому висока, відповідь необхідна точний. В другому випадку потрібно визначити, чи забруднений свинцем метал, з якого виготовлена старовинна монета. Зміст свинцю низький, потрібна лише приблизна його оцінка, в ході аналізу сама монета не повинна постраждати. Зрозуміло, що ці випадки вимагають різного підходу. Для аналізу зразка руди можна застосувати такі методи, як гравіметрія або титрування. Для монети буде потрібно іншій, щадний (неруйнуючий) метод, наприклад флуоресценція в рентгенівському промінні.
Відбір зразка. Для різних аналітичних методів потрібні, звичайно, і різні по величині зразки – в кількості від нанограмів (1 нг = 10–9 г) до декількох грамів. Навряд чи можливо цілком проаналізувати об'єкт, який важить набагато більше, ніж вимагає вибрана для аналізу методика. В цих випадках відбирають зразок, або пробу, речовини. Ця проба повинна бути репрезентативною, тобто адекватної всьому об'єкту або тій його частині, яка представляє найбільший інтерес. В приведеному вище прикладі з ртуттю у водоймищі постановка задачі визначає і спосіб відбору проби.
Підготовка зразка до аналізу. Якщо кількісні вимірювання проводять в розчині, зразок розчиняють у відповідному розчиннику; при цьому концентрацію зразка підбирають так, щоб вона знаходилася в межах застосовності методу. Іноді доводиться виділяти визначувану речовину з суміші, оскільки багато методів аналізу неспецифічні і навіть неселективні. Специфічним називають метод, за допомогою якого визначається тільки конкретна речовина, а селективним – переважний для даної речовини метод, користуючись яким можна визначати і інші речовини. Специфічних методів дуже мало, селективних – значно більше. Наприклад, високо-селективні мас-спектрометрія і імунологічний аналіз.
Вимірювання. Щоб визначити кількість аналізованої речовини або його склад, виміряють яку-небудь його фізичну величину: кількість речовини, витраченої або утворилося в результаті хімічної реакції; швидкість реакції; інтенсивність поглинання, випуски або розсіяння світла; струм, що виникає в ході окислювально-відновних процесів; кількість тепла, що виділилося або поглиненого, і т.д. Знаючи зв'язок між результатами вимірювань і тими величинами, які цікавлять дослідника, а також порівнявши ці результати з відповідними стандартами, встановлюють кількість визначуваної речовини або його склад.
Інтерпретація результатів. Коли результати вже отримані, може виникнути ряд питань: чи вирішена поставлена задача? як проводити подальші дослідження? Не виключено, що для отримання більш точних результатів потрібно удосконалити методику аналізу.
Робочі криві. Робоча крива – це графічна залежність, що зв'язує концентрацію визначуваної речовини з тим параметром, який вимірюється в ході аналізу (оптичною густиною, інтенсивністю флуоресценції, електродним потенціалом, швидкістю реакції і т.д.). Масштаб координатних осей – лінійний або логарифмічний – вибирається залежно від конкретного експерименту. Логарифмічні осі використовують, зокрема, при зміні концентрації в широких межах. Якщо потрібні більш точні результати, переважні лінійні осі і вузькі інтервали концентрації. Для побудови робочої кривої спочатку готують стандартні зразки відомої концентрації. Потім для кожного з них виміряють той або інший параметр і відкладають його значення у вигляді крапки проти відповідної концентрації. По крапках проводять плавну криву, на яку крапки лягають найкращим чином. Для цього використовують яку-небудь відповідну математичну функцію або емпіричну залежність. Потім виміряють той же параметр для досліджуваного зразка і по робочій кривій визначають його концентрацію (мал. 1).
У кожного методу є свої робочий діапазон, чутливість, фон, поріг виявлення.
Робочий діапазон – це діапазон концентрацій, в межах якого застосовна дана методика. Лінійна ділянка кривої відповідає області концентрацій, в якій результати найбільш надійні. При близьких до граничних високих і низьких концентраціях робочі криві звичайно стають нелінійними. Це обумовлено обмеженими можливостями методів аналізу і устаткування, що використовуються. Якщо концентрація визначуваної речовини потрапляє в нелінійну область високих значень, то зразок слідує розбавити і аналіз повторити.
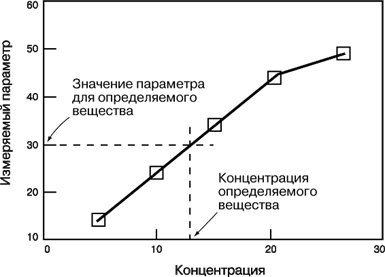
Мал. 1. РОБОЧА КРИВА – залежність параметра, що вимірюється, від концентрації для стандартної речовини. З її допомогою можна знайти концентрацію визначуваної речовини, відповідну даному значенню параметра.
Чутливість методу характеризується величиною зміни параметра, що виміряється, при даній зміні концентрації. Вона рівна кутовому коефіцієнту (тангенсу кута нахилу) робочої кривої. Як правило, чим вище чутливість, тим надійніше результати і тим нижче поріг виявлення.
Результат вимірювання часто включає складову, не пов'язану з визначуваною речовиною, – її називають фоном. Наявність фону може бути пов'язаний з особливостями устаткування або впливом матриці, в яку включений зразок. Щоб оцінити величину фону, проводять контрольний дослід. Для цього готують контрольний зразок, в якому немає визначуваної речовини, а є тільки всі сторонні домішки, що є в матриці, а також реагенти, що додаються в процесі аналізу. Контрольний зразок піддають тій же аналітичній процедурі, що і визначувана речовина. Значення параметра, що виміряється, для цього контрольного зразка вважають рівним фону.
Поріг виявлення – це якнайменша концентрація визначуваної речовини, при якій сигнал помітно відрізняється від фону. Величина порогу виявлення залежить від чутливості і точності методу: чим вони вище, тим нижче мінімальні визначувані концентрації. Хіміки-аналітики систематично розробляють способи вимірювання все більш низьких концентрацій. Сьогодні для багатьох методів аналізу поріг виявлення складає 10–6–10–9М, а деякі недавно розроблені методи дозволяють виміряти пікомолярні концентрації (нижче 10–12 М), знаходити речовини в абсолютних кількостях менше 10–18 мілі (приблизно декілька сотень тисяч молекул) і навіть спостерігати окремі атоми. Одна із задач, які постійно доводиться вирішувати в аналітичній хімії, – вдосконалення методів, що дозволяє працювати зі все більш дрібними зразками. Ті методи, для яких колись були потрібні мілілітрові кількості, тепер обходяться мікролітрами, а деякі – і десятками піколітрів.
Матриця. Термін «матриця» відноситься до оточення визначуваної речовини. Це все речовини, присутні в зразку, у тому числі і визначувані, відмінні від даного. Так, хлор визначають в плазмі крові, консервованої моркви, питній або морській воді. Ці зразки розрізняються по своїх хімічних і фізичних властивостях, а отже, їх матриці теж різні. Найпростіша матриця – питна вода: вона містить відносно небагато речовин, концентрація яких до того ж невелика. Консервована морква – складна матриця, головним чином тому що в ній містяться різні органічні сполуки.
Стандарти і визначувані при аналізі речовини по можливості повинні знаходитися в однакових або порівнянних матрицях, проте отримати матриці, що калібруються, вдається дуже рідко. Щоб розв'язати цю проблему, використовують синтетичні матриці, метод внутрішнього стандарту і т.д.
Якщо матриця даного зразка володіє відносно постійними фізичними і хімічними властивостями, не залежними від того, коли і де був отриманий зразок, то її можна достатньо повно охарактеризувати і відтворити. Одна з таких матриць – морська вода. Концентрації її основних компонентів (Na, Mg, Cl...) добре відомі. Можна отримати штучну морську воду і використати її для приготування стандартних розчинів інших речовин, концентрація яких невелика (наприклад, Al, Au, Ni, Zn). Склад біологічних рідин, таких, як плазма крові або сеча, також відомий, що дозволяє створювати штучні матриці для проведення певних аналізів.
Інший метод полягає в тому, що для стандартів і досліджуваної речовини створюють матриці приблизно однакового складу. Для цього до зразка і стандартів додають велику кількість якої-небудь «інертної речовини» (для отримання розчинів однакової іонної сили до зразка і стандартів можна додати 1 М NaClO4), так що невеликі відмінності в інших компонентах матриці стають неістотними. Вплив матриці при цьому не виключається, навпаки, воно посилюється, але тепер цей вплив в досліджуваному зразку і стандарті практично однаково.
Зручний спосіб компенсації впливу матриці, а також рішення проблем, пов'язаних з втратами речовини в ході складного аналізу, – використовування внутрішнього стандарту. Метод полягає в наступному. Перш ніж визначати речовину А, до що містить його зразка додають відому кількість речовини B. Кількості А і B визначають по одній і тій же методиці. Встановивши співвідношення між знайденою і відомою кількостями B, коректують отримане при аналізі кількість А. Внутрішній стандарт повинен бути відсутній в початковому зразку і бути хімічним аналогом визначуваної речовини. Наприклад, для визначення натрію в плазмі крові методом полум'яної емісійної спектроскопії як внутрішній стандарт часто використовують літій, оскільки він хімічно аналогічний натрію і в крові звичайно відсутній.
В методі доданих стандартів для приготування стандартів порівняння використовують сам досліджуваний зразок. Припустимо, що ми хочемо визначити вміст натрію в плазмі крові. Початковий зразок ділять на декілька частин, наприклад на три. До однієї з них нічого не додають, до двох іншим додають відомі кількості визначуваної речовини (в даному випадку Na), так що його концентрація стає на 100 і 200 ммоль/л більше, ніж в початковому зразку. Далі по одній і тій же методиці визначають Na у всіх частинах зразка і будують графік залежності величини, що виміряється, від приросту концентрації. З графіка визначають концентрацію натрію в початковому зразку.
Рівноважні і кінетичні вимірювання.
На мал. 2 графічно представлений хід хімічної реакції:
Визначувана речовина + Реагенти ![]() Продукти
Продукти
Спочатку концентрація лінійно міняється в часі, потім зміна стає все більш повільною, і, нарешті, концентрація виходить на горизонталь – система досягає рівноваги.
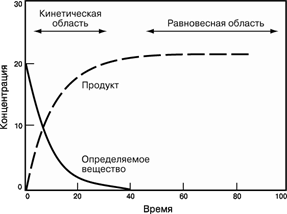
Мал. 2. ХІД ХІМІЧНОЇ РЕАКЦІЇ, представлений у вигляді графіка залежності концентрації реагенту від часу.
Хоча вважається, що багато хімічних реакцій йдуть «до кінця» (до повного вичерпання початкових речовин), насправді жодна з них не протікає тільки в одному напрямі. Хімічна реакція йде до тих пір, поки концентрація всіх що беруть участь в ній речовин не перестає мінятися, тобто поки система не досягне рівноваги. В цьому стані концентрація деяких речовин може бути дуже малий, але все таки вона не рівна нулю. Реакція не припиняється, просто швидкість прямої реакції (Реагенти ? Продукти) стає рівній швидкості зворотної (Продукти ? Реагенти), при цьому відбувається швидке взаємне перетворення реагентів і продуктів реакції, так що ніякої сумарної зміни концентрацій немає.
Аналітичні визначення можна проводити в хімічних системах, що знаходяться як в рівноважному, так і в нерівноважному станах. В першому випадку концентрації речовин не міняються, тому тривалість аналізу неістотна і не впливає на вибір методики. Рівноважні концентрації речовин пов'язані один з одним через константу рівноваги. Для хімічної реакції aA + bB ![]() cC + dD ця константа рівна
cC + dD ця константа рівна
![]()
де в квадратних дужках вказані мольні концентрації відповідних речовин, а показники ступеня рівні стехіометричним коефіцієнтам рівняння хімічної реакції. Константи рівноваги реакцій, що використовуються в аналітичній хімії, змінюються від 1 до 10100 і більш. Багато методів аналізу засновано на визначенні стану рівноваги. Можна навести як приклад дані нижче класичні методи – гравіметрію і титрування.
При аналізі нерівноважних систем визначають зміну концентрації реагуючих речовин в часі, тобто швидкість реакції. Вона задається виразом:
![]()
де до – константа швидкості, [A], [B], [C] – мольні концентрації речовин А, B, З, сума x, у, z – порядок реакції. Які саме хімічні речовини фігурують в рівнянні швидкості такої реакції і з якими ступенями входять їх концентрації, залежить від механізму хімічної реакції. При нерівноважних визначеннях потрібно встигнути провести вимірювання за достатньо малий (в порівнянні з тривалістю самої реакції) час, так щоб концентрації реагентів не змінилися. Визначення, засновані на вимірюванні швидкості реакції, можуть бути виконаний в дуже короткий час від початку реакції (іноді декілька секунд), оскільки не потрібно чекати, коли система досягне рівноваги. Якщо визначувана речовина – каталізатор, то вимірювання слід проводити до досягнення рівноваги, оскільки каталізатор змінює тільки швидкість реакції, але не положення рівноваги.
Застосування кінетичних вимірювань в аналітичній хімії не обмежується методами аналізу, заснованими на вимірюванні швидкості реакції. В основі багатьох аналітичних методів, наприклад флуоресцентного аналізу, амперометрії, хроматографії, лежать кінетичні процеси, хоча аналізуються системи, що знаходяться в стані рівноваги. Для одержання остаточних висновків і підвищення вірогідності застосовуються методи математичного аналізу і математичного моделювання.
Розділ ІІ
Похожие работы
... розрахункових задач слід використовувати аналітико-синтетичний шлях, тобто той шлях, який використовують самі учні. Спираючись на дані аналізу методичної літератури, свої спостереження за учнями процес розв’язування розрахункових задач ми представили як ряд взаємних етапів. Перший етап: уважно прочитати текст задачі. Якщо текст задачі сформульований автором задачника не зовсім зрозумілий, можна ...
... дування відкритих уроків, спільного планування уроків і т. д. Вчитель географії з врахуванням загально шкільного плану навчально – методичної роботи розробляє індивідуальний план реалізації міжпредметних зв’язків в курсах географії. Методика творчої роботи вчителя включає ряд етапів: 1. Вивчення опорних тем і підручників інших предметів, читання додаткової наукової, науково – популярної і ...
... прийоми їх реалізації на уроках - один з аспектів загальної проблеми удосконалювання методів навчання в сучасній школі [23, 27, 28]. 3.2. Методика впровадження міжпредметних зв’язків при підготовці трактористів-машиністів Для здійснення міжпредметних зв’язків на практичних заняттях необхідно в умови задач включати конкретні чисельні данні про параметри та характеристики технічних об’єктів, ...
... . Лише за наявності відповідної математичної підготовки слід вимагати від учнів запис та формулювання законв заломлення світла. У новій програмі з фізики для 12 – річної школи багато уваги приділено розв’язуванню фізичних задач. Так, підкреслено , що задачі потрібно ефективно використовувати на всіх етапах засвоєння фізичного знання : для розвитку інтересу, творчіх здібностей і мотивації учнів ...


0 комментариев