Навигация
2. Отстаивание.
Налейте 50 мл загрязненной воды в мерный цилиндр. Наблюдайте за происходящими изменениями в течение 0,5-1 ч.
Какие из загрязняющих веществ можно удалить отстаиванием? Исследуйте верхний слой волы на загрязнение следуюшими способами:
присутствие в воде взвесей определяется ее относительной мутностью (прозрачная вода взвесей практически не содержит);
присутствие растворенных веществ в данном случае определяется визуально, поскольку нами был использован пищевой краситель;
присутствие бактерий проверяется с помощью стерильной проволочной петли: петлю простерилизуйте в пламени; перенесите каплю исследуемой воды из стакана в чашку Петри с заранее приготовленной питательной средой - эта среда обеспечивает рост бактерий, так что их присутствие будет заметно по появлению колоний через несколько дней.
3. Фильтрование.
Отфильтруйте с помощью воронки и фильтровальной бумаги 20-30 мл загрязненной воды в чистый лабораторный стакан. Проверьте отфильтрованную воду на загрязнение описанными выше способами.
Удаляются ли в результате фильтрования взвеси? Растворенные вещества? Бактерии? Сравните эффективность отстаивания и фильтрования.
4. Хлорирование.
Налейте 30-40 мл загрязненной воды в лабораторный стакан емкостью 100 мл. Добавьте несколько капель раствора хлорки, тщательно перемешайте и дайте отстояться в течение 10 мин. Проверьте воду на загрязнения.
Удаляются ли в результате хлорирования взвеси? Растворенные вещества? Бактерии? Почему в настоящее время особую актуальность приобретают разработки технологий обеззараживания волы без применения хлора?
4. Дистилляция.
Пронаблюдайте за процессом дистилляции воды.
Удаляются ли в результате дистилляции взвеси? Растворенные вещества? Бактерии? Почему дистилляцию не используют как единственный способ надежной очистки питьевой воды?
Проба с простейшими
Для опытов берут культуру простейших, приготовленную заранее.
а) Висячую каплю культуры простейших помещают над часовым стеклом с кашицей или вытяжкой исследуемого материала, чтобы они не соприкасались и, наблюдая в микроскоп при увеличении 300 или 600 (в зависимости от цели), отмечают по секундомеру время прекращения движения простейших.
Фитоцидную активность (А) выражают в единицах, рассчитанных по формуле, где Т - время.
А = 100: Т
Картина гибели простейших под влиянием фитонцидов разных растений различна. Это - растворение (лизис), образование вздутий и пузырей, сморщивание, просто прекращение движения и т.д.
б) В каплю культуральной жидкости с простейшими в середине часового стекла добавляют меньшую каплю вытяжки растений с сильной фитонцидной активностью. Наблюдают сначала усиление движения, затем избегание простейшими фитонцидной вытяжки (рассредоточение по краям), далее обнаруживаются уменьшение и вовсе прекращение движения.
Через некоторое время можно видеть и морфологические изменения, указанные в предыдущем разделе данной работы.
Для исключения растекания капли вытяжки ее место можно ограничить, сделав предварительно на предметном стекле петлю из человеческого волоса, в которую и помещают каплю культуральной жидкости.
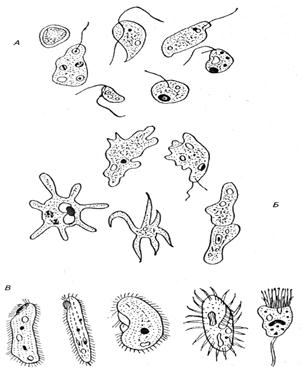
Простейшие - обитатели воды: А - жгутиковые, Б - амебы, В - инфузории [11].
3.3 Тестовые заданияСреди перечисленных веществ отметьте нерастворимое основание:
гидроксид бария;
гидроксид железа (II); +
гидроксид натрия;
гидрокарбонат аммония
Гидроксид цинка может реагировать со всеми веществами пары:
сульфат кальция и оксид серы (VI);
гидроксид натрия (р-р) и соляная кислота; +
вода и хлорид натрия;
сульфат бария и гидроксид железа (III).
В молекулярном уравнении реакции гидроксида цинка с соляной кислотой сумма всех коэффициентов равна:
1) 72) 5+3) 64) 4
Сумма коэффициентов в молекулярном уравнении реакций между гидроксидом алюминия и соляной кислотой равна:
1) 72) 8 +3) 64) 4
Формулы только основных оксидов указаны в ряду: 2O, SO2, CaO;
K2O, Na2O, CaO; +; CO, SO3, P2O5; CO, SO2, K2O.
Реакция
FeCl3 + 3NaOH ® Fe (OH) 3 + 3NaCl
относится к реакциям:
соединения;
разложения;
замещения;
обмена. +
При обычных условиях основания можно получить при взаимодействии с водой: BaO, CuO, FeO; Na2O, CaO, Li2O; +;MgO, ZnO, Al2O3; K2O, Li2O, Mn2O7.
Количеству вещества 1,5 моль равна масса гидроксида меди (II):
1) 98 г;
2) 196 г;
3) 147 г; +4) 980 г.
Реакции гидроксида железа (II) с серной кислотой отвечает сокращенное ионное уравнение:
FeO + 2H+ ® Fe2+ + H2O;
Fe (OH) 3 + 3H+ ® Fe3+ + 3H2O;
Fe (OH) 2 + 2H+ ® Fe2+ + 2H2O; +
Fe2+ + 2OH - ® Fe (OH) 2.
Основные свойства проявляет оксид:
марганца (VII);
кальция; +
калия; +
серы (IV), фосфора.
В схеме превращений:
![]()
веществами А, Б, В являются соответственно: Cl2, H2O, Na2O; HCl, NaOH, NaOH (избыток); +HCl, H2O, NaOH; Cl2, NaOH, Na2O.
Характер реакции среды водного раствора аммиака:
слабокислый;
сильнокислый;
нейтральный;
щелочной. +
Гидроксид алюминия проявляет амфотерные свойства при взаимодействии:
только с щелочью;
с кислотой и щелочью; +
только с кислотой;
с солью и кислотой
Раствор гидроксида натрия реагирует с каждым из веществ, указанных в паре:
оксид железа (II) и соляная кислота; +
хлорид железа (III) и углекислый газ;
серная кислота и оксид кальция;
оксид цинка и хлорид калия.
Конечным продуктом в цепочке превращений на основе цинка является:
![]()
гидроксид цинка;
оксид цинка; +
цинк;
цинкат калия
В сокращенном ионном уравнении реакции серной кислоты с гидроксидом натрия сумма коэффициентов равна:
1) 7;
2) 5;
3) 3; +4) 4.
Раствор гидроксида натрия взаимодействует с каждым веществом, указанным в ряду:
оксид кремния, сульфат натрия, хлоргидроксид алюминия;
оксид железа (II), медь, серная кислота, гидроксид алюминия;
оксид кремния, алюминий, соляная кислота, гидроксид цинка; +
оксид железа (II), медь, аммиак, гидроксид цинка.
В водном растворе ступенчато диссоциируют:
1) KOH;
2) Cu (OH) 2;
3) Ca (OH) 2; +4) Al (OH) 3.
Общая сумма всех коэффициентов в полном и сокращенном ионном уравнениях реакции между нитратом серебра и гидроксидом натрия равна ____________________ (ответ напишите цифрами- 10)
Гидроксид бария можно получить из
BaO и H2CO3;
BaSO4 и NaOH;
BaO и NaOH
BaO и Н2О+
Установите соответствие:
| Реагенты | Протекает реакция |
| 1. Са (ОН) 2 ® (t) … 2. NaHCO3 + NaOH (p) ® … 3. Al2O3 + Na2O ® (t) … 4. Al + H2O ® … 5. (CuOH) NO3 + HNO3 ® … 6. PbCl2 + HI ® … | А. Соединения (3) Б. Замещения (4) В. Разложения (1) Г. Нейтрализации Д. Ионного обмена (2, 5,6) |
Щелочь, а затем кислоту используют при осуществлении следующих превращений:
CaO ® CaCO3 ® CO2;
FeCl2 ® Fe (OH) 2 ® FeSO4; +
K ® KOH ® K2SO4;
CuSO4 ® Cu (OH) 2 ® CuO.
Сокращенным ионным уравнением Fe2+ + 2OH - = Fe (OH) 2¯ может быть выражено взаимодействие между:
FeO + KOH;
FeCl2 + NaOH; +
FeSO4 + Cu (OH) 2.
Сокращенным ионным уравнением NH4++ OH - Û NH3 + H2O
можно выразить результат взаимодействия веществ:
хлорида аммония и гидроксида натрия; +
хлорида аммония и нитрата серебра;
аммиака и соляной кислоты;
сульфата аммония и гидроксида меди (II).
Сильными электролитами являются все вещества группы: KOH, HNO3, H2SO4; + H2S, H2SO3, H2SO4; MgCl2, CH3COOH, NaOH; H2S, CH3COOH, H2SO3.
Отметьте самый сильный электролит:
1) RbOH; +2) Ca (OH) 2;
3) CuOH;
4) LiOH.
Как изменяются свойства гидроксидов, образованных металлами главной подгруппы II группы, при увеличении заряда ядра атомов?
щелочи ® нерастворимое основание ® амфотерный гидроксид;
амфотерный гидроксид ® нерастворимое основание ® щелочь;
кислота ® амфотерный гидроксид ® щелочи;
основания ® амфотерный гидроксид ® кислота. +
Основные свойства гидроксидов усиливаются слева направо в ряду
Mg (OH) 2 - Al (OH) 3 - H2SiO3 - H3PO4
H2CO3 - B (OH) 3 - Be (OH) 3 - LiOH+
NaOH - Mg (OH) 2 - H3PO4 - H2SO4
LiOH - B (OH) 3 - H2CO3 - HNO3
Будет протекать реакция в растворе между гидроксидом калия и
1) NO2;
2) Fe2O3; +3) BaSO4;
4) Ca (OH) 2
Установите соответствие:
| Реагенты | Сумма коэффициентов в кратком ионном уравнении |
| 1. NaHSO3 + HCl ® … 2. K2CO3 + H2O + CO2 ® … 3. Cr (OH) 3 + HBr ® … 4. Mn (OH) 2 + KHSO4 ® … | А.3 (1) Д.7 Б.4 (3) Е.8 В.5 (2) Ж.9 Г.6 (4) З.10 |
Сокращенное ионное уравнение Zn2+ + 2OH - = Zn (OH) 2¯ отражает сущность взаимодействия между:
цинком и водой;
оксидом цинка и водой;
хлоридом цинка и гидроксидом натрия; +
хлоридом цинка и серной кислотой.
При взаимодействии 40 г гидроксида натрия и 100 г сульфата меди (II) масса вещества, оставшегося в избытке, равна___ г. (80г CuSO4)
33. Укажите название кислоты, которая может образовывать кислые соли:
а) метафосфорная
б) азотная
в) угольная +
г) уксусная
34. Два типа кислых солей образует кислота:
а) угольная
б) сернистая
в) сероводородная
г) ортофосфорная +
35. У каких солей заряд кислотного остатка равен - 1:
а) сульфид натрия
б) гидросульфит кальция +
в) дигидрофосфат натрия +
г) гидросульфат калия +
36. Какие вещества, реагируя с раствором хлорида бария, образуют соль?
а) азотная кислота
б) серная кислота
в) сульфат натрия +
г) карбонат калия
37. Какие металлы вытесняют медь из водного раствора сульфата меди (II):
а) железо +
б) серебро
в) натрий
г) цинк +
38. Заряд каких кислотных остатков равен - 2?
а) гидрокарбонат-ион
б) гидрофосфат - ион +
в) дигидрофосфат-ион
г) сульфит-ион +
39. В отличие от соляной кислоты концентрированная серная кислота при определенных условиях может реагировать с:
а) гидроксидом калия
б) нитратом натрия +
в) оксидом алюминия
г) оксидом углерода (IV)
40. Ортофосфорная кислота реагирует с:
а) оксидом кальция +
б) хлоридом натрия +
в) гидроксидом железа +
г) оксидом кремния (IV)
41. В каких парах вещества могут реагировать между собой?
а) серная кислота и карбонат калия +
б) нитрат серебра и ортофосфорная кислота +
в) соляная кислота и железо +
г) оксид алюминия и азотная кислота +
42. С какими из перечисленных веществ реагируют щелочи?
а) растворимыми солями меди +
б) слабыми кислотами +
в) основными оксидами
г) амфотерными гидроксидами +
43. Щелочь может образовываться при взаимодействии?
а) калия и воды +
б) карбоната натрия и гидроксида бария (водные растворы) +
в) хлорида алюминия и гидроксида аммония (водные растворы)
г) оксида натрия и воды +
44. Щелочи могут реагировать:
а) только с сильными кислотами
б) как с сильными, так и со слабыми кислотами +
в) только с кислотными оксидами
г) как с кислотными, так и с амфотерными оксидами +
45. Основание не образуется при взаимодействии избытка разбавленного раствора щелочи с:
а) сульфатом алюминия +
б) хлоридом железа (II)
в) нитратом аммония
г) хлоридом цинка +
46. При нагревании сравнительно легко разлагаются:
а) гидроксид калия
б) гидроксид меди (II) +
в) гидроксидом натрия
г) гидроксидом алюминия +
47. Охарактеризуйте свойства оксида кремния (IV):
а) амфотерный
б) кислотный +
в) не реагирует с водой +
г) вытесняет при нагревании из кристаллических карбонатов оксид углерода (IV)
48. Оксид фосфора (V) не реагируют с:
а) водой
б) щелочами
в) основными оксидами
г) кислотами +
49. С какими веществами, формулы которых приведены ниже, реагирует ![]() , но не реагирует
, но не реагирует ![]() ?
?
а) оксид бария +
б) вода
в) серная кислота
г) гидроксид натрия +
50. Наиболее выраженными кислотными свойствами обладает:
а) оксид висмута (V)
б) оксид фосфора (V)
в) оксид азота (V) +
г) оксид мышьяка (V) [27-30].
Обсуждение результатов. Выводы
В эксперименте принимали участие ученики 8 классов МОУ СОШ-гимназии № 5 (выборочная совокупность составляла 45 школьников).
В экспериментальных классах были проведены разработанные уроки - экскурсии, приведенные в главе 3. Занятия проводились с акцентом на прикладные и экологические аспекты.
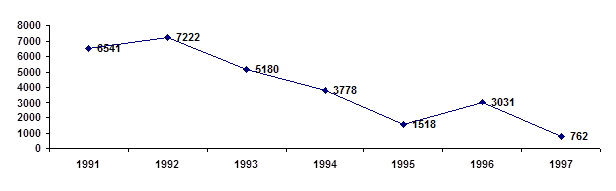
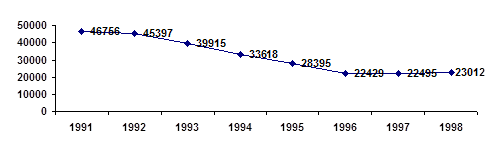
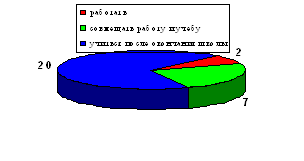
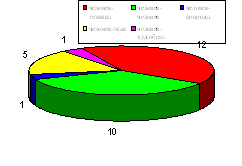
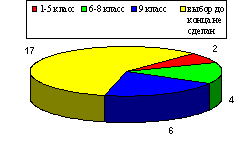
Для констатации результата после проведения разработанных занятий были проведены контрольные работы, состоящие из тестов, которые приведены в главе III. Результаты эксперимента в школе приведены на диаграмме, отражающей изменения качества знаний и успеваемости в контрольном (8 а) и экспериментальном (8 в) классах.
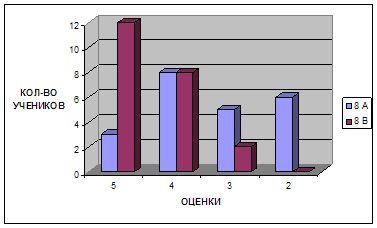
Диаграмма 1. Изменение успеваемости учащихся
Таким образом, избранная тематика способствовала повышению качества знаний, научного и экологического мировоззрения, а главное вызвала интерес учащихся к более глубокому изучению химии.
На основе проведенной работы можно сделать следующие выводы:
1. Доказано, что использование на уроках химии экскурсий с акцентом на экологические знания развивает умения наблюдать факты и явления и объяснять их сущность в свете изученных теорий и законов; формирует и совершенствует экспериментальные умения и навыки.
2. Оценен уровень сформированности знаний и познавательной активности при изучении заданной темы по разработанным методическим подходам.
Изучив проблему использования экскурсий для формирования экологического мировоззрения школьников, мы можем утверждать, что гипотеза "Систематическое использование экскурсий на уроках химии способствует развитию мыслительной деятельности, познавательного интереса учащихся, более прочному и глубокому усвоению материала и формированию экологического мировоззрения и профориентации", подтверждена в ходе эксперимента.
Литература
1. Чернобельская Г.М. Методика обучения химии в средней школе. М.: ВЛАДОС, 2000. с.12-63.
2. Оржековский П.А. Формирование у учащихся опыта творческой деятельности при обучении химии. - М.: 1997. С.121.
3. Теоретические основы содержания общего среднего образования / Под ред.В. В. Краевского, И.Я. Лернера. - М.: 1983. С.211.
4. Сафонова М.В. Экскурсии на химические производства. - М.: 1998.
5. Бабанский Ю.К. Об актуальных проблемах совершенствования обучения в общеобразовательной школе // Советская педагогика, 1979, № 3. С.3-10.
6. Чернобельская Г.М., Трухина М.Д., Шелехова Л.М. Пропедевтический курс химии с прикладным содержанием для VIIIкласса // Химия в школе, 1995, № 4.С. 19.
7. Назаренко В.М. Химия, экология, нравственность: проблемы образования // Химия в школе, 1995, № 3. С. 2.
8. Макареня А.А., Обухов В.Л. Методология химии. - М.: Просвещение, 1985.
9. Бабанский Ю.К. Оптимизация процесса обучения. - М.: Педагогика, 1977.
10. Вивюрский В.Я. Заключительные уроки по химии в средней школе. - М.: Просвещение, 1980.
11. Производственные экскурсии по химии: Сб. статей из опыта учителей/ Под ред. Л.А. Цветкова. - М. Учпедгиз, 1953. - с.135.
12. Митлена Э.М. Создание эмоционального настроя учащихся на уроках. Химия в школе, 1989, № 6.
13. Яншин А.Л., Мелуа А.И. Уроки экологических просчетов. М.: Мысль - 1991.
14. Шиленков Р.В., Чернобельская Г.М. Развитие самостоятельности учащихся в условиях индивидуализации обучения // Химия в школе. - 2004. - №5. - с.18-19.
15. Соколова О.Е. Технология педагогических мастерских: развитие творческих способностей учащихся // Химия в школе. - 2001. - №7. - с.14-15.
16. Зайцев О.С. Методика обучения химии: Теоретический и прикладной аспекты. - М.: Гуманит. изд. ВЛАДОС, 1999. - 358 с.
17. Обучение химии в 11 классе. В 2 ч. Ч 1: Кн. Для учителя / Под ред. И.Н. Черткова. - М.: просвещение, 1992. - с.6 - 20.
18. Боброва О.В. Организация самостоятельной работы учащихся при изучении нового материала // Химия в школе. - 1996. - №5. - с.23.
19. Эпштейн Д.А. Общая химическая технология. - М.: Химия, 1979. - с.312.
20. Монахова В.М., Орлова В.А. Теория и практика проведения факультативных занятий. - М.: Просвещение, 1983. - С.150.
21. Дьякович С.В. Методика факультативных занятий по химии. - М.: Просвещение, 1985. - С.175.
22. Пидкасистый П.И. Самостоятельная деятельность учащихся. - М.: Педагогика, 1972. - С. 200.
23. Скаткина М.Н. Дидактика средней школы. - М.: Просвещение, 1982. - С.180.
24. Егорова H.В. Наш подход к экологическому образованию учащихся // Химия в школе. - 2002. - № 5. - С.40 - 43.
25. Табуева Э.М. Экологическое образование как фактор формирования культурного потенциала личности // Химия в школе. - 2004. - №5. - С.18-19.
26. Шиленков Р.В., Чернобельская Г.М. Развитие самостоятельности учащихся в условиях индивидуализации обучения // Химия в школе. - 2004. - №5. - С.18-19.
27. Кирюшкин Д.М., В.С. Полосин. Методика обучения химии. - М.: Просвещение, 1970. - C.297 - 302.
28. Эпштейн Д.А. Факультативные занятия по химии. - М.: Просвещение, 1971. - С.175.
29. Афонина И.Г. Тестовые задания в курсе химии. // Химия в школе. - 2002. - № 7. - С.43 - 45.
30. Химия: Сборник тестовых заданий для подготовки к итоговой аттестации (варианты и ответы, решение расчетных задач).9 класс (базовый уровень) / Н.В. Ширшина. - Волгоград.: Учитель, 2004. - С.81.
Похожие работы
... эти психологические факторы (а не находится в противоречии с ними), то качество образования будет повышаться. Это и касается качества школьного исторического образования. 3.3. Практическая деятельность школьного музея на базе МОУ «Большеутинская средняя общеобразовательная школа» Территория села Большой Ут и близко расположенных деревень находится в пределах западных предгорий Уральской ...
... и устойчивых требований, которые определяют характер и особенности организации коррекционно-образовательного процесса и управления познавательной деятельностью лиц с особыми образовательными потребностями. Специальная педагогика опирается на соответствующие обще- педагогические принципы организации образования и управления познавательной деятельностью, однако их реализация в системе специального ...
... больше чем в Харькове), дальше, где-то в само конце, следовали ремесленники и рабочие. Глава II. ГЕОГРАФИЯ ОТРАСЛЕЙ ПРОМЫШЛЕННОСТИ КУРСКОЙ ОБЛАСТИ 2.1. География машиностроения Машиностроительный комплекс - сложное межотраслевое образование, охватывающее машиностроение и металлообработку. В свою очередь, машиностроение включает много специализированных отраслей, сходных по технологии ...
... экспериментальной площадки был выбран 9 А класс. В этом классе 29 человек: 17 мальчиков и 12 девочек. Цель эксперимента: выявление психолого-педагогических условий профессионального самоопределения учащихся в процессе обучения биологии; а также формирование устойчивой положительной мотивации к изучению курса биологии и развитие профессионального самоопределения учащихся при изучении курса “Общая ...

0 комментариев