Приближенные вычисления в расчетных химических задачах
Введение
Каждый учитель в своей практике сталкивался с ситуацией, когда учащийся, решая расчётную задачу, получает ответ, немного отличающийся от ответа, данного в задачнике, или у группы учащихся ответы различаются между собой. Незначительно, на десятые или даже сотые. Тем не менее возникает вопрос: какой ответ правильный при условии, что решение задачи верное?
Однозначно можно утверждать, что суть этой проблемы заключена в способах вычислений, производимых учащимися. Точнее, в неправильных приближённых вычислениях.
В математике есть целые разделы, где изложены правила приближённых вычислений, приведены доказательства теорем, следствия и т. п. При обучении химии наиболее существенно сформулировать правила приближённых вычислений, основанных на математических законах, строгих, понятных и достаточных для того, чтобы решение и оформление химической задачи было корректным с точки зрения математики.
Рассмотрим задачу.
Задача 1. Вычислите объём 10%-ной соляной кислоты, которую можно нейтрализовать 26,3 г питьевой соды, содержащей примеси (массовая доля примесей 0,026). Ответ округлите до сотых.
Можно сказать, что с математической точки зрения эта, и любая другая, расчётная химическая задача сводится к вычислению некоторого числа на основании чисел, заданных в условии задачи и(или) взятых из справочника.
Поэтому первое, что необходимо, — это научиться правильно записывать и характеризовать числа, учитывая, точные они или приближённые.
Точные и приближённые числа
Числа бывают точными и приближёнными. Точное число абсолютно. Приближённое число имеет погрешность. Форма записи не влияет на точное число. Точное число 2 можно записать так: 2; 2,0; 2,00; 2,000. Эти записи обозначают одно и то же. Принципиально иная картина с записью приближённого числа 2: записи «2; 2,0; 2,00; 2,000» неравноценны. Следовательно, чтобы правильно записать число, надо понимать, с какими числами — точными или приближёнными — мы имеем дело.
При решении расчётной химической задачи используют числа из разных источников. Во-первых, указанные в условии задачи числовые значения физических величин: массы, объёма и т. д. Во-вторых, числовые значения физических величин, взятые из справочников, например плотности или молярной концентрации раствора, относительной атомной и молекулярной массы, молярной массы. В-третьих, числа, полученные в результате промежуточных вычислений в ходе решения задачи. Наконец, коэффициенты пересчёта одних единиц в другие, коэффициенты пропорциональности и т. п. Какие эти числа: точные или приближённые?
Очевидно, самая большая проблема будет состоять в определении характера чисел, указанных в условии задачи. Мы имеем основания считать их приближёнными числами. Эти числа — результат измерений физических величин. А поскольку любое измерение можно провести с ограниченной точностью, то и точность чисел будет ограниченна. С этим можно не соглашаться. Но принятие этой или иной точки зрения повлечёт определённые последствия, влияющие на ответ задачи.
Числовые значения, указанные в справочниках, — всегда приближённые числа.
Числовые значения, полученные в результате вычислений, могут быть как точными, так и приближёнными. Очевидно, если хотя бы одно число приближённое, в результате не может быть получено точное число. В то же время не всегда результат вычисления двух точных чисел — точное число. Например, частное от деления единицы на три — бесконечная дробь, после округления которой получится приближённое число.
Всевозможные коэффициенты мы будем считать точными числами, если не указано обратное. Например, числа л и е — приближённые.
Числовые значения величин, принадлежащие множеству натуральных чисел: число частиц, количество процедур и др., — точные числа. При этом число Авогадро приближённое. Значение количества вещества в качестве неизвестного — приближённое число.
Таким образом, с нашей точки зрения, математическое решение расчётной химической задачи сводится к приближённым вычислениям.
Правила записи приближённых чисел
Все числа в расчётной химической задаче обычно записывают либо в виде целого числа, либо в виде десятичной дроби и очень редко — в виде обыкновенной. Целое число десятичных знаков не имеет. А десятичная дробь имеет десятичные знаки, которыми являются все цифры, расположенные после запятой.
Например, в условии задачи указан объём воды, равный 5 л. В этом числе десятичных знаков нет. Указана масса железа, равная 1,005 кг. В числе 1,005 десятичными знаками будут 0, 0 и 5, т. е. число имеет три десятичных знака.
Значащими цифрами десятичной дроби называют все её цифры, кроме нулей, расположенных левее первой отличной от нуля цифры.
В предыдущем примере все цифры значащие. Первая отличная от нуля цифра — 1, поэтому и она сама, и все числа, следующие за ней, значащие, всего четыре. Если в условии дан объём 0,050 л, то в этом числе первая цифра, отличная от нуля, — 5. Согласно определению первые два нуля значащими не будут, следовательно, в этом числе две значащие цифры.
Значащими цифрами целого числа называют все его цифры, кроме нулей, расположенных в конце числа, если они стоят взамен неизвестных или отброшенных чисел. Например, числовое значение массы 12 450 имеет пять значащих цифр, если все цифры известны, и четыре, если последний нуль стоит взамен неизвестной цифры.
Количество значащих цифр важно для оценки точности числа. Чем больше указано значащих цифр, тем точнее приведено числовое значение величины. Так, точность числа 1,005 дана до тысячных, а точность числа 12 450 — либо до десятков, либо до единиц.
Верной называют некоторую цифру приближённого числа а, если её абсолютная погрешность меньше пяти единиц разряда, следующего за этой цифрой, или равна им. Все числа, помещённые в таблицах, имеют все верные цифры, если не указано что-то дополнительно. Например, в числовом значении плотности раствора 1,150 г/мл имеются четыре значащие цифры, три десятичных знака, все цифры этого числа верные. В справочнике приведено числовое значение постоянной Авогадро NA = (6,022045 ± ± 0,000031) • 1023 моль. В числе 6,022045 последние две цифры — 4 и 5, которые составляют стотысячный и миллионный разряды, неверные, т. е. сомнительные, так как абсолютная погрешность равна 0,000031, что меньше половины десятитысячного разряда, но больше стотысячного и миллионного разрядов.
Сомнительными называют все цифры приближённого числа, расположенные правее последней верной цифры.
Вновь обратимся к условию задачи 1. Оно включает три числа: 10; 26,3; 0,026. Как мы видим, они даны с разной точностью, с разным количеством десятичных и значащих цифр, при этом ответ требуется округлить до сотых.
Что делать: сразу начинать округление всех или отдельных чисел или округлить полученный ответ?
Считая числа, заданные в условии задачи и неизвестные, приближёнными и не зная, какие математические вычисления мы будем производить и какие дополнительные числа нам понадобятся для решения, примем, что:
• в записи чисел, данных в условии задачи или взятых из справочных таблиц, все цифры верные;
• никакого предварительного округления всех этих чисел производить нельзя;
• нельзя дописывать десятичные нули.
Правила округления чисел
Данные в условии задачи числа, имеющие разную точность, придётся округлять, приступая к тем или иным математическим действиям. Поэтому следует сформулировать правила, согласно которым округления будут выполнены корректно и с минимальной погрешностью.
Для начала введём определения.
Округлением десятичной дроби называют отбрасывание цифр этой дроби, следующих за некоторым разрядом.
Округлением целого числа называют замену нулями цифр этого числа, следующих за некоторым разрядом.
Правила округления
• Если первая отбрасываемая цифра менше 5, то последняя сохраняемая цифра не изменяется.
Например, чтобы представить числовое значение относительной атомной массы бериллия (Лг(Ве) = 9,01218) с двумя десятичными знаками, необходимо округлить число 9,01218. Первая отбрасываемая цифра 2, она меньше 5, следовательно, число 9,01218, округлённое до 2 десятичных знаков, равно 9,01: Лг(Ве) ~ 9,01.
• Если первая отбрасываемая цифра больше 5, то последняя сохраняемая цифра увеличивается на единицу.
Например, числовое значение относительной атомной массы скандия Hr(Sc) = 44,9559) с тремя десятичными знаками равно 44,956: /\r(Sc) ~ = 44,956.
• Если отбрасывается только цифра 5, то последняя сохраняемая цифра не изменяется, если она чётная, и увеличивается на единицу, если она нечётная.
Например, чтобы представить числовое значение относительной атомной массы золота (Лг(Аи) = = 196,9665) с тремя десятичными знаками, необходимо округлить число 196,9665. Первая и единственная отбрасываемая цифра 5, а первая сохраняемая цифра 6 чётная, следовательно, цифру 6 необходимо оставить без изменения. Таким образом, Аг(Аи) ~ 196,966.
В то же время при округлении числового значения относительной атомной массы углерода ИГ(С) = 12,01115) до четырёх десятичных знаков надо отбросить единственную цифру 5, первая сохраняемая цифра 1 нечётная, следовательно, её необходимо увеличить на единицу: А,(С) ~ ~ 12,0112.
Рассмотрим следующий пример. Необходимо представить числовое значение относительной атомной массы кислорода (4(0) = = 15,9994) с двумя десятичными знаками. Согласно вышеприведённым правилам следует отбросить от числа 15,9994 последние две цифры — 9 и 4, а последнюю сохраняемую 9 — увеличить на единицу. Но цифры большей чем 9.в десятичной системе счисления нет. Не вдаваясь в математические рассуждения и обоснования, приведём правило для такого рода случаев.
• Если отбрасывают цифру больше 5, а последняя сохраняемая цифра 9, то её заменяют нулём, а предпоследнюю цифру увеличивают на единицу. Если же несколько подряд сохраняемых цифр равны 9, то их заменяют нулями, а первая сохраняемая цифра, отличная от9, увеличивается на единиц)'. В итоговой записи сохраняются все десятичные знаки. Нельзя отбрасывать десятичные знаки, равные нулю.
В числе 15,9994 отбрасываем третий десятичный знак (9), второй десятичный знак (9) заменяем нулём, но предпоследняя цифра тоже равна 9, её необходимо заменить на нуль. Первая цифра, отличная от 9, равна 5, её мы увеличиваем на единицу. Таким образом, Ar(0) ~ 16,00. Неправильно записать Аг(0) = 16,0 или Д(О) =16, отбросив значащие нули.
Теперь приступим к математическому решению задачи 1.
Вычислим массу питьевой соды в смеси.
Вычислим молярные массы гидрокарбоната натрия (питьевой соды) и хлороводорода, раствор которого представляет собой соляная кислота, или узнаем их из справочника.
Вычислим по уравнению реакции массу хлороводорода.
Вычислим массу соляной кислоты.
Вычислим объём соляной кислоты.
Приближённые вычисления в расчётных задачах
В расчётных задачах по химии подавляющее большинство вычислений не выходят за рамки четырёх действий: сложения, вычитания, умножения, деления.
При формулировании правил будем считать, что в записи числа с наименьшим числом десятичных знаков все десятичные знаки верные.
Правила сложения
Чтобы сложить приближённые числа с различным числом десятичных знаков, достаточно:
• оставить без изменения число, имеющее наименьшее количество десятичных знаков;
• округлить другое слагаемое так, чтобы оно содержало на один знак больше, чем слагаемое, оставленное без изменения;
• найти сумму полученных чисел и округлить её на один знак.
Задача 2. Рассчитайте массу раствора, полученного при смешении 12,4854 г твёрдого гидрок-сида натрия и 120,6 г воды.
Согласно правилам число 120,6 оставляем без изменения, как имеющее наименьшее число десятичных знаков, а число 12,4854 округляем до 12,49. Складываем числа и округляем до одного десятичного знака:
![]()
Правила вычитания
Правила вычитания сходны с правилами сложения:
• оставить без изменения число, имеющее наименьшее количество десятичных знаков;
• округлить другое число так, чтобы оно содержало на один знак больше, чем число, оставленное без изменения;
• найти разность полученных чисел и округлить до наименее точного числа.
Задача 3. Найдите массу примесей в 245 г образца, если масса вещества 242,67 г.
Согласно правилам оставляем без изменения число 245, число 242,67 округляем до 242,7, находим разность:
![]()
При вычитании может возникнуть ситуация, когда уменьшаемое и вычитаемое близки по значению, тогда разность будет настолько мала, что при округлении обратится в нуль.
Задача 4. Вычислите массу платины в драгоценном сплаве массой 15,26 г, если масса золота в нём составляет 15,2585 г.
Находим разность в соответствии с правилами округления:
![]()
После округления результат обратится в нуль, так как точность наименее точного числа составляет два десятичных знака. Однако если в дальнейшем полученное число необходимо использовать в других арифметических действиях, это может привести к принципиально неверным результатам, особенно при умножении и делении.
Поэтому в подобных случаях разность целесообразно округлить до одной значащей цифры, отличной от нуля. В задаче массу платины оставляем равной 0,002 г.
Правила умножения и деления
Чтобы перемножить два числа или разделить одно число на другое, необходимо:
• оставить без изменения наименее точное ЧИСЛО;
• округлить другое число так, чтобы оно содержало на одну значащую цифру больше, чем оставленное без изменения;
• найти произведение или частное и округлить его так, чтобы оно содержало столько значащих цифр, сколько их в наименее точном числе.
Задача 5. Вычислите массу примесей в 246,58 г чистого вещества, если их массовая доля составляет 0,0048.
Точность числового значения массы вещества определена до сотых, но имеет при этом пять значащих цифр, а массовой доли — до десятитысячных, но имеет при этом всего две значащие цифры. Поэтому оставляем число 0,0048 без изменения, округляем число 246,58 до трёх значащих цифр, т. е. до 247, умножаем:
![]()
Число 1,18 округляем до двух значащих цифр. Если эту задачу решать в точных числах, то вычисления дадут другой ответ:
![]()
Задача 6. Вычислите массу слитка бронзы, если масса олова в нём составляет 0,01266 кг, а массовая доля олова — 0,12.
Оставляем без изменения число с наименьшим числом значащих цифр, т. е. 0,12. Число 0,01266 округляем до трёх значащих цифр, до 0,0127. Находим частное:
![]()
Полученную бесконечную периодическую дробь округляем до двух значащих цифр.
При решении в точных числах получим иной ответ:
![]()
Вернёмся к решению задачи 1 с учётом правил, приведённых выше.
Вычислим массу соды в смеси. Определим её массу как произведение массы смеси и массовой доли вещества. Но поскольку дана
массовая доля примеси, то для нахождения массы питьевой соды необходимо произвести два действия. Можно сначала вычислить массовую долю вещества как разность, а потом найти массу питьевой соды как произведение или сначала вычистить массу примесей (произведение), а потом — массу питьевой соды (разность).
В подавляющем большинстве расчётных химических задач необходимо совершать множество вычислений. Выражения для определения разных величин можно объединить в одну формулу или производить в несколько действий с вычислением промежуточных результатов.
Правила множественных вычислений
Формулируя правила множественных вычислений, мы исходим из того, что точность ответа не может быть выше точности данных, указанных в условии. Это означает, что в полученном числе должно быть столько верных цифр, сколько их в наименее точном исходном числе.
Если в процессе решения задачи определены все числа, то предварительно, перед выполнением действий, числа можно округлить, руководствуясь следующим правилом.
• Чтобы получить ответ с и верными цифрами в наименее точном числе, необходимо все остальные числовые значения задать с п + 2 верными цифрами. Результаты промежуточных вычислений также должны иметь п + 2 верных цифр.
Если необходимо или возможно объединить несколько арифметических действий в одно, применяется следующее правило.
• Вычисления следует производить последовательно, так как правила вычислений приближённых чисел различны для разных арифметических действий. Можно объединить несколько последовательных действий в одно выражение, если они представляют сложение нескольких чисел, умножение и деление нескольких чисел. В задаче 1 мы столкнулись с необходимостью произвести умножение и вычитание. В соответствии с правилами эти действия следует выполнять последовательно.
Рассмотрим оба способа, чтобы сравнить ответы.
Способ 1. Масса смеси 26,3 г — три значащие цифры, массовая доля примесей 0,026, — две значащие цифры. Согласно правилам умножения оба числа остаются без изменения, умножаем, в ответе оставляем две значащие цифры:
![]()
После округления:
![]()
Способ 2
w(NaHC03) = 1,000 - 0,026 = 0,974. (Так как 1 — точное число.)
Числа 26,3 и 0,974 имеют одинаковое число значащих цифр, мы их не округляем и находим произведение:
![]()
Ответы совпали, но в другом примере они могут и не совпасть.
Теперь определим молярные массы гидрокарбоната натрия и хлороводорода. Их можно найти в справочнике: iW(NaHC03) = = 84,01 г/моль, Jlf(HCl) = 36,46 г/моль. Но традиционно вычисляют суммы молярных масс атомов элементов, составляющих формульную единицу вещества, округляя их до целых, за исключением хлора, относительную атомную массу которого округляют до 35,5 (безо всяких на то оснований). Следует иметь в виду, что при вычислении молярной массы вещества округлять её значение необходимо в соответствии с правилами округления, а именно до наименее точного числа, а не до целых, как обычно.
![]()
Так как в числе 1,0079 на один десятичный знак больше, чем в менее точном числе 35,453, то ни одно число не округляют.
![]()
По правилам в одном выражении нельзя складывать и умножать, поэтому сначала найдём молярную массу кислорода в питьевой соде как произведение, а потом молярную массу питьевой соды как сумму:
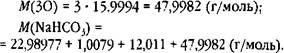
Поскольку наименее точное число 12,011, округлим все остальные числа до четырёх десятичных знаков: 22,9898; 1,0079 и 47,9982. Сумму четырёх слагаемых округлим до трёх десятичных знаков:
![]()
Теперь рассчитаем массу хлороводорода, реагирующего с заданной массой питьевой соды. Такие задачи решают, как правило, составлением пропорции:
![]()
Это выражение включает умножение и деление, вычислять в два действия не требуется.
Сначала подставим молярные массы, взятые из справочника:
![]()
Так как наиболее точное число имеет всего на одну значащую и верную цифру больше, чем наименее точное, то все числа остаются без округления. Считаем на двенадцатиразрядном калькуляторе. После округления полученного числа до числа значащих цифр в наименее точном сомножителе (три) получаем окончательный ответ:
![]()
Вычислим массу хлороводорода, используя рассчитанные молярные массы:
![]()
При вычислении массы традиционным способом наименее точное число имеет две значащие цифры:
![]()
• Мы считаем, что молярные массы веществ лучше брать из справочника. При вычислении необходимо оставлять максимальное число верных десятичных знаков.
Далее определим массу соляной кислоты.
Массовая доля хлороводорода в задаче 1 задана в процентах. Но массовую долю вещества в растворе можно выразить в разных относительных единицах, допускаемых СИ (международной системой единиц) и имеющих соответствующие обозначения: процентах — %, промилле — %о (миллионных долей — млн'1). Только относительная единица — доля единицы (0,1, 0,125, 1/2 и т. д.) не имеет обозначения. При записи это приводит к путанице.
Если записать, что и>(в-ва) = 0,10 = 10%, то запись будет верной. Поскольку из контекста ясно, что 0,10 — это не просто число и не числовое значение величины массовой доли, а значение этой величины. Запись «10%» означает, что число 10 умножено на значение единицы измерения относительной величины, обозначаемой знаком «%» (1/100), что эквивалентно записи «10 • 1/100». Если же записать просто «0,1», то в этой записи нет контекста, из которого следует, что 0,1 — это значение относительной величины, а не просто число.
Чтобы этой путаницы не происходило, учителя придумали запись, которой традиционно пользуются. Например, для определения массы раствора записывают следующее уравнение:
![]()
хотя корректно эта запись должна выглядеть так:
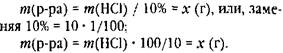
Но тогда возникает вопрос, откуда взялось число 100.
Итак, необходимо рассмотреть, как переводить одни единицы физических величин в другие.
Перевод одних единиц физической величины в другие
Задача 7. Вычислите массу 2 л 30,74%-ного раствора азотной кислоты.
По справочнику находим плотность данного раствора кислоты: 1,185 г/мл. Мы видим, что плотность и обьём заданы в различных единицах. Какие единицы выбрать: литры или миллилитры?
Рассмотрим ситуацию приведения к меньшим единицам, к миллилитрам, с точки зрения уменьшения или увеличения ошибки в расчётах. Коэффициент пропорциональности равен 1000. Мы условились считать коэффициенты точными числами. Поэтому при умножении или делении числа на 1000 точность результата не изменится. Однако опасность заключается в другом — в потере точности в форме записи. l/(HN03) = 2 л = 2000 мл. Если число 2 точное, то разницы никакой. Однако если число 2 приближённое, то все нули в числе 2000 — цифры незначащие. Точность такого числа оценивается до тысяч, и об этом надо помнить на всём протяжении решения задачи.
Вычислим массу раствора:
![]()
Но этот ответ неверный, так как точность наименее точного числа определена до тысяч. Поэтому окончательный ответ должен быть округлён до тысяч: 2000 г.
Рассмотрим другой вариант, переведём плотность из единицы г/мл в единицу г/л: р = 1,185 г/мл = = 1185 г/л. Вычислим массу:
![]()
Поскольку все числа были определены с точностью до целых, то и результат должен быть округлён до целых. Очевидно, что точность результата второго решения выше.
Из этого примера следует правило.
• При решении расчётных химических задач меньшие единицы переводятся в наибольшие, представленные в условии.
Таким образом, меньшую единицу массовой доли — процент — необходимо перевести в большую, т. е. в доли единицы, с соответствующим числом значащих цифр:
![]()
Теперь можно рассчитать массу раствора хлороводорода:
![]()
Наименее точный сомножитель имеет две значащие цифры, значит, в окончательном ответе должны быть две значащие цифры:
![]()
Осталось вычислить объём соляной кислоты по формуле: V = т/р. Следует определить плотность, пользуясь справочником, но для 10%-ного раствора соляной кислоты плотность в справочнике не указана, даны только значения для 9,510%- и 10,52%-ного растворов кислоты. Возникает задача: определить промежуточное значение величины. Это можно сделать с помощью интерполяции данных.
Интерполяция данных
Прибегать к интерполяции школьникам приходится редко, поскольку справочные значения, как правило, задаются в условии, но уметь это делать тем не менее надо.
Используем интерполяционную формулу Лагранжа. Она достаточно громоздка для вычислений вручную, но с помощью компьютерных средств обработки информации можно автоматизировать процесс. Задача была решена с помощью программы Excel, входящей в пакет Microsoft Office.
Необходимо найти плотность раствора в зависимости от массовой доли, т. е. массовая доля есть аргумент, а плотность — функция. В табл. 1 представлены справочные данные зависимости плотности раствора от массовой доли хлороводорода. Полужирным шрифтом выделено значение заданной массовой доли.
На основании этих табличных данных по формуле Лагранжа были вычислены значения искомой плотности, представленные в табл. 2.
Таблица 2

Вычисление многочлена четвёртой и выше степени по формуле Лагранжа даёт необходимую точность, т. е. три десятичные верные цифры, как это указано в справочной таблице.
Как видно из данных табл. 2 (многочлен первой степени, значение 1,0474257426), линейная интерполяция также даёт результат с достаточной точностью. Для вычисления плотности и содержания вещества в растворах по справочным таблицам линейной интерполяции достаточно. Таким образом, искомая плотность соляной кислоты 1,047 г/мл.
• При интерполяции табличных данных в искомом числе надо оставлять столько значащих цифр, сколько их указано в справочной таблице.
Наименее точное число 110 имеет две значащие цифры, значит, число 1,047 округляем до трёх значащих цифр; ответ — до двух значащих цифр:
![]()
![]()
Таким образом, объём соляной кислоты приблизительно равен 100 мл.
Задача решена, однако ответ должен быть дан с двумя десятичными знаками. Для данной задачи это условие невыполнимо. А в целом подобного рода условия нельзя признать корректными.
Для сравнения решим задачу 1, представив её решение как вычисление значения одного выражения
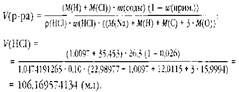
Похожие работы
... пособие по прикладной химии «Задачи по теоретическим основам химической технологии», составленное по материалам представленной работы. 3. Методика решения задач по теоретическим основам химической технологии Одна из главных задач химической науки и промышленности - получение необходимых человеку веществ (продуктов, материалов). Поэтому большинство учебных химических задач снизано с ...
... и МПДП Дьюар и Форд [23] подобрали систему инкрементов, специфичных для валентных, деформационных и торсионных колебаний определенных атомных групп или связей; на очень большом числе примеров продемонстрирована удовлетворительная точность результатов. сульфаниламид квантовый химический органический молекула Более логичным представляется корректирование значений силовых постоянных, и на этом пути ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
... промышленных сточных вод. Цель регенерации – с одной стороны, десорбция адсорбированных молекул (при регенеративной очистке воды) или деструктивное их разрушение и, с другой стороны, восстановление адсорбционной способности активного угля. Для удаления органических веществ с поверхности активного угля используют вытеснительную десорбцию, смещение равновесного состояния системы с помощью изменения ...





0 комментариев