Навигация
Уровень – в виде рисунков с описанием наблюдений, цифровыми пояснениями под рисунками и уравнениями реакций
1 уровень – в виде рисунков с описанием наблюдений, цифровыми пояснениями под рисунками и уравнениями реакций.
2 уровень - в текстовой форме или в виде таблицы – на выбор учащихся.
|
Рисунок прибора или описание действий | Наблюдения | Объяснения наблюдений |
| После нагревания перманганата калия тлеющая лучинка у отверстия газоотводной трубки вспыхнула | Выделяется кислород: 2KMnO4 ® K2MnO4 + MnO2 + O2 С + О2 ® СО2 |
Упрощенным вариантом этой работы или дополнением к ней для учеников 2-3 уровней может быть получение кислорода каталитическим разложением пероксида водорода. В этом случае важно предварительно предупредить детей о необходимости быстро и четко обнаруживать кислород в сосуде тлеющей лучинкой, так как реакция заканчивается довольно быстро. Чтобы не допустить быстрого ухода кислорода из сосуда, лучше проводить этот опыт в небольшой конической колбе с узким горлом: с началом выделения газа тлеющая лучинка вносится внутрь колбы, вспыхивает, затем быстро гасится, и опыт повторяется снова. Элемент занимательности и соревновательности придает подсчет вспышек лучинки за каждым ученическим столом. Пероксид водорода для этого опыта ученики по предложению учителя могут заранее приобрести в аптеке и принести в класс перед практической работой.
Инструкция к работеОборудование:
- пробирка с порошком перманганата калия;
- рыхлый комочек ваты;
- пробка с изогнутой газоотводной трубкой;
- спиртовка, спички, лучинка;
- штатив с лапкой;
- 2 стакана.
1. Соберите прибор для опыта, как показано на рисунке.
2. Осторожно нагревайте перманганат в пробирке, предварительно обогрев всю пробирку (для чего это делается?). Через 1-2 минуты проверьте, но появился ли в стакане кислород – опустите в стакан тлеющую лучинку.
3. Виден ли кислород? Есть ли у него цвет, запах?
4. Нагревая пробирку еще 2-3 минуты, соберите в стакан побольше кислорода. В момент наполнения стакана газом лучинка у верхнего края стакана будет вспыхивать. Затем осторожно уберите этот стакан из-под газоотводной трубки и так же осторожно «перелейте» газ из него во второй стакан. Как доказать, что во втором стакане появился кислород?
5.Составьте в тетради рассказ «Как я получал и изучал кислород».
Задания для 2 уровня
1.Подумайте над вопросами:
а)Для чего в пробирку вставляется вата?
б)Как еще можно получить кислород в лаборатории
в)В одинаковых стаканах под крышками находятся кислород, азот, углекислый газ и воздух. Как распознать, где какой газ?
2.Что нужно добавить в колбу, где закончилось выделение кислорода из пероксида водорода: пероксид водорода или диоксид марганца? Почему? Проверьте свои предположения на опыте.
Задания для 3 уровня.
1. В пробирках без надписей даны два черных порошка: оксид меди и диоксид марганца. Как надежно и быстро определить, где какое вещество?
2. Какие из веществ, способных выделять кислород при разложении, ни в коем случае не нужно применять для этой цели? Почему?
3. Как можно получить кислород в домашних условиях, не используя реактивов и приборов из школьной лаборатории?
По окончании изучения темы «Кислород, оксиды, горение» в классах с сильным составом учеников можно дать дополнительный практикум со следующими заданиями:
1. Определите, взаимодействует ли медь с кислородом на воздухе без нагревания. Как это проще всего сделать? Объясните результаты наблюдений.
2. Возможна ли эта же реакция при нагревании? Почему? По каким признакам это можно установить?
3. Как доказать, что в состав молекул спирта входят атомы водорода и углерода?
4. Окисляется ли алюминий в пламени спиртовки? Как это доказать?
5. Образуются ли при сжигании бумаги твердые вещества? Если да то о наличии какого химического элемента в составе бумаги они говорят?
ПРАКТИЧЕСКАЯ РАБОТА 4. ПОЛУЧЕНИЕ СУЛЬФАТА МЕДИ РЕАКЦИЕЙ ОБМЕНА
Демонстрация способа получения сульфата меди предварительно проводится учителем на уроке «Взаимодействие кислот с оксидами металлов». При этом выделяются те части его, которые потом предстоит выполнять самостоятельно на практической работе.
Прежде, чем приступить к выполнению опыта, ученикам следует показать оксид меди, раствор серной кислоты и предложить описать их свойства. В стакан объемом 150 мл наливается 20-25 мл раствора серной кислоты (1:5), туда же учитель высыпает ложечку оксида меди и все это перемешивает. Лучше использовать оксид меди, полученный на предыдущих уроках разложением малахита или гидроксида меди – он обладает большой реакционной способностью, и это помогает сэкономить реактив. Происходят ли какие-либо изменения? Можно ли этим ограничиться и сделать вывод, что серная кислота не взаимодействует с оксидом меди? Здесь необходимо обратить внимание на определенное условие протекания реакции – нагревание. Стакан с серной кислотой и оксидом меди ставят на асбестированную сетку, помещенную на кольцо штатива, и подогревают до кипения. Что наблюдается? Раствор становится голубым, а черный порошок на дне стакана растворяется. Добавляют еще немного оксида меди, перемешивают до полного его растворения, и так несколько раз, пока новая порция порошка остается на дне стакана не растворившейся. Что представляет собой раствор голубого цвета? Как выделить образовавшееся вещество из раствора? Для этого горячий раствор отфильтровывают, фильтрат выливают в фарфоровую чашку и упаривают до появления кристаллов сульфата меди.
Далее процесс анализируется и записывается его уравнение. Можно ли отнести данную реакцию к одному из трех известных типов реакций: соединения, разложения, замещения? Когда выяснено, что во время этой реакции атомы меди и водорода поменялись местами, учитель формулирует определение реакции обмена. Учащиеся делают вывод, что при взаимодействии серной кислоты с оксидом меди образуются соль и вода – произошла реакция обмена.
Во время практической работы учитель следит за работой каждого ученика и отмечает свои наблюдения: насыпание в пробирку оксида меди, наливание кислоты, нагревание смеси твердого вещества с жидким, приготовление фильтра, фильтрование выпаривание. Если каплю полученного горячего раствора поместить на предметное стекло, то при остывании его выпадают голубые кристаллы медного купороса, которые можно рассмотреть под микроскопом.
Отчет о работе может быть составлен по той же схеме, что и в практической работе «Получение и свойства кислорода».
Учащимся 2-3 уровней могут быть предложены следующие дополнительные вопросы и задания:
1. Рассчитайте, какие количества вещества и массы серной кислоты и оксида меди нужны для получения 32 г сульфата меди.
2. Можно ли для получения этого вещества использовать медь и раствор серной кислоты? Почему?
3. Ученик решил получить сульфат меди тем же способом, что и вы – из оксида меди и серной кислоты. Однако в ходе опыта началось выделение едкого газа. О чем это может говорить?
4. Можно ли аналогичным способом получить хлорид цинка? Какие вещества и приборы вам для этого потребовались бы? Имеет ли задача только одно решение?
ПРАКТИЧЕСКАЯ РАБОТА 5. ПРИГОТОВЛЕНИЕ РАСТВОРОВ.
Целью данной работы является обучение учащихся готовить растворы заданной процентной концентрации и закрепление понятия о концентрации растворов. Она же способствует развитию у них аккуратности, бережливости, навыков рационального планирования работы, трудовой дисциплины, товарищеской взаимопомощи.
Работа должна быть выполнена каждым учеником класса, и в данном случае это легко, так как одним и тем же предметом оборудования могут пользоваться в течение урока двое учащихся. Практическое выполнение работы требует не более половины урока, поэтому может быть дополнительно дано задание в виде расчетных задач по растворам.
Работу по приготовлению раствора следует дать в 2-4 вариантах, чтобы учащиеся за одним столом готовили растворы веществ разной концентрации. Желательно иметь в виду, что эти растворы могут быть использованы на последующих уроках и в других классах, поэтому при составлении вариантов заданий следует учесть потребности кабинета химии. Нельзя давать задание готовить растворы щелочей и кислот. Концентрация растворов должна примерно соответствовать той, которая нужна для работы на уроках. Количество раствора, приготовленного каждым учеником, должно быть небольшим (25-50 г).
Начиная занятие, предупредить детей о необходимости избегать рассыпания кристаллов солей на столе и загрязнения реактивов. Затем ученики намечают план приготовления раствора: рассчитать необходимые массу соли и объем воды, затем отвесить на рычажных весах соль и отмерить мензуркой воду.
В отчете о работе, кроме записей, относящихся к экспериментальной части задания, учащиеся должны написать и решение дополнительных расчетных задач.
Примеры заданий1 уровень
Рассчитайте массы соли и воды, необходимые для приготовления:
- 50 г 10% раствора хлорида натрия
- 40 г 20% раствора хлорида натрия
- 60 г 5% раствора сульфата меди
и т.п.
Похожие работы
... школы. Мебель кабинета физики. Особенности оснащения и оборудования кабинета физики сельской школы. Рабочее место ученика и учителя в кабинете физики сельской школы. Кабинет физики в условиях разноуровневого обучения. Системы освещения и затемнения кабинета. Экскурсия в кабинет физики городской школы. 4. Работа заведующего кабинетом физики (5ч.) Права и обязанности заведующего кабинетом физики. ...
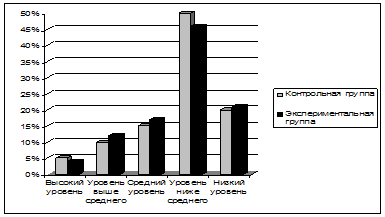
... школе №__ г. Кизляра в 3 классе. Изучив и проанализировав рассмотренные выше методики, попробуем выявить пути формирования знаний на уроках русского языка посредством применения схем при обучении грамоте и их эффективность. Исследование проводилось в 3 этапа. На первом этапе – констатирующий эксперимент: при помощи тестирования на уроке русского языка выявили уровень знаний учащихся по теме « ...
... школьников формировалась стихийно. В экспериментальной группе реализовывалась система формирования профильной направленности личности. 2.2 Диагностика профессионально значимых качеств личности, профессиональных склонностей и профессиональной направленности у учащихся старших классов школы 1356 г. Москва Нормы по СЖО, рассчитанные на нашей выборке, показали, что большинство старшеклассников ...
... АЛ. Деятельность. Сознание. Личность. М., 1983. 10. Мерлин B.C. Очерк интегрального исследования индивидуальности. М., 1986. 11. Орлов Ю.М. Восхождение к индивидуальности. М., 1991. Педагогическая антропология: Хрестоматия. Н. Новгород, 2002. 12. Петровский В.А. Личность в психологии: парадигма субъектности. Ростов н/Д., 1996. 13. Психология человека от рождения до ...






0 комментариев