Навигация
2. Заполните схему 4.
Схема 4.
Основные источники загрязнения атмосферы.
3. Сформулируйте поправки к закону «О чистом воздухе».
Международный конгресс постановил внести в закон «О чистом воздухе» следующие поправки, связанные с мерами борьбы с загрязнениями атмосферы: …
Лучший закон «О чистом воздухе» учитель зачитывает классу.
Урок заканчивается поведением итогов, оценивается работа учащихся [8, 11, 14].
Урок № 2. Интегрированный урок: пресс-конференция о воде и ее свойствахПредлагаем разработку интегрированного урока по теме «Вода. Свойства воды», который мы проводим в форме пресс-конференции. Учащиеся играют роли жителей планеты Акватоид — ученых, журналистов и гостей конференции. Учителя же выступают в роли землян-экспертов.
Звучит запись: «Приветствуем вас, жители планеты Земля, именующие себя человечеством. За помощью к вам обращается отряд наблюдателей с планеты Акватоид звездной системы Тау из созвездия Кит.
История нашей планеты трагична и поучительна. К сожалению, различные цивилизации Акватоида не могли сосуществовать мирно. Как правило, более грубая и примитивная, а в силу этого более жестокая цивилизация уничтожала более развитую и гуманную, чтобы, в свою очередь, оказаться уничтоженной еще более грубой.
В результате бессмысленных войн и варварского использования планетарных ресурсов Акватоид потерял почти всю жидкость, являющуюся основой жизни.
Чтобы выжить, Организация Объединенного Разума планеты предприняла попытки поиска вещества, способного по своим свойствам заменить жидкость жизни Акватоида. В архивах радиообменов с планетой Земля Солнечной системы было найдено сообщение, в котором упомянуто вещество, удовлетворяющее заданным параметрам: «Вода - самое драгоценное минеральное сырье, это не только средство для развития промышленности и сельского хозяйства, вода — это действительный проводник культуры, это живая крошка, которая создает жизнь там, где ее не было» (академик. Л.П. Карпинский).
В течение года специальная научно-исследовательская экспедиция тайно изучала вещество, которое вы, земляне, называете словом «вода». Обращаемся к вам с просьбой быть экспертами на конференции ученых, проводивших исследования свойств воды, и журналистов Акватоида, информирующих жителей планеты о ходе исследований».
Пресс-конференцию начинает сотрудник химической лаборатории планеты Акватоид. По ходу выступления он и следующие докладчики прикрепляют к классной доске карточки, на которых написаны важнейшие данные. В результате на доске получается краткий конспект по теме (рис. 1).
Сотрудник химической лаборатории. Это вещество встречается на Земле в трех агрегатных состояниях — жидком, твердом, газообразном. Среди ученых Земли оно известно под названием «оксид водорода», причем по химическим свойствам его относят к амфотерным оксидам.
Далее он приводит формулу воды, ее молярную массу, количественный и качественный состав, рассказывает о химических связях в молекуле, молекулярной кристаллической решетке этого вещества, последовательно прикрепляя на доску карточки 1-5 и демонстрируя схему образования ковалентной полярной связи.
Сотрудник физической лаборатории.
Сотрудники нашей лаборатории пришли к выводу, что наличие воды на планете Земля (около 1387 млн. км3) — наиболее важное условие зарождения и существования жизни. Вода на Земле существует не только в явном виде: четыре океана, моря, озера, реки; она присутствует и в воздушном океане Земли, и в почве, и во всех породах, слагающих земную кору. Много ее и в живых организмах. Даже в изливающейся из жерла вулканов огненной магме есть вода: каждый год они извергают из недр Земли до 40 млн. тонн воды.
Мы изучили теплофизические свойства воды.
Удельная теплоемкость воды составляет 4,2 кДж/(кг ·°С) (карточка 6). Это в 10 раз больше, чем у железа, в 40 раз больше, чем у золота. Только немногие вещества, например водород и аммиак, обладают большей удельной теплоемкостью. Из-за этой исключительной способности поглощать тепло температура воды при нагревании и охлаждении изменяется незначительно, поэтому водным обитателям никогда не угрожает ни сильный перегрев, ни чрезмерное охлаждение. Большая удельная теплоемкость воды определяет и климат планеты: вода нагревается значительно медленнее суши, забирая большое количество теплоты, и дольше сохраняет полученное тепло, выполняя при этом терморегулирующую функцию. На этом свойстве воды, кстати, основан и принцип обогрева жилых помещений землян — использование горячей воды в батареях отопительной системы.
Aqua omnia sunt (лат.) - вода существует везде
| 1 |
|
| |
| 2 | М = 18 г/моль | ||
| 3 |
| ||
| 4 | w(O) = 88,9 % | ||
| 5 | w(K) = 11,1 % | ||
| 6 | с = 4,2 кДж/(кг ·°С) | ||
| 7 | L = 2300 кДж/кг | ||
| 8 | λ = 334 кДж/кг |
Рис. 1. Вид доски к концу урока.
Удельная теплота парообразования воды составляет 2300 кДж/кг (карточка 7). Это означает, что при испарении 1 г воды поглощается 2300 Дж теплоты. Данное свойство воды тоже важно для терморегуляции: например, если бы люди не потели при совершении работы, то они перегревались бы. Пот, основой которого является вода, при испарении понижает температуру тела.
Значительна и удельная теплота плавления льда. При 0° С и атмосферном давлении она составляет 334 кДж/кг (карточка 8). Из распространенных на Земле металлов только алюминий, железо и медь имеют удельную теплоту плавления выше 200 кДж/кг (при соответствующих температурах плавления). Таким образом, замерзая, вода выделяет тепло и согревает окружающий воздух. Это свойство воды также играет немаловажную роль в формировании климата планеты: замерзание воды в реках, озерах, морях не позволяет переохлаждаться воздуху в данной местности, поэтому часто можно наблюдать, как птицы в сильный мороз греются, сидя на льду.
Журналист. Объясните, почему лед плавает.
На этот вопрос отвечают учащиеся, затем слово берет учитель физики (эксперт-физик), который демонстрирует подкрашенный плавающий лед.
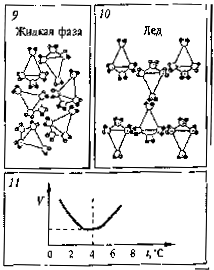
Эксперт-физик. Стоит задуматься, почему твердая вода (т. е. лед) легче жидкой. Это свойство воды аномальное и требует дополнительных разъяснений.
У большинства веществ при затвердевании образуется кристаллическая структура, средние расстояния между частицами при этом сокращаются, таким образом, объем уменьшается, а плотность растет.
При снижении температуры воды до +4°С расстояния между молекулами и небольшими ассоциатами (группами молекул) тоже становятся меньше, а также уменьшаются размеры самих молекул за счет снижения интенсивности колебаний атомов в них, что и приводит к увеличению плотности воды. Но затем происходит процесс кристаллизации с образованием дополнительных водородных связей, которые образуют ассоциаты крупных размеров с полостями внутри (карточки 9, 10). Именно это и приводит к уменьшению плотности, а следовательно, к возрастанию объема (карточка 11).
Журналист. Каким образом аномальное изменение плотности воды влияет на облик Земли?
Отвечают учащиеся.
Эксперт-физик. Это свойство необходимо всегда учитывать. Например, надо сливать воду из радиаторов автомобилей, из системы водяного отопления, если она не подогревается. При замерзании объем воды увеличивается примерно на 11 %. Если такой процесс происходит в замкнутом пространстве, то возникает громадное избыточное давление, превышающее атмосферное порой в 2500 раз. Замерзая, вода может разрывать горные породы, дробить многотонные глыбы, не говоря уже о трубах водяного отопления жилых помещений.
Учитель демонстрирует треснувшую стеклянную бутылку с замерзшей водой.
Сотрудник химической лаборатории.
Из свойств воды особенно важна ее способность растворять вещества. Вода — универсальный растворитель. В ней могут растворяться вещества различной химической природы, образованные ковалентными полярными и ионными связями. В воде могут растворяться твердые, жидкие и газообразные вещества. Но не все они одинаково хорошо растворяются в воде. Вещества бывают хорошо растворимые, малорастворимые и практически нерастворимые.
Докладчик демонстрирует таблицу растворимости, затем показывает через кодоскоп, как постепенно растворяются кристаллы различных окрашенных солей, помещенные на мокрую фильтровальную бумагу.
Журналист. Какой величиной характеризуется способность веществ растворяться в воде?
Сотрудник химической лаборатории. Эта величина — растворимость, которая определяется массой вещества, способной раствориться в 100 г воды при определенной температуре.
Журналист. Растворимость зависит от температуры?
Сотрудник химической лаборатории. Да, но не всегда одинаково; на нее влияет еще и агрегатное состояние вещества.
Демонстрирует заранее подготовленный стакан с водой, на стенках которого появились пузырьки воздуха. Проводит опыты — растворение газов в холодной и горячей воде, растворение сахара в холодной и горячей воде. Делает вывод, что при повышении температуры растворимость твердых веществ увеличивается, а газообразных — уменьшается.
Журналист. Отличаются ли свойства растворов веществ от свойств чистой воды?
Сотрудник химической лаборатории. Да, они имеют разные температуры кипения и кристаллизации, некоторые растворы электропроводны, а чистая вода — диэлектрик.
Испытывает электропроводность раствора поваренной соли и дистиллированной воды.
Журналист. Молярная масса воды равна 18 г/моль. В обычном состоянии вода — жидкость. Как можно объяснить, что вещества, имеющие большее значение молярной массы (например, углекислый и сернистый газы, метан), находятся при тех же условиях в газообразном состоянии?
Эксперт-химик. Действительно, температуры плавления и кипения воды аномально высоки в сравнении с соответствующими температурами водородных соединений аналогов кислорода (рис. 2). Если бы вода подчинялась этой закономерности, то ее температура кипения была бы равна примерно - 75о С, а температура замерзания составила бы - 90о С. Но тогда она не смогла бы стать эликсиром жизни.
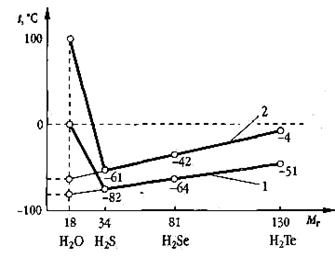
Рис. 2. Зависимость температур плавления и кипения веществ от молекулярной массы: 1 — tnn; 2 — tкип
Молекулы воды, образованные ковалентной полярной связью, электростатически притягиваются друг к другу {демонстрирует схему образования водородных связей). Такое взаимодействие называют водородной связью. Водородные связи могут связывать три, четыре, пять, шесть молекул воды, образуя ассоциаты (карточки 12-15), имеющие значительно большие значения молярных масс, поэтому вода при обычных условиях — жидкость. Между молекулами водородных соединений других элементов подгруппы кислорода водородные связи не возникают, и эти вещества при обычных условиях газообразны. Образованием водородных связей можно объяснить и хорошую растворимость некоторых веществ.
Журналист. Мы поняли, что на Земле встречается не чистая вода, а растворы различных веществ. А много ли в них растворено веществ?
Сотрудник химической лаборатории. Общий объем растворенных в Мировом океане солей равен 48 000 000 млрд. тонн. Если эти соли выпарить и равномерно распределить по всей поверхности земного шара, то образуется слой толщиной 45 м, а если распределить эту соль только по суше, то толщина слоя составит 153 м - это высота 50-этажного небоскреба.
Журналист. Имеет ли значение для живых организмов Земли способность воды растворять твердые, жидкие и газообразные вещества?
Сотрудник биолаборатории. Именно с водой к клеткам животных и растений поступают необходимые для жизнедеятельности вещества, продукты жизнедеятельности удаляются из клеток тоже с водой.
Вода участвует в явлениях осмоса, играющего важную роль в поддержании постоянства химического состава клетки. Осмос — это проникновение молекул растворителя через полупроницаемую мембрану в раствор какого-либо вещества. Вода поступает в клетку именно путем осмоса. Давление, которое нужно приложить к раствору, чтобы прекратить этот процесс, называют осмотическим, оно возрастает с увеличением концентрации раствора. Осмотическое давление жидкостей организма человека соответствует давлению 0,86%-ного раствора хлорида натрия. Более концентрированные растворы принято называть гипертоническими, менее концентрированные — гипотоническими. Направление диффузии воды — в клетку или из нее — обусловлено значением осмотического давления окружающего клетку раствора. Если, например эритроциты, поместить в гипотонический раствор, вода будет поступать в них и давление ее на наружную клеточную мембрану будет возрастать до тех пор, пока клеточная оболочка не лопнет. Напротив, в гипертоническом растворе вода стремится наружу, и клетки обезвоживаются.
На явлениях осмоса основано движение воды по проводящей системе зеленых растений от корней к листьям. Вода, всасываемая корневыми волосками, содержит мало растворенных веществ. Проникая в клетки через мембраны и создавая в них повышенное давление, вода придает упругость листьям, лепесткам цветков, стеблям трав.
Вода поддерживает кислотно-основное равновесие организма — это чисто химическая роль воды. Под действием специальных ферментов она вступает в реакции гидролиза, при которых образуются вещества, необходимые для жизни клетки.
Эксперт-биолог. Вода - самое распространенное неорганическое соединение в живых организмах нашей планеты. Например, даже в клетках эмали зубов ее около 10%, а в теле медузы - до 98%. В среднем в многоклеточном организме вода составляет около 80% общей массы тела.
Количество воды в организме зависит от возраста. Эмбрион человека на 97% состоит из воды, а у новорожденных ее количество составляет 77% массы. К 50 годам человек немного «усыхает» и вода составляет только 60% от его массы.
Основная масса воды — 70% — сосредоточена внутри клеток, а 30% - вне клеток (7% — это кровь и лимфа, а большая часть омывает клетки, это вода межтканевая — интерстициальная).
Вода в организме постоянно обновляется. В кактусах полное обновление воды происходит в течение 28 лет, у черепах - за 1 год, у верблюдов — за 3 месяца, у человека—за 1 месяц. Без воды человек может прожить только 3 дня, в то время как без пищи — 30-50 дней.
Живые организмы чутко реагируют на потерю воды. Человек, например, тяжело переносит потерю даже 0,68% воды. При этом у него повышается температура, краснеет кожа, учащается сердцебиение, начинается головная боль. Потеря 10% воды может привести к необратимым изменениям в организме, потеря 15-20% воды при 30о С (25% при 20° С) смертельна.
Журналист. Как происходит обезвоживание организма?
Эксперт-биолог. Этот процесс происходит на клеточном уровне. Растворы солей или Сахаров высокой концентрации, находящиеся вокруг клетки, вытягивают из нее воду. При этом цитоплазма отходит от стенок клетки. Это явление получило название плазмолиз.
Учитель демонстрирует опыты.
Опыт 1. «Выделение воды при плазмолизе». В небольшой цилиндр, наполненный глицерином, опускает кубик картофеля, нагрузив его для предотвращения всплытия. Постепенно из картофеля выделяется вода и поднимается вверх.
Опыт 2. «Потеря растением тургорного движения». Примерно за 30 мин до демонстрации в цилиндры с водой и раствором поваренной соли нужно опустить кусочки листьев капусты. На роке необходимо сравнить внешний вид образцов, сделать вывод.
Журналист. Мы знаем, что для сохранения тканей живыми вне организма ученые Акватоида опускали их в воду, но ткани погибали. Однако ткани, помещенные в 0,95%-ный раствор хлорида натрия, сохранились. Почему?
Сотрудник биолаборатории. Если ткани поместить в простую воду, концентрация солей в них снижается, что приводит к гибели клеток. В физиологическом растворе (0,95%-ный раствор хлорида натрия) клетки не погибают, так как концентрации солей в клетке и вне ее равны.
Журналист. Эксперименты показали, что если прилить в кровь чистую воду, то клетки крови человека лопаются, если же поместить их в концентрированный раствор соли, то они сморщиваются. Почему же этого не происходит, когда человек пьет воду и употребляет в пищу соль?
Сотрудник биолаборатории. В организме поддерживается постоянная внутренняя среда. Излишки воды и солей быстро удаляются через почки и кожу.
Журналист. Подлетая к зелено-голубой планете Земля, наши ученые заметили на поверхности воды темные пятна непонятного происхождения. Что это такое?
Эколог. Большая часть всей воды на Земле сосредоточена в морях и океанах. Запас пресной воды составляет всего 2%. Основное количество пресных вод (85%) сосредоточено во льдах полярных зон и ледников. Возобновление запасов пресных вод происходит в результате круговорота воды. С появлением жизни на Земле круговорот воды стал сложнее, так как к физическим явлениям испарения и конденсации добавились более сложные процессы, связанные с жизнедеятельностью живых организмов. Все более значительной становится роль человека в этом круговороте. Деятельность человека порой приводит к загрязнению природных вод.
Один из основных загрязнителей воды — нефть и нефтепродукты, которые могут попадать в воду из естественных источников, при нефтедобыче, транспортировке, переработке и использовании в качестве топлива и промышленного сырья.
Из других загрязнителей необходимо назвать металлы (например, ртуть, свинец, цинк, медь, хром, олово, марганец), радиоактивные элементы, ядохимикаты, поступающие с сельскохозяйственных полей, и стоки животноводческих ферм. Из металлов наибольшую опасность для водной среды представляют ртуть, свинец и их соединения. Накопление в водоемах органических веществ приводит к эвтрофикации — обогащению их биогенными элементами, следствием чего являются уменьшение содержания кислорода, обеднение фауны и флоры, неприятный запах.
Электростанции, промышленные предприятия часто сбрасывают в водоемы подогретую воду. Это приводит к повышению температуры воды — так называемому тепловому загрязнению. При этом уменьшается количество кислорода, увеличивается токсичность загрязняющих воду примесей, нарушается биологическое равновесие. В таких водоемах возникает и биологическое загрязнение — накапливаются микробы.
Деятельность человека — это геологическая сила, способная привести как к нарушению природных закономерностей, так и к улучшению состояния природных вод. На Земле разработаны химические и биологические способы очистки сточных вод, но самая эффективная мера — применение безотходных технологий, при которых использованную воду очищают от примесей и загрязнений, а затем вновь используют в технологическом процессе. Повторное использование очищенных вод в 20-25 раз снижает потребление свежей воды и уменьшает сброс сточных вод в водоемы. Это одно из главных условий рационального использования воды.
Эксперт-эколог. Человечество потребляет огромное количество пресной воды — в основном на промышленные и сельскохозяйственные нужды (рис. 3). Главный потребитель воды — сельское хозяйство. Наиболее водоемкие отрасли промышленности - горнодобывающая, сталелитейная, химическая, нефтехимическая, целлюлозно-бумажная и пищевая. На них уходит до 70 % всей воды, затрачиваемой в промышленности.
На все виды водопользования тратится 2200 км3 воды в год. На разбавление стоков уходит почти 20% ресурсов пресных под мира. Расчеты показывают, что даже если очищать все сточные воды, то все ришт и их разбавление потребуется 30-35 тыс. км3 пресной воды. Это означает, что водные ресурсы близки к истощению.
Потребление воды связано с развитием цивилизации: чем выше ее уровень, тем больше потребляется воды (рис. 4). К началу XXI в. среднее потребление воды составило более 200 л в сутки на человека. Все это приводит к недостатку пресной воды.
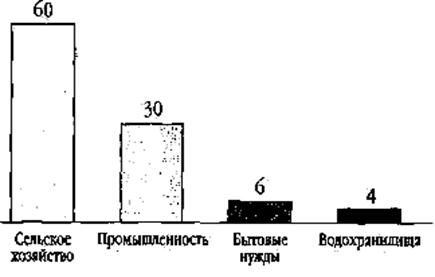 |
Рис. 3. Потребление пресной воды в различных отраслях человеческой деятельности (в процентах)
Вода занимает особое положение среди природных богатств Земли - она незаменима, поэтому человечество должно рационально использовать и беречь воду — основу жизни на Земле.
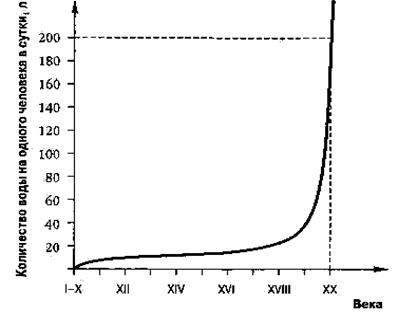 |
Рис. 4. Потребление пресной воды человечеством
Руководитель экспедиции ученых Акватоида. Итак, мы выяснили, что вода может служить основой жизни не только для землян, но и для цивилизации планеты Акватоид. Овладение способами получения этого вещества позволит нам восстановить условия, необходимые для существования жизни на нашей планете.
Учитель химии. Закончим урок словами А. де Сент-Экзюпери: «Вода, у тебя нет ни вкуса, ни цвета, ни запаха, тебя невозможно описать, тобой наслаждаются, не ведая, что ты такое. Нельзя сказать, что ты необходима для жизни! Ты сама жизнь! Ты наполняешь нас радостью, которую не объяснить нашими чувствами. С тобой возвращаются к нам силы, с которыми мы уже простились. По твоей милости в нас вновь начинают бурлить высохшие родники нашего сердца. Ты самое большое богатство на свете...»
Учащимся предлагается кроссворд. Лучшие ответы оцениваются. Отметки по физике, биологии, химии и экологии получают школьники, исполнявшие роли ученых, журналистов, а также активно работавшие на уроке.
Кроссворд
|
|
|
|
| 1 |
|
|
|
|
|
| Р |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 2 |
|
| А |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 3 |
| С |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 4 | Т |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 5 | В |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 6 |
|
|
|
| О |
|
|
|
|
|
|
|
|
|
|
|
| 7 |
|
|
|
|
|
|
|
|
|
| Р |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 8 |
| И |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 9 |
|
|
| Т |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 10 |
|
|
|
|
|
| Е |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 11 | Л |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| 12 |
|
|
| Ь |
|
|
|
|
|
|
|
|
|
|
|
1. Химическая система, образованная несколькими веществами, не имеющими поверхности раздела. 2. Процесс обособления цитоплазмы клетки от оболочки вследствие частичной потери воды. 3. Переход молекул растворителя из области с высокой их концентрацией в область с низкой концентрацией через полупроницаемую мембрану. 4. Физическая величина, показывающая, какое количество теплоты необходимо сообщить телу, чтобы нагреть его на 1 °С. 5. Самый распространенный химический элемент Вселенной. 6. Потеря воды организмом. 7. Прибор для получения дистиллированной воды. 8. Самый распространенный химический элемент на Земле. 9. Переход вещества из жидкого состояния в твердое. 10. Процесс увеличения объема тела. 11. Твердое состояние воды. 12. Неорганическое вещество, образованное атомами металлов и кислотными остатками.
Ответы. 1. Раствор. 2. Плазмолиз. 3. Осмос. 4. Теплоемкость. 5. Водород. 6. Обезвоживание. 7. Дистиллятор. 8. Кислород. 9. Кристаллизация. 10. Расширение. 11. Лед. 12. Соль. [6-9, 11, 17-18].
3.2 Контрольные заданияПохожие работы
... и воспитания младших школьников нашли отражение в работах Л.П. Салеевой, И.К. Блиновой, В.М. Минаевой, А.А. Плешакова, А.Е. Тихоновой, А.А. Вахрушева, О.В. Бурского. Реальные возможности для формирования основ мировоззрения у младших школьников содержат курс «Окружающий мир», Программа “Зеленый дом” А.А.Плешакова, факультативы “Экология для младших школьников” и “Планета загадок”, Программа “ ...
... ценностных приоритетов в определении целей и содержания, форм и методов построения учебной деятельности учащихся. Одно из направлений методического обновления уроков в начальных классах – конструирование интегрированных уроков и проведение их на основе интеграции учебного материала с нескольких предметов, объединённого вокруг одной темы. Это междисциплинарная форма учебного процесса, которая ...
... разработанной программы кружка «Юный эколог», способствует значительному повышению экологической культуры школьников. Подготовка дипломной работы убедила меня в большой важности разработки специальной программы, направленной на повышение экологической культуры учащихся начальных классов сельских школ.Литература. Артамонов В.И. Редкие и исчезающие растения. – М.: Агропромидат, 1989. – 383с. ...
... признаки слова, наблюдать, как видовое понятие соотносится с родовым. Все это дается в интересной форме (52,13). Так же нами проводились наблюдения исследовательской работы по использованию интегрированных уроков в процессе обучения младших школьников чтения. Приступая к работе по изучению и исследованию опытов интегрированных уроков мы исходили из гипотезы, что если учебный материал по курсу ...
 Н20
Н20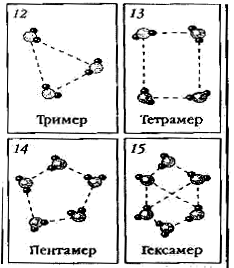
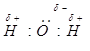

0 комментариев