Навигация
Семинарское занятие
3.3 Семинарское занятие
Решение задач
1. Углеводород А, который легче воздуха, присоединяет в присутствии хлорида ртути (II) хлороводород и превращается при этом в вещество В, которое при определенных условиях образует вещество С, имеющее тот же качественный и количественный состав, но гораздо большую относительную молекулярную массу. Приведите формулы веществ А, В, С. Напишите уравнение реакций.
Ответ: A - C2H2,, B - CH2=CHCl, C - (-CH2-CHCl-)n.
2. Составьте уравнение реакции полимеризации углеводорода C4H8 с разветвленным углеродным скелетом.
Ответ: n(CH3)2C=CH2→(-CH2-C(CH3)2-)n.
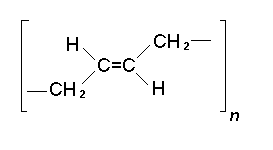
3. Напишите уравнение между бутадиеном и стиролом, приводящее к образованию полимера регулярного строения.
Ответ: nC6H5CH=CH2+nH2C=CH-CH=CH2→(-CH2-CH(C6H5)-CH2-CH=
=CH-CH2-)n.
4. Исходя из неорганических веществ, получите полимер с четырьмя атомами углерода в элементарном звене.
Ответ: CaO→CaC2→C2H2→HC º C-CH=CH2→H2C=CH-CH=
=CH2→(-CH2CH=CHCH2-)n.
5. Предложите способы получения из этанола двух полимеров с разным числом атомов углерода в элементарном звене.
Ответ: 1) C2H5OH→C2H4→(-CH2-CH2-)n;
2) C2H5OH→H2C=CH-CH=CH2→(-CH2-CH=CH-CH2-)n.
6. Органическое стекло представляет собой полимер метилового спирта метакриловой кислоты – простейшей непредельной карбоновой кислоты с разветвленным скелетом. Напишите уравнение реакции образования оргстекла.
Ответ: nCH2=![]() -COOCH3→
-COOCH3→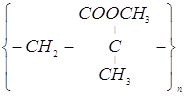
7. Какую массу каучука можно получить из 100 кг. 96%-ного этанола, если выход реакции Лебедева составляет 60%, а реакции полимеризации – 80%?
Ответ: 27 кг. каучука.
8. Определите среднюю степень полимеризации в образце бутадиенового каучука, средняя молярная масса которого равна 100000 г/моль. Изобразите структуру мономерного звена.
Ответ: 1850.
9. Сравните массовые доли углерода в полимере и мономере, если полимер получен в результате реакции: а) полимеризации;
б) поликонденсации с выделением воды. Ответ мотивируйте.
Ответ: а) массовые доли одинаковы;
б) в полимере массовая доля углерода больше.
10. Определите строение непредельного углеводорода с открытой цепью углеродных атомов, на полное каталитическое гидрирование 1,62 г. которого потребовалось 1,34 л. водорода (н.у.). Исходный углеводород широко используется в промышленности для производства каучука.
Ответ: бутадиен-1,3.
11. К 1,12 л. бесцветного газа (н.у.), полученного из карбида кальция, присоединили хлороводород, образовавшийся при действии концентрированной серной кислоты на 2,93 г. поваренной соли. Продукт присоединения хлороводорода полимеризовался с образованием 2,2 г. полимера. Какой полимер был получен? Каков выход превращения мономера в полимер (в % от теоретического)?
Ответ: 70,4% поливинилхлорида.
12. Определите среднюю степень полимеризации в образце природного каучука, средняя молярная масса которого равна 200 000 г/моль. Изобразите структуру мономерного звена.
Решение:
Природный каучук представляет собой полиизопрен, в котором большинство звеньев находится в цис-конфигурации. Получение каучука из изопрена можно представить как 1,4-присоединение:
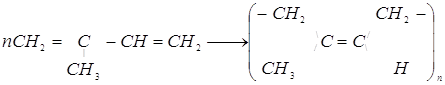 .
.
Каждое мономерное звено имеет молекулярную формулу С5Н8 и молярную массу 68 г/моль. В одной молекуле полимера в среднем содержится 200 000 /68=2940 мономерных звеньев.
Ответ: Степень полимеризации – 2940.
13. 28,2 г. фенола нагрели с избытком формальдегида в присутствии кислоты. При этом образовалось 5,116 г воды. Определите среднюю молярную массу полученного высокомолекулярного продукта реакции, считая, что поликонденсация протекает только линейно и фенол полностью вступает в реакцию.
Решение:
Уравнение линейной поликонденсации фенола и формальдегида можно записать следующим образом:
![]()
![]()
![]() OH
OH
![]()
![]()
![]()
![]()
![]()
![]()
![]() n +(n+1)CH2O
n +(n+1)CH2O ![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() OH OH OH
OH OH OH
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() CH2 CH2
CH2 CH2
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() +(n-1)H2O
+(n-1)H2O
n-2
Согласно этому уравнению отношение количеств воды и фенола равно (n-1)/n, что позволяет найти значение n. Количество веществ
v(C6H5OH)= =28,2/94=0,300 моль, v(H2O)=5,116/18=0,2842 моль.
v(H2O)/ v(C6H5OH)=0,2842/0,300=(n-1)/n,
откуда п =19. Молярная масса продукта конденсации равна:M=M(C6H4OH)+17. M(CH2C6H3OH)+M(CH2C6H4OH)=
=93+17.106+107=2002 г/моль.
Ответ: 2002 г/ моль.
14. Сколько тонн 2-метил-1,3-бутадиена можно получить из 180 тонн 2-метил-бутана, если выход продукта составляет в массовых долях 0,89, или 89%, по сравнению с теоретическим?
Решение:
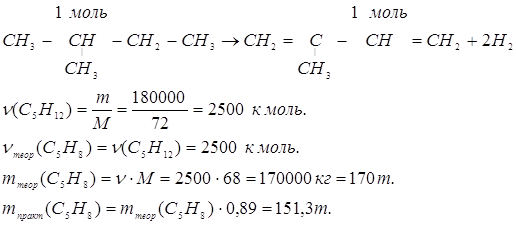
Ответ: 151,3 m 2-метил-1,3-бутадиена.
15. Сколько по объему 1,3-бутадиена можно получить из 800 л. раствора содержащего в массовых долях 0,96, или 96% этилового спирта (![]() г/см3)?
г/см3)?
Решение:
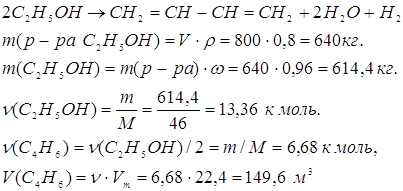
Ответ: 149,6 м3 бутадиена.
16. Составьте уравнение реакций, при помощи которых можно осуществить следующие превращения:
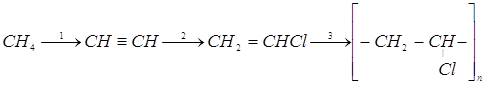
Ответ:
1) ![]()
![]()
2) 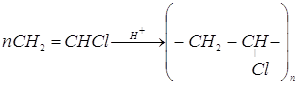
поливинилхлорид
17. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения и назовите продукты реакции:
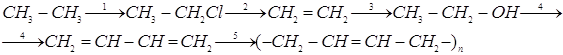
Ответ:
1) ![]()
2) ![]()
3)![]()
3) ![]()
4) ![]()
18. При полимеризации 140г изобутилена в присутствии серной кислоты был получен диизобутилен. Непрореагировавший изобутилен отогнали, а на диизобутилен подействовали бромом, причем было израсходовано 120г брома. Определите процент выхода диизобутилена.
Ответ: 60%.
19. Определите среднюю степень полимеризации в образце хлоропренового каучука, средняя молярная масса которого равна 120 000 г/моль. Изобразите структуру мономерного звена этого полимера.
Решение. Хлоропрен по строению напоминает изопрен, имея атом хлора на месте метильной группы изопрена. Полимеризация хлоропрена в положения 1,4 дает полимер:
n CH2=C–CH=CH2 → –CH2–C=CH–CH2–
 | |
| |
Cl Cl n
хлоропрен
хлоропреновый каучук Структура мономерного звена: –СН2−С=СН−СН2− |Сl
Молярная масса М (C4H5Cl)= 88,5 г/моль. Средняя степень полимеризации n = M (каучука)/ М (мономера) = 120000: 88,5 = 1356.
Ответ. n=1356 [39-42].
3.4 Контрольный срез знаний (1 рейтинговая точка) Тесты
1) К природным высокомолекулярным соединениям относится:
а. полиэтилен
б. глюкоза
в. сахароза
г. клетчатка (+)
2) Белковые молекулы из аминокислот образуются по реакции.
а. замещения
б. поликонденсации (+)
в. полимеризации
г. разложения
3) Какому классу синтетических высокомолекулярных соединений родственны в химическом отношении белки?
а. полиолефинам
б. поликарбонатам
в. полиамидам (+)
г. полиэфирамд. полиуретанам
4) Процесс соединения одинаковых молекул в более крупные молекулы:
а. поликонденсация
б. изомеризация
в. полимеризация (+)
г. гидратация
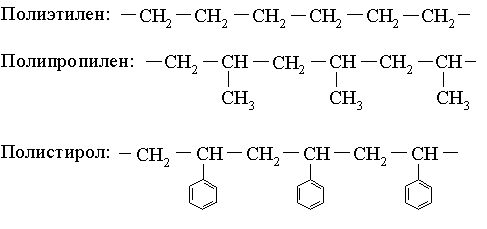
5). Структурным звеном полиэтилена является:
а. CH3-CH=CH2
б. –CH2–CH2– (+)
в. –CH–CH2–
|
СН3
г. СH2=CH2
6). Полиэтилен получают, используя реакцию
а. полимеризации (+)
б. поликонденсации
в. гидрирование
г. изомеризации
7). Элементарным звеном бутадиенового каучука является:
а.–CH2–CH=CH–CH2– (+)
б. CH2=CH–CH=CH2
в. –CH2–CH2–CH2–CH2–
г.–CH2–CH2–
8). Элементарное звено –CH2–CH2– имеется в макромолекулах:
а. бутадиенового каучука
б. полиэтилена (+)
в. полипропилена
г. бутадиенстирольного каучука
9). Высокомолекулярные соединения получают в результате:
а. гидролиза и этерификации
б. этерификации и поликонденсации
в. полимеризации и поликонденсации (+)
г. полимеризации и гидролиза
10). К биополимерам относятся:
а. белки (+)
б. капрон
в. натуральный каучук (+)
г. полистирол
д. сахароза
11). Структурное звено полипропилена:
а. CH3–CH=CH2
б. –CH2–CH2–
в. –CH–CH2– (+)
СН3
г.CH2=CH2
12). Полиэтилен получают реакцией полимеризации:
а. бутена
б. этана
в. изопропена
г. этена (+)
13). Элементарное звено –CH2−CH=CH−CH2− имеется в макромолекулах:
а. полиэтилена
б. бутадиенового каучука (+)
в. бутадиенстирольного каучука
г полистирола
14). Каучук получают, используя реакцию
а. этерификации
б. дегидрирование
в. «серебряного зеркала»
г. полимеризации (+)
д. поликонденсации
15). Формула мономера для получения полипропилена
а. CH3−CH=CH2 (+)
б. CH2=CH2
в. –CH-CH2
СН3
г.CH2=CH−CH=CH2
16). Какие полимеры обладают термопластичностью:
а. полистирол (+)
б. фенолформальдегидная смола
в. карболит
г. полиэтилен (+)
17). Мономер для получения полиэтилена:
а. CF2=CF2
б. CН2=CH−СН3
в.CH2=CH2 (+)
г.-CH2-CH2-
18). В результате реакции поликонденсации может образоваться:
а. полипропилен
б. полистирол
в. бутадиенстирольный каучук
г. фенолформальдегидная смола (+)
19). Первичные спирты могут использоваться:
а. в процессе крекинга
б. в реакциях полимеризации (+)
в. для получения сложных эфиров
г. для синтеза углеводов
20). Как называется процесс получения резины из каучука при нагревании его с серой:
а. поликонденсация
б. вулканизация (+)
в. окисление
г. гидрирование
21). Полимер, имеющий следующее строение
![]()
![]() Н СН3
Н СН3
\ ∕
С=С
∕ \
–СН2 СН2– n
Смешали с избытком серы и нагрели. Продукт реакции называется:
а. резина
б. стирол
в. эбонит (+)
г. изопреновый каучук
22). Для того чтобы началась реакция полимеризации, к мономеру добавляют пероксид водорода. Какую роль выполняет пероксид водорода?
а. катализатора
б. ингибитора
в. инициатора (+)
г. индикатора
23). Сырьем для промышленного производства ацетатного волокна служит:
а. целлюлоза (+)
б. натуральный каучук
в. лавсан
г. поливинилхлорид
24). Полимеризацией, какого вещества получают волокно капрон:
а. ацетилена
б. винилхлорида
в. капролактама (+)
г. 6-аминогексановой кислоты
25). Какое из данных веществ является полиэфирным волокном:
а. целлюлоза
б. лавсан (+)
в. ацетатное
г. хлопковое
26). К каким волокнам относится вискозное волокно:
а. растительного происхождения
б. синтетическим
в. животного происхождения
г. искусственным (+)
27). В чем растворяется натуральный шелк:
а. NaOH (10%) (+)
б. NaOH (5%)
в. HCl
г. ацетоне
28). Какую реакцию дают продукты разложения хлопка:
а. окрашиваются в желтый цвет
б. окрашивают синюю лакмусовую бумажку в красный цвет (+)
в. набухают
г. обесцвечивают раствор KMnO4
29). В чем не растворяется целлулоид:
а. бензоле (+)
б. феноле
в. HNO3
г. дихлорэтане (+)
30). Сополимеризацией каких веществ получают бутадиенстирольный каучук:
а. стирола и метилметакрилата
б. фенола и формальдегида
в.1,3-бутадиена и стирола (+)
г. этиленгликоля и терефталевой кислоты
31).Укажите название высокомолекулярных веществ природного происхождения:
а) крахмал +
б) полиэтилен
в) глюкоза
г) целлюлоза +
32). Какое волокно содержит амидную связь:
а) лавсан
б) ацетатное +
в) капрон
г) хлопковое
33). Натуральный каучук представляет собой:
а) цис- форму полибутадиена
б) транс- форму полиизопрена
в) транс- форму полибутадиена
г)) цис- форму полиизопрена +
34). Чему равна степень полимеризации полипропилена со средней мо лярной массой 100000 г/моль?
а) 2300
б) 2375
в) 2381 +
г) 2392
35). Какие из перечисленных волокон относятся к химическим?
а) хлопковое
б) вискозное +
в) лавсан +
г) шерстяное
36). Какие два вещества из перечисленных ниже взаимодействуют между собой с образованием мономера, используемого для получения волокна лавсан:
а) этиленгликоль +
б) глицерин
в) бензойная кислота
г) терефталевая кислота +
37). К синтетическим волокнам относятся:
а) льняное
б) лавсан +
в) капрон +
г) ацетатное
38). Укажите массовую долю хлора в поливинилхлориде (%):
а) 55,8
б) 56,8 +
в) 57,0
г) 58,8
39). Какой каучук называют дивиниловым:
а) изопреновый стереорегулярного строения
б) изопреновый с транс- формой макромолекул +
в) бутадиеновый стереорегулярного строения
г) бутадиеновый нерегулярного строения +
40).Волокно капрон представляет собой:
а) продукт реакции полимеризации аминокапроновой кислоты
б) продукт реакции сополимеризации этиленгликоля и терефталевой кислоты
в) продукт реакции поликонденсации 6- аминогексановой кислоты +
г) продукт реакции поликонденсации γ- аминокапроновой кислоты
41).Какой каучук получается при полимеризации 2- хлорбутадиена- 1,3?
а) дивиниловый
б) изопреновый
в) хлоропреновый +
г) бутадиеновый
42).Охарактеризуйте процесс вулканизации каучука
а) повышает прочность каучука +
б) является химическим процессом +
в) является физическим процессом
г) для этой цели используется сера +
43).Для получения искусственного волокна целлюлозу:
а) взаимодействием с хлором
б) взаимодействием с хлороводородом
в) обрабатывают азотной кислотой
г) обрабатывают уксусным ангидридом +
44).Сколько изопреновых звеньев должна содержать макромолекула натурального каучука при молярной массе, равной одному миллиону?
а) 16700
б) 15700
в) 14700 +
г) 14800
45).Средняя относительная молекулярная масса целлюлозы равна 586602. Рассчитайте степень поликонденсации макромолекулы:
а) 3550
б) 3601
в) 3621 +
г) 3653 [37-41].
Обсуждение результатов. Выводы
В эксперименте принимали участие ученики 11 классов МОУ СОШ-лицей № 4 и студенты 4 курса специальности «Химия» и (выборочная совокупность составляла 40 школьников и 31 студент).
В экспериментальных классах при раскрытии темы «Высокомолекулярные соединения» были проведены разработанные лекции и уроки, приведенные в главе III.
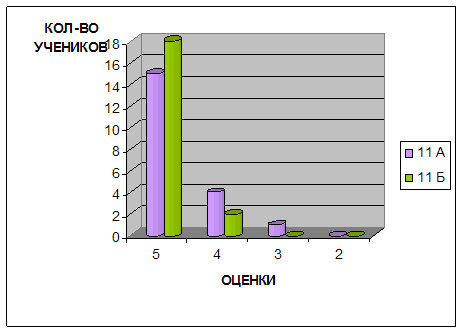
Для констатации результата после проведения разработанных занятий были проведены контрольные работы, которые приведены в главе III. Результаты эксперимента в школе приведены в диаграммах, отражающих изменения качества знаний и успеваемости в контрольном (11 б) и экспериментальном (11 а) классах.
Диагностику знаний студентов проводили на рейтинговом контрольном мероприятии с использованием специально разработанных тестов по теме проведенных экспериментальных занятий.
Разработанная лекция была прочитана на 4 курсе специальности «Химия» по дисциплине «Высокомолекулярные соединения», где 1 группа была экспериментальной, а 2 контрольной. Первое, что обращает на себя внимание при анализе изменения качества знаний – это более высокая успеваемость студентов экспериментальной группы по сравнению с контрольной. В таблице 1 представлены результаты усвоения материалов по теме «».
Таблица 1.
| Группа | Число опрошенных студентов | Процент баллированных оценок | Средний балл | |||
| Отлично | Хорошо | Удов-но | Неуд-но | |||
| Эксперимен- тальная | 25 | 23,7 | 38 | 31,5 | 1,0 | 4,2 |
| Контрольная | 21 | 7,2 | 34,3 | 26,7 | 22,6 | 3,27 |
Как видно из таблицы, в экспериментальной группе неуспевающих студентов не было, в то время как в контрольной группе процент неудовлетворительных оценок сравнительно высок – 22,6 %. Показателен и разброс оценок по баллам: подавляющее количество студентов экспериментальной группы имеют оценки в диапазоне «отлично-хорошо», в то время как в контрольной – большая часть оценок падает на диапазон «удовлетворительно-неудовлетворительно».
Таким образом, можно сделать вывод, что увеличение относительного вклада сведений о физических методах исследования в соответствующие разделы химии ВМС как в ВУЗе, так и школе позволит оптимизировать содержание и повысить качество учебно-воспитательной работы. предложенная в работе гипотеза, что свое подтвержднение в результате наших исследований.
Выводы
1. Показана возможность установления и использования связей с ФМИ при проведении занятий по курсу «Высокомолеклярные соединения» посредством проведения уроков-лекций;
2. Решена задача наполнения дисциплины «Высокомолекулярные соединения» знаниями о современных методах физических исследования полимеров путем использования заданий, задач, тестов;
3. Проведена апробация разработанных методик в школе-гимназии № 4 и на химическом факультете университета;
4. Оценен уровень сформированности знаний при изучении тем по разработанным методическим подходам;
5. Выявлено, что изучение химии высокомолекулярных соединений с применением знаний о современных физических методах исследования позволяет заметно повысить уровень знаний, научной культуры, уверенности в своих способностях студентов и школьников.
Литература
1. Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. В двух книгах: кн..1 – М.: Химия, 1990. -480с.
2. Пилипенко А.Т., Пятницкий И.В. Аналитическая химия. В двух книгах: кн..2 – М.: Химия, 1990. -480с.
3. Васильєв В.П. Аналитическая химия. В 2 ч. Ч. 2. Физико – химические методы анализа: Учеб. для Химко – технол. спец. вузов. – М.: Высш. шк., 1989. – 384с.
4. Шишловский А. А. Прикладная физическая оптика. М.: Физматгиз, 1961. - 811 с.
5. Оптические спектральные приборы. Л.: Энергия, 1975. - 136 с.
6. Толмачев Ю.А. Новые спектральные приборы. Принципы работы. Л.: ЛГУ, 1976. - 126 с.
7. И.Р.Шен. Нелинейная оптика. М.: Наука,1989.
8. . В.Демтредер. Лазерная спектроскопия. М.: Наука 1985.
9. Юинг Г. Инструментальные методы химического анализа / Пер. с англ. М.: Мир, 1989.
10. Булатов М.И., Калинкин И.П. Практическое руководство по фотометрическим методам анализа -5-е изд., перераб.- Л.:Химия, 1986. - 432 с.
11. Булатов М.И., Калинкин И.П. Практическое руководство по фотоколориметрическим и спектрофотометрическим методам анализа, изд. 4-е, пер. и доп., Л., «Хиимя», 1976,-376с.
12. Физические основы спектрального анализа. Райхбаум Л.Д., М.: Наука, 1980.
13. Рабек Я. Экспериментальные методы в химии полимеров.: в 2-х частях. – М.: Мир, 1983. – 384 с., 480 с.
14. В.В. Киреев. Высокомолекулярные соединения. М. Высшая школа, 1992.
15. Николаев А.Ф. Технология пластических масс. - Л.: Химия, 1977. 368 с.
16. Калинчев Э.Л., Саковцева М.Б. Свойства и переработка термопластов: Справочное пособие. - Л.: Химия, 1983. 288 с.
17. Тагер А.А. Физикохимия полимеров. - М.: Химия, 1978. 544 с.
18. Шур А.М. Высокомолекулярные соединения. - М.: Высшая школа, 1981. 656 с.
19. Тугов И.И., Кострыкина Г.И. Химия и физика полимеров. - М.: Химия, 1989. 432 с.
20. Папков С. П. Физико-химические основы переработки растворов полимеров. – М.: Химия, 1971.
21. Козлов П. В., Физико-химия эфироцеллюлозных пленок, Изд. «Искусство», 1948.
22. Козлов Л. В., Брагинский Г. И., Химия и технология полимерных пленок, Изд. «Искусство», 1965.
23. Чесунов В. М., Васенин Р. М., Высокомол. соед., А9, 2067 (1967).
24. Козлов Л. В., Брагинский Г. И., Химия и технология полимерных пленок, Изд. «Искусство», 1965.
25. Подгородецкий Е. К., Технология производства пленок из высокомолекулярных соединений, Изд. «Искусство», 1953.
26. Ultradur S. Plasty a kauc. – 1997. – v.34, № 10. – р.315.
27. Mapleston P. Glass filled PBTs have improved surface finish, reduced warpage. Mod. Plast. Int. – 1997. – v.27, № 3. – р.78.
28. Tashi M., Maiti S.N., Misra A., Mittal R.K. Polim. Compos. – 1994. – v.15, № 5. – р.349-358.
29. Сhu J., Sullivan J.L. Reciclabiliti of a glass fiber poly(butylenetere-phthalate)composite. Polym. Compos.. – 1996. – v.17, № 3. – р.523-531.
30. Шляпников Ю.А., Кирюшкин С.Г., Марьин А.П. Антиокислительная стабилизация полимеров. – М.: Химия, 1986. – 256 с.
31. Беллами Л. Инфракрасные спектры сложных молекул ИЛ, М.; 1963. С. 18.
32. Наканиси К. Инфракрасные спектры и строение органических соединений. “Мир”, М., 1965, с. 93.
33. Гурвич Я.А., Кумок С.Т. Промежуточные продукты, органические красители и химикаты для полимерных материалов. – М.: Высш. шк., 1989. – 304 с.
34. Рудзитис Г. Е., Фельдман Ф. Г. Химия: Органическая химия. Основы общей химии (Обобщение и углубление знаний):Учеб. Для 11 класса.-М.: Просвещение, 2004.- 160с.
35. Рудзитис Г. Е., Фельдман Ф. Г. Химия: 10-й класс.:Учеб. Для общеобразоват. учреждений. - М.: ООО «Издательство АСТ»: ООО «Издательство АСстрель», 2004.- 159с.
36. Хомченко Г.П. Пособие по химии для поступающих в вузы.- 3-е изд. Испр. И доп. М.:ООО Издательство Новая Волна», Издатель Умеренков, 2004.- 464с.
37. Гузей Л.С. и др. Химия, 11 класс/ Л.С. Гузей, Р.П. Суровцева, Г.Г. Лысова - М.: "Дрофа", 1999. -240c.
38. Патапов В. М., Татаринчик С. Н., Аверина А. В. Задачи и упражнение по органической химии. - М.: «Химия», 1997. - 144с.
39. Мовсумзаде Э.М. и др. Химия в вопросах и ответах с использованием ЭВМ./Э.М. Мовсумзаде, Г.А. Аббасова, Т.Г. Захарочкина. - М.: Высш. школа,1991. - 191с.
40. Кузьменко Н.Е., Еремин В.В. Химия. 2400 задач для школьников и поступающих в вузы.- М.: Дрофа, 1999.- 560 с.
41. Исидоров В.А. Экологическая химия: Учебное пособие для вузов. – СПб: Химиздат, 2001. – 304 с.
42. Селезнев А.В. Некоторые представления о свойствах поливинилхлорида и материалов на его основе // Экология и промышленность России.- 2001.- №11.- с. 35-37.
43. Микитюк А.Д. Обобщение сведений о реакциях полимеризации // Химия в школе.- 2002.- №4.- с. 56-62.
Похожие работы
... . И в следующей главе мы будем рассматривать, способы проведения уроков в школе по этой теме. ГЛАВА 3. ИЗУЧЕНИЕ СИНТЕТИЧЕСКИХ ВЫСОКОМОЛЕКУЛЯРНЫХ ВЕЩЕСТВ НА УРОКЕ ПО ХИМИИ В СРЕДНЕЙ ШКОЛЕ 3.1 План урока Урок 1. Тема урок. Понятие о высокомолекулярных соединениях Цель урока: Систематизировать и углубить знания учащихся о высокомолекулярных веществах. Задачи: 1. ввести понятия – мономер, ...
... информационной плотности, что весьма важно для развития современных технических средств записи, накопления и хранения информации. 7. Важнейшие открытия в химии XXI века 2001 Уильям Ноулз, Риоджи Нойори и Барри Шарплесс «За исследования, используемые в фармацевтической промышленности - создание хиральных катализаторов окислительно-восстановительных реакций». 2002 Джон Фенн и Койчи Танака «За ...
... питьевой воды на станциях водоподготовки и обеззараживания сточных и оборотных вод. Производительность свыше 100 кг. активного хлора в сутки более 100 тыс. кубометров воды в сутки. 3. Расчет экономической эффективности очистки технической воды: 3.1 Определение затрат труда 3.1.1. Определим оплату труда обслуживающего персонала в год Сп = Тм*aз*nм, где Тм – 167 часов –норма времент в ...
... . Эти качества придают ей ведущие принципы построения и организации современного научного знания: системность, глобальный эволюционизм, самоорганизация, историчность. Данные принципы построения современной научной картины мира в целом соответствуют фундаментальным закономерностям существования и развития самой Природы. Системность означает воспроизведение наукой того факта, что наблюдаемая ...
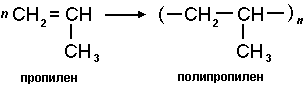
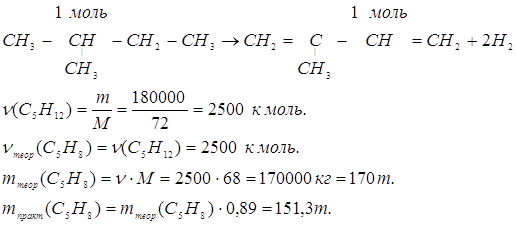

0 комментариев