Навигация
3.1.2 Алюминий
3.1.2.1 Распространение в природеПо своей распространенности алюминий среди элементов занимает третье место, среди металлов - первое. Он встречается главным образом в виде двойных силикатов, в полевых шпатах и слюдах и в продуктах их выветривания - глинах. В свободном состоянии алюминий никогда не встречается. Окись алюминия Al2O3 встречается в виде корунда и наждака. Из гидроокисей боксит AlO(OH) имеет наибольшее техническое значение в качестве основного исходного продукта для получения, Большое значение имеет также криолит Na3AlF6.
Из двойных силикатов следует отметить: калиевый полевой шпат или ортоклаз K[AlSi3O8] - главная составная часть изверженных пород: гранита, сленита, базальта, кальциевый полевой шпат или анорит Сa[Al2Si2O8], плагиоглаз, далее слюды: биотит, мусковый лепидалит, которые также содержатся в изверженных породах. Силикат алюминия, содержащий фтор - топаз, относится к числу драгоценных камней Al2(OH, F)2[SiO4] [9-11].
При выветривании полевых шпатов образуется каолин (фарфоровая глина), содержащий воду силикат алюминия состава Al2O3. 2SiO2. 2H2O.
3.1.2.2 Биохимическая рольСульфат алюминия Al2(SO4)3 используется в качестве протравы при крашении, для дубления кожи, в бумажном производстве. Сульфат алюминия применяют для очистки природных вод от коллоидных частиц, загрязняющих воду, которые захватываются гидроксидом алюминия, образующимся при этом гидролизе соли.
Алюминий имеет большое биологическое значение. Низкие концентрации ионов алюминия Al3+ стимулируют некоторые процессы жизнедеятельности растений. Например, прорастание семян. Но более высокие концентрации снижают интенсивность фотосинтеза, нарушают фосфорный обмен, задерживают рост корневой системы. Некоторые производные алюминия применяют в медицине. Например, KAl(SO4)2 служит вяжущим средством. Основной ацетат алюминия AlOH(COOCH3)2 используется для дезинфекции [9-11].
3.1.3 Галлий
3.1.3.1 Распространение в природеГаллий встречается в природе как спутник цинка во многих обманках, но только в исключительно малых количествах (0,002 % и меньше). В виде следов он встречается почти как постоянный спутник алюминия. В всех сортах технического алюминия его можно открыть спектрально. Самый богатый галлием минерал - германит. В нем содержится 0,6 - 0,7 % галлия [9].
3.1.3.2 Токсикологическая характеристика
Долгое время считалось, что галлий токсичен. Лишь в последнее время это мнение было опровергнуто. Легкоплавкость галлия представляет интерес для стоматологов. Еще в 1930 г. была испытана композиция для пломбирования зубов, в которой ртуть Hg была заменена на галлий. И в настоящее время используются пломбы для пломбирования зубов с использованием галлия [10].
3.2 V-A группа периодической системы 3.2.1 Круговорот азотаГазообразный N2 возникает в результате реакции окисления NHH3, образующегося при извержении вулканов и разложении биологических отходов:
4NH3 + 3O2 ® 2N2 + 6H2O.
Круговорот азота – один из самых сложных, но одновременно самых идеальных круговоротов. Несмотря на то, что азот составляет около 80% атмосферного воздуха, в большинстве случаев он не может быть непосредственно использован растениями, т.к. они не усваивают газообразный азот. Вмешательство живых существ в круговорот азота подчинено строгой иерархии: только определённые категории организмов могут оказывать влияние на отдельные фазы этого цикла. Газообразный азот непрерывно поступает в атмосферу в результате работы некоторых бактерий, тогда как другие бактерии – фиксаторы (вместе с сине-зелёными водорослями) постоянно поглощают его, преобразуя в нитраты. Неорганическим путём нитраты образуются и в атмосфере в результате электрических разрядов во время гроз.
Самые активные потребители азота – бактерии на корневой системе растений семейства бобовых. Каждому виду этих растений присущи свои особые бактерии, которые превращают азот в нитраты. В процессе биологического цикла нитрат-ионы (NO3-) и ионы аммония (NH4+), поглощаемы растениями из почвенной влаги, преобразуются в белки, нуклеиновые кислоты и т.д. Далее образуются отходы в виде погибших организмов, являющихся объектами жизнедеятельности других бактерий и грибов, преобразующих их в аммиак. Так возникает новый цикл круговорота. Существуют организмы, способные превращать аммиак в нитриты, нитраты и в газообразный азот. Основные звенья круговорота азота в биосфере представлены схемой на рис. 10.
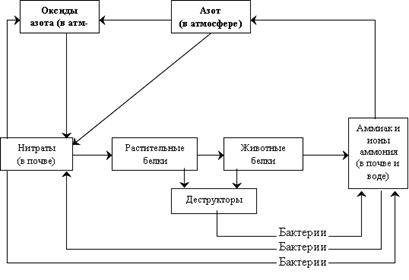
Рис. 10. Круговорот азота
Биологическая активность организмов дополняется промышленными способами получения азотосодержащих органических и неорганических веществ, многие из которых применяются в качестве удобрений для повышения продуктивности и роста растений.
Антропогенное влияние на круговорот азота определяется следующими процессами:
1. Сжигание топлива приводит к образованию оксида азота, а затем реакциям:
2NO + O2 ® 2NO2 ,
4NO2 + 2H2O + O2 ® 4HNO3,
способствуя выпадению кислотных дождей;
2. В результате воздействия некоторых бактерий на удобрения и отходы животноводства образуется закись азота – один из компонентов, создающих парниковый эффект;
3. Добыча полезных ископаемых, содержащих нитрат-ионы и ионы аммония, для производства минеральных удобрений;
4. При сборе урожая из почвы выносятся нитрат-ионы и ионы аммония;
5. Стоки с полей, ферм и из канализаций увеличивают количество нитрат-ионов и ионов аммония в водных экосистемах, что ускоряет рост водорослей и других растений; при разложении последних расходуется кислород, что приводит к гибели рыб. [12]
3.2.3 Соединения азота
Оксид азота(I) относительно инертен, а потому «экологически нейтрален». Однако на человека он оказывает наркотическое действие, начиная от просто веселья (за что он и был прозван «веселящим газом») и, заканчивая глубоким сном, что нашло свое применение в медицине. Интересно, что он безвреден, и для медицинского наркоза применяют смесь оксида азота(I) с кислородом в таком же соотношении, что и соотношение азота и кислорода в воздухе. Наркотическое действие снимается сразу после прекращения вдыхания этого газа.
Два других устойчивых оксида азота легко переходят один в другой, затем в кислоты, а затем в анионы NO2- и NO3-. Таким образом, эти вещества представляют собой естественные минеральные удобрения, если находятся в естественных количествах. В «неестественных» количествах эти газы редко попадают в атмосферу в одиночестве. Как правило, образуется целый «букет» ядовитых соединений, которые действуют комплексно.
Например, всего один завод азотных удобрений выбрасывает в воздух кроме оксидов азота, азотной кислоты, аммиака и пыли от удобрений еще и оксиды серы, соединения фтора, некоторые органические соединения. Ученые выясняют устойчивость различных трав, кустов и деревьев к подобным «букетам». Уже известно, что, к сожалению, ель и сосна неустойчивы и быстро погибают, однако белая акация, канадский тополь, ивы и некоторые другие растения могут существовать в таких условиях, более того, они способствуют удалению из воздуха этих веществ.
Сильное отравление оксидами азота можно получить в основном при авариях на соответствующих производствах. Ответная реакция организма будет разной из-за различия в свойствах этих газов. «Едкий» NО2 в первую очередь действует на слизистые оболочки носоглотки, глаз, вызывает отек легких; NО, как малорастворимое в воде и не едкое вещество, проходит через легкие и попадает в кровь, вызывая нарушения в центральной и периферийной нервных системах. Оба оксида реагируют с гемоглобином крови, результат – гемоглобин перестает переносить кислород.
Экологические свойства азотной кислоты складываются из двух «половинок». Как сильная кислота, она разрушающе действует не только на живые ткани (кожу человека, лист растения), но и на почву, что достаточно актуально – кислотные (из-за присутствия оксидов азота и серы) дожди, увы, не редкость. При попадании кислоты на кожу возникает химический ожог, который болезненнее и заживает значительно дольше, чем термический. Это были основные экологические свойства катиона водорода.
3.2.3.1 Взаимодействие нитрат-иона с фауной и флоройНитрат-ион – неотъемлемая часть круговорота азота в природе. В обычных условиях и в разбавленных растворах устойчив, слабо проявляет окислительные свойства, не осаждает катионы металлов, тем самым способствуя транспортировке этих ионов с раствором в почве, растениях и т. п.
Нитрат-ион становится ядовитым только в больших количествах, нарушающих баланс других веществ. Например, при избытке нитратов в растениях уменьшается количество аскорбиновой кислоты. (Стоит напомнить, что живой организм настолько тонко организован, что любое вещество в больших количествах нарушает равновесие и, следовательно, становится ядовитым.)
Растения и бактерии используют нитраты для построения белков и других необходимых органических соединений. Для этого надо перевести нитрат-ион в ион аммония. Эта реакция катализируется ферментами, содержащими ионы металлов (меди, железа, марганца и др.). Из-за гораздо большей ядовитости аммиака и иона аммония в растениях хорошо отработана и обратная реакция перевода иона аммония в нитрат.
Животные не умеют строить все необходимые им органические соединения из неорганических – отсутствуют соответствующие ферменты. Однако микроорганизмы, живущие в желудке и кишечнике, этими ферментами обладают и могут переводить нитрат-ион в нитрит-ион. Именно нитрит-ион и действует как отравитель, переводя железо в гемоглобине из Fe2+ в Fe3+.
Соединение, содержащее Fe3+ и называемое метгемоглобином, слишком прочно связывает кислород воздуха, следовательно, не может отдавать его тканям. В результате организм страдает от недостатка кислорода, при этом происходят нарушения в работе мозга, сердца и других органов.
Обычно нитрит-ион образуется не в желудке, а в кишечнике и не успевает перейти в кровь и произвести все эти разрушения. Поэтому отравления нитратами достаточно редки. Существует, правда, и другая опасность: в нашем организме есть много веществ, в которых атомы водорода аммиака замещены на органические радикалы. Такие соединения называют аминами. При реакции аминов с нитрит-ионами образуются нитрозамины – канцерогенные вещества:

Они действуют на печень, способствуют образованию опухолей в легких и почках. Интересно, что активным замедлителем реакции образования нитрозаминов является давно нам знакомая аскорбиновая кислота [4, 11-14].
ГЛАВА 4. МЕТОДИЧЕСКИЕ РАЗРАБОТКИ ПО ТЕМЕ «р-ЭЛЕМЕНТЫ» 4.1 Урок на тему «III-А группа периодической системы химических элементов Д. И. Менделеева»
Занятие 1. Характеристика химических элементов III-а группы периодической системы
Алюминий
Основные цели. Формирование основополагающих понятий, умений и навыков. Характеристика химических элементов III-a группы периодической системы. Строение атома, физические и химические свойства, применение и получение алюминия.
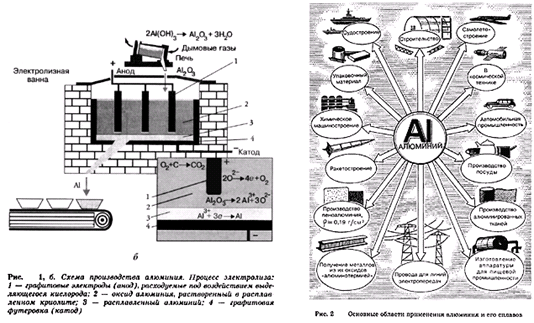
Оборудование. Периодическая система химических элементов, рис. 2, 1 б.
Вещества. Алюминий.
|
| Основное содержание | Формы обучения | Методы обучения | Средства обучения |
| 1. Актуализация знаний, умений и навыков учащихся. 1) Перечислите химические элементы IIIa группы периодической системы в порядке усиления их металлических свойств. | Рис. 2 | ||
| 2) Электронная формула внешнего энергетического уровня 3s23p1 принадлежит атому: а) бора; б) алюминия; в) галлия; г) таллия. | |||
| 3) Перечислите физические и химические свойства и области применения алюминия, используя рис. 21.3 | |||
| 2. Получение алюминия | Рис. 1, б | ||
| 3. Подведение итогов |
Краткое сообщение на тему «Металлы III группы с точки зрения химика-эколога»
Опросить учащихся.
Информация о домашнем задании. § 50 ([3]). Напишите уравнения реакций, при помощи которых можно осуществить превращения веществ:

Самоанализ урока
Занятие 2. Оксиды и гидроксиды алюминия
Основные цели. Формирование основополагающих понятий, умений и навыков. Углубить знания учащихся об амфотерности оксидов и гидроксидов. Аквакомплексы, гидроксокомплексы, химизм производства алюминия электролизом оксида алюминия.
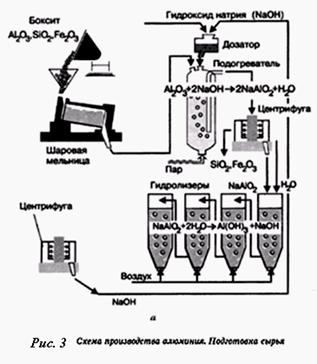
Оборудование. Схема производства алюминия (процесс электролиза), штатив с пробирками, рис. 1, а.
Вещества. Растворы AlCl3, NaOH, H2SO4.
ХОД ЗАНЯТИЯ
| Основное содержание | Формы обучения | Методы обучения | Средства обучения |
| 1. Амфотерность оксида алюминия | |||
| 2. Запись уравнений реакций взаимодействия оксида алюминия с гидроксидом натрия и азотной кислотой | |||
| 3. Амфотерность гидроксида алюминия. Запись ионных уравнений реакций. Разбор образования аква- и гидроксокомплексов. Сверить запись уравнений реакций с домашним заданием. Коллоидные частицы | Лабораторный опыт 21 | ||
| 4. Разбор химизма образования гидроксида алюминия в производстве алюминия | рис. 3 | ||
| 5. Подведение итогов |
Сообщение на тему «Экологические аспекты переработки алюминийсодержащих руд»
Опросить учащихся.
Информация о домашнем задании. § 50; таблица 21.1 ([13, 28]).
Самоанализ урока
Занятие 3. Гидролиз солей алюминия
Основные цели. Формирование основополагающих понятий, умений и навыков. Расширить знания о гидролизе солей. Применение гидролиза солей.
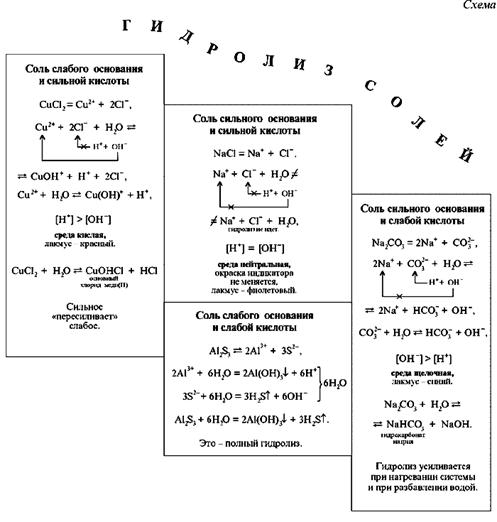
Оборудование. Штатив с пробирками, схема «Гидролиз солей».
Вещества. Растворы сульфата или хлорида алюминия, лакмусовая бумага (лакмус) синяя, фиолетовая.
ХОД ЗАНЯТИЯ
| Основное содержание | Формы обучения | Методы обучения | Средства обучения |
| 1. Актуализация знаний, умений и навыков учащихся об амфотерности оксида и гидроксида алюминия | |||
| 2. Гидролиз солей алюминия: а) анализ результата опыта; б) запись ионных уравнений проделанного опыта; в) вывод | Лабораторный опыт 22(1) | Схема «Гидролиз солей» | |
| 3. Выполнение задания. Напишите уравнения реакций, при помощи которых можно осуществить превращения веществ:
| |||
| 4. Подведение итогов |
Опросить учащихся
Информация о домашнем задании. § 50 ([13-15]).
Самоанализ урока.
4.1.1 Экологические аспекты преподавания темы «Азот. Соединения азота»Знать: важнейшие свойства и применение азота, аммиака, оксидов азота, азотной кислоты, нитратов; важнейшие минеральные удобрения, условия их рационального хранения и использования; устройство прибора для получения аммиака в лабораторных условиях; качественные реакции на нитрат-ионы и ион аммония; химические реакции, лежащие в основе производства аммиака и азотной кислоты, условия их осуществления; общие научные принципы химического производства.
Уметь: давать характеристику подгруппе элементов; составлять уравнения изученных реакций, рассматривать их с точки зрения окислительно-восстановительных и ионных представлений; определять на практике нитрат-ионы, а также ион аммония; решать комбинированные задачи.
Основные понятия: донорно-акцепторный механизм образования связи, ион аммония, несолеобразующий (безразличный) оксид, селитры, удобрения (туки), азотистый ангидрид, азотный ангидрид, нитриды.
Контрольные вопросы
1. Каково строение атома азота?
2. Каковы возможные валентности и степени окисления азота?
3. Где в природе встречается азот?
4. Как получают азот в лаборатории и в промышленности?
5. Каковы физические свойства азота?
6. Каковы химические свойства азота? Напишите уравнения реакций.
7. Где применяется азот?
8. Каково строение молекулы аммиака? Какой тип химической связи в молекуле NH3?
9. Как образуется донорно-акцепторная связь в ионе аммония?
10. Почему аммиак способен окисляться?
11. Каковы физические свойства аммиака?
12. Как аммиак взаимодействует с водой и кислотами?
13. Какие два способа окисления аммиака вам известны? Приведите уравнения соответствующих реакций.
14. Где применяется аммиак?
15. Почему соли аммония схожи с солями калия?
16. Какова растворимость в воде солей аммония?
17. Как получают аммиак в лаборатории и на производстве? Составьте уравнения реакций получения NH3.
18. Каковы общие свойства солей аммония? Напишите уравнения реакций.
19. Каковы специфические свойства солей аммония? Подтвердите свой ответ уравнениями реакций.
20. Какова качественная реакция на соли аммония? Составьте уравнение реакции.
21. Какие оксиды азота вам известны?
22. Как можно получить монооксид азота? Каковы его физические свойства?
23. Как можно получить диоксид азота? Каковы его физические свойства?
24. Как диоксид азота взаимодействует с водой и щелочами? Напишите уравнения реакций.
25. Каковы физические свойства азотной кислоты?
26. Каково строение молекулы азотной кислоты?
27. Каковы валентность и степень окисления азота в азотной кислоте?
28. Как можно получить азотную кислоту? Приведите уравнение реакции.
29. Почему азотная кислота является сильным окислителем?
30. Как азотная кислота взаимодействует с металлами?
31. Какие газообразные вещества могут выделяться при восстановлении азота в азотной кислоте?
32. Какие металлы не взаимодействуют с концентрированной азотной кислотой? Почему?
33. Как взаимодействуют с разбавленной азотной кислотой медь и серебро? Напишите уравнения реакций.
34. В какой таре можно хранить азотную кислоту?
35. Как разлагается азотная кислота?
36. Как взаимодействуют неметаллы с азотной кислотой? Приведите уравнения реакций.
37. Какие еще соединения азота вам известны?
38. Как называют соли азотной кислоты? Каковы их физические свойства?
39. Какие нитраты являются удобрениями?
40. Какие способы получения нитратов вам известны? Составьте уравнения реакций.
41. Как могут разлагаться нитраты при нагревании? Напишите уравнения реакций разложения KNO3, Cu(NO3)2 и AgNO3.
42. Почему нитраты могут быть окислителями?
43. Как отличить нитраты от других солей?
44. Какие вещества называют удобрениями?
45. Какие виды удобрений вам известны?
46. Перечислите важнейшие удобрения каждой группы.
47. Какие элементы составляют семейство азота?
48. Как изменяются свойства элементов группы Vа и их соединений с увеличением атомного номера? Почему?
Рассмотрим в качестве примера разработки некоторых уроков по теме «Производство азотной кислоты».
4.1.2 Урок по теме «Получение азотной кислоты»Цель урока: Рассмотреть процесс получения азотной кислоты в лабораторных условиях, изучить и закрепить химизм процесса.
Приборы и материалы: штатив, реторта, воронка, тубус, резиновая пробка, чашка с холодной водой, печь или спиртовка
Реактивы: концентрированная серная кислота, 15-20 г. нитрата натрия.
ХОД УРОКА
Собрать прибор по рисунку 3. В реторту поместить 15-20 г NaNO3 и прилить через воронку, вставленную в тубус столько концентрированной H2SO4, чтобы она покрыла соль. Закрыть тубус стеклянной или резиновой пробкой и опустить конец реторты в сухую колбу, помещенную в чашку с холодной водой. Осторожно нагревать реторту. Когда в приемнике соберется несколько миллилитров кислоты, нагревание прекратить и, дав реторте охладиться, разобрать прибор. Кислоту сохранить для следующих опытов. Объяснить появление у нее окраски..
Остерегаться попадания HNO3 на одежду или на руки: она быстро разрушает ткань, а на руках появляются желтые пятна и ожоги.
Написать уравнение реакции:
H2SO4 + NaNO3 ® HNO3 + NaHSO4
Вопросы: Почему реакция проводят при несильном нагревании?
Сделайте вывод о проведенной работе[16-19].
Похожие работы
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
... виды связей, тогда как синхронные резко ограничены, а во внутрипредметных связях синхронный вид вообще отсутствует. 2. Планирование и осуществление межпредметных связей в процессе обучения. Разработка теоретических основ межпредметных связей в учебной теме сточки зрения раскрытия ее ведущих положений дает возможность применить механизм выявления и планирования межпредметных связей к ...
... и дидактические основы организации обучения позволяют более доступно объяснять изучаемый материал на уроках физики при изучении темы «Основы электродинамики». Анализ различных технологий позволил составить авторскую технологию развития у учащихся направленности на диалогическое общение при групповой форме обучения. От того, на сколько правильно будет построен процесс обучения при использовании ...
... с этим возникает необходимость рассмотрения вопроса взаимосвязи молекулярной физики и химии в курсе средней школы. При изучении молекулярной физики взаимосвязь ее с химией проявляется в двух главных направлениях. Первое из них заключаются в использовании знаний учащихся, полученных ими в процессе изучения химии в качестве материала для доказательства основных положений молекулярной физики. Второе ...
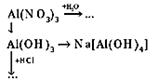
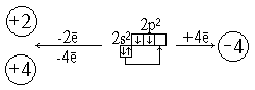
0 комментариев