Навигация
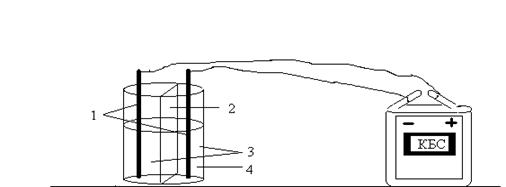
На начало опыта электроды должны быть погружены в раствор наполовину
1. На начало опыта электроды должны быть погружены в раствор наполовину.
2. Сделать отчет по форме:
а) запись уравнения реакции;
б) схема опыта;
в) полученный результат.
Перед проверкой выполненного каждой группой учащихся лабораторного эксперимента учитель физики на одной из опытных установок (на первой парте, например) меняет полюса подключения источника тока к угольным электродам, предварительно показав катод всем учащимся, обратив внимание на его характерную окраску. Поочередно спрашивает результат, полученный каждой группой при выполнении эксперимента. Затем включает кодоскоп, и учащиеся сравнивают свои результаты с записями на пленке кодоскопа, записывают общий вывод в тетрадь:
масса вещества выделяемого на электродах зависит от напряжения, концентрации раствора, температуры, расстояния между электродами, площади электродов (слайд 6)
Учитель химии: Вы экспериментально подтвердили, что с помощью электролиза можно получать разные вещества, в частности, медь. В промышленности электролизом получают и другие металлы, например алюминий.Далее следует сообщение учащегося о получении алюминия в промышленности (приложение 2).
Демонстрационный эксперимент
Учитель физики: посмотрим на результат нашего эксперимента по замене полярности угольных электродов. (Отключает установку и достает электрод, который был покрыт медью. Учащиеся убеждаются, что электрод стал чистым). Формулируется вывод: медь, осевшая на катоде, прореагировала, когда он стал анодом.
Вопрос: Что произойдет, если анод будет из меди?
Учитель химии: Тогда процессы для раствора сульфата меди (II) будут следующими (слайд 8):
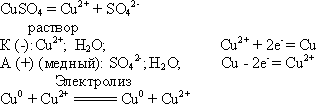
Учащиеся записывают все в тетрадь. Учитель сообщает, что электролиз с растворимым анодом применяют для очистки металлов. Этот способ называется электролитическим рафинированием (приложение 3).
IV. Решение задач. (10 минут)
Учитель физики: переходим к следующей части занятия – решению задач. Вызывает к доске двух учащихся, которые решают задачи: № 1 и №2. Остальные учащиеся решают задачу № 3 в тетради (приложение 4).Один из учащихся решает задачу № 3 на пленке кодоскопа для последующей проверки.
После разбора задач-примеров, решенных на доске и задачи на пленке кодоскопа, учащимся предлагается выполнить самостоятельную работу по решению задач (уровень сложности задачи ученик может выбрать сам (приложение 4)
V. Самостоятельная работа. (25 минут) (приложение 4)
VI. Подведение итогов урока. (8 минут)
Учитель физики проводит собеседование с учащимися по вопросам (слайд 9):
-что сделано?
-что повторили?
-что узнали нового?
Далее выставляется итоговая оценка каждому учащемуся в лист «Результатов и достижений учащихся».
VII. Домашнее задание. (2 минуты)
Учитель химии комментирует домашнее задание.
Литература к уроку:
1. Касьянов В.А. Физика. 11 кл.: Учебник для общеобразоват. учреждений. - М.: Дрофа, 2007.
2. Рымкевич А.П. Физика. Задачник. 10-11 кл.: Пособие для общеобразоват. учеб. заведений. - М.: Дрофа, 2004.
3. Общая химия: учебник для 11 кл. общеобраз. учреждений с углубл. изуч. химии/ Габриелян О.С.и др. - М: Просвещение ,2006.
Урок 2. «Электролиз»
Цели:
- дать представление об электролизе как окислительно-восстановительном процессе;
- научить составлять схемы анодного и катодного процессов, о также уравнения электролиза;
- раскрыть значение электролиза для получения различных веществ.
Оборудование: лист фронтальной работы, ряд активности.
Ход урока.
I. Актуализация знаний.
1) Предложите способ получения Zn из ZnS.
(фронтально, 1 человек у доски).
2) Беседа после выполнения задания.
- Какой способ применяется для получения Zn из ZnS?
- В чем сущность пирометаллургического способа получения металлов?
- Какие еще способы получения металлов вам известны?
- В чем их сущность?
- А какой способ вы можете предложить для получения Na?
( идет обсуждение применения одного из известных способов)
- Почему ни один из известных вам способов не подходит для получения Na?
- Какие еще металлы нельзя получить известными вам способами?
II. Изложение нового материала.
Получить активные металлы удалось только после открытия электричества и сегодня мы познакомимся с этим способом получения. Тема урока: «Электролиз».
1) Беседа.
- Какие вещества называются электролитами?
- За счет чего электролиты проводят электрический ток?
- Как катионы и анионы электролитов движутся в растворе или расплаве при обычных условиях?
- А что произойдет, если в раствор или расплав электролита погрузить электроды и пропустить электрический ток?
+ катионы движутся к катоду –
- анионы движутся к аноду +
- К / Кn+ + ne ------------ K0 / восстановление
+А / An- -ne ------------- A0 / окисление
Электролиз – это окислительно – восстановительный процесс, протекающий на электродах при прохождении электрического тока через раствор или расплав электролита.
Пример 1.
NaCl р-в = Na+ + Cl-
-K / Na+ +1e = Na0 / 2 / восстановление
+A / 2Cl- - 2e = Cl20 / 1 / окисление
2NaCl электролиз 2Na + Cl2
Восстановительное и окислительное действие электрического тока во много раз сильнее действия самых сильных химических окислителей. Электролиз водных растворов протекает иначе, чем в расплавах.
Пример 2.
NaCl р-в = Na+ + Cl-
- K / 2H2O + 2e = H20 + 2OH- / 1 / восстановление
+A / 2Cl- - 2e = Cl20 / 1 / окисление
2NaCl + 2H2Oэлектролиз2NaOH +H2 + Cl2
- Почему же в растворах электролиз протекает иначе, чем в расплавах?
III. Работа с фронтальным листом
Задание: заполнить пропуски по ходу объяснения.
а) Правила восстановления катионов на катоде.
Ряд активности металлов:
Li, K, Ba, Ca, Na, Mg, Al, / Be, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, P, H2, / Sb, Cu, Hg, Ag, Pt, Au
I II III
I группа – активные металлы – не восстанавливаются, вместо них восстанавливается вода.
II группа – менее активные металлы – восстанавливаются вместе с водой.
III группа – неактивные металлы – восстанавливаются.
б) Правила окисления анионов на аноде.
Cl-, Br-, S2-, I- и другие бескислородные анионы – окисляются.
SO42-, NO3-, PO43-, CO32- и другие кислородсодержащие анионы - не окисляются, вместо них окисляется вода.
- K / 2H2O + 2e = H20 + 2OH- / 2 / восстановление
+А / 2H2O - 4e = O20 +4H+ /1 / окисление
в) Выполните задание.
- Составьте схему анодного и катодного процессов и уравнение электролиза следующих электролитов с комментариями:
1) CuSO4 р-р;
2) К2СО3 р-р;
3) СаBr2 р-в.
Вывод! Электролиз – это_______________, он применяется для_________________.
IV. Закрепление.
Работа с тестом. (5 минут).
Тест по теме: «Электролиз».
Вариант 1.
1. При электролизе водного раствора какого вещества происходит разложение воды на кислород и водород?
1) NaCl, 2) CuSO4, 3) Na2SO4, 4)AgNO3.
2. При электролизе водного раствора какого вещества не происходит разложения воды на кислород и водород?
1) NaOH, 2) MgSO4, 3) MgCl2, 4) KOH.
3. Установите соответствие между формулой вещества и продуктами электролиза его водного раствора
Формула вещества Продукты электролиза
1) KOH A) H2, O2.
2) CuSO4 Б) H2, Cl2.
3) K3PO4 B) K, H2, O2.
4) KCl Г) K, Cl2.
Д) Cu, O2.
E) Cu, O2, SO2.
4. Установите соответствие между формулой вещества и коэффициентом перед ней в уравнении электролиза раствора.
CH3COONa + H2O = C2H6 + CO2 + NaOH + H2
Формула вещества Коэффициент
1) CH3COOH A) 1
2) C2H6 Б) 3
3) NaOH B) 2
4) H2 Г) 4
Д) 0
5. Установите соответствие между металлом и источником его электролитического получения.
Название металла Источник
1) Натрий А) Расплав нитрата
2) Магний Б) Раствор гидроксида
3) Медь В) Расплав хлорида
4) Свинец Г) Расплав оксида
Д) Раствор оксида в расплавленном
криолите
Е) Водный раствор солей.
9. Домашнее задание. & 8, упр. 2 (б), сообщение «Применение электролиза».
10. Приложение.
Лист фронтальной работы по теме: «Электролиз»
Задание: заполнить пропуски по ходу объяснения.
а) Правила восстановления катионов на катоде.
Ряд активности металлов:
Li, K, Ba, Ca, Na, Mg, Al, / Be, Mn, Zn, Cr, Fe, Cd, Co, Ni, Sn, P, H2, / Sb, Cu, Hg, Ag, Pt, Au
I II III
I группа –____________– не восстанавливаются, вместо них восстанавливается вода.
II группа –______________– восстанавливаются вместе с водой.
III группа________________– восстанавливаются.
б) Правила окисления анионов на аноде.
______________________________________- окисляются.
____________________- не окисляются, вместо них окисляется вода.
Катодный и анодный процесс, протекающий с участием воды:
- K / 2H2O + 2e = H20 + 2OH- / 2 / восстановление
+А / 2H2O - 4e = O20 +4H+ /1 / окисление
в) Выполните задание.
Составьте схему анодного и катодного процессов и уравнение электролиза следующих электролитов с комментариями:
1) CuSO4 р-р;
2) К2СО3 р-р;
3) СаBr2 р-в.
Вывод! Электролиз – это__________, он применяется для____________[5,6].
ЛИТЕРАТУРА
1. Кузнецова Л.М., Дронова Н.Ю., Евстигнеева Т.А. К методике изучения химической кинетики и химического равновесия // Химия в школе. – 2001. – № 9. – с.7.
2. Кузнецова Н.Е. Методика преподавания химии: Учеб. пособие для студентов пед. ин-тов по хим. и биол. спец. – М.: Просвещение, 1984. –415 с., ил.
3. Кузнецова Н.Е. Формирование систем понятий при обучении химии. – М.: Просвещение, 1989. – 144 с.
4. Чернобельская Г.М. Методика обучения химии в средней школе: Учеб. для студ. высш. учеб. заведений. – М.: Гуманит. изд. центр ВЛАДОС, 2000. – 336 с.
5. Шелинский Г.И. Насущные вопросы формирования важнейших химических понятий химии на начальном этапе обучения // Химия в школе. – 2001. – № 5. – с.17.
6. Стабалдина С.Т. Принципы и законы диалектики в обучении химии // Химия в школе. – 2003. – № 7. – с.16.
Похожие работы
... "ОВР" можно свести в единую схему [13] , которая отражает их взаимосвязь (таблица 3). Таблица 3. Понятия об окислительно-восстановительных реакциях Умения пользоваться химическим языком I группа II группа Относительная электроотрицательность исление1восстановление1 степень окисления окисление2 восстановление2 окислитель восстановитель единство окисления и восстановления ОВР ...
... пособие по прикладной химии «Задачи по теоретическим основам химической технологии», составленное по материалам представленной работы. 3. Методика решения задач по теоретическим основам химической технологии Одна из главных задач химической науки и промышленности - получение необходимых человеку веществ (продуктов, материалов). Поэтому большинство учебных химических задач снизано с ...
... выше, нежели в предыдущем. Пищевые продукты, выращенные и полученные при соблюдении необходимых условий, обычно характеризуются допустимым содержанием ртути [17]. Глава III. МЕТОДИЧЕСКИЕ РАЗРАБОТКИ ПО ТЕМЕ «ЭЛЕМЕНТЫ II ГРУППЫ ПЕРИОДИЧЕСКОЙ СИСТЕМЫ Д.И.Менделеева» Эксперимент начался со знакомства с ученическим коллективом. При этом для получения представления об успеваемости класса по химии ...
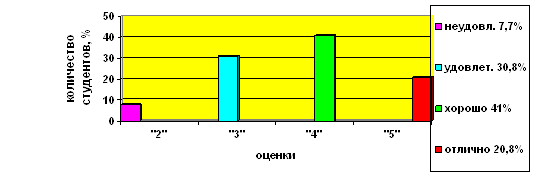
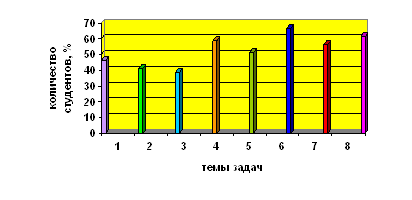
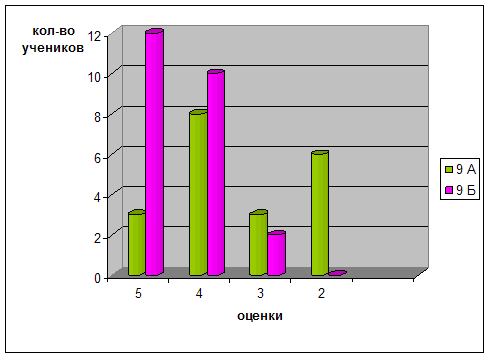
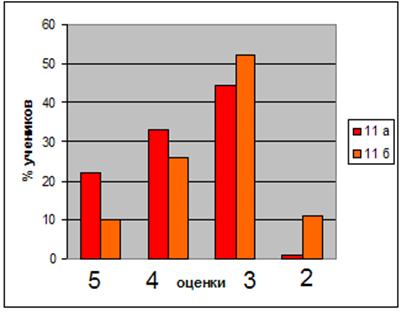
... учащихся Диаграмма 2. Динамика успеваемости и качества обучения Таким образом, можно сделать вывод, что предложенная в работе гипотеза, что разработка и реализация новых методических подходов к изучению темы «Бериллий» позволят заметно повысить уровень знаний, научной культуры, уверенности в своих способностях школьников нашла свое подтверждение в результате наших исследований. ЛИТЕРАТУРА ...


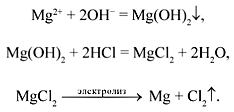

0 комментариев