Навигация
Перенос генов, опосредованный ДНК
4. Перенос генов, опосредованный ДНК
4.1 Введение
В настоящее время разработано большое количество методов для введения клонированных последовательностей ДНК в клетки млекопитающих. Среди них преципитация фосфатом кальция или DEAE-декстраном, электропробой, использование инактивированных вирусов и слияние прокариотических и дрожжевых протопластов с клетками млекопитающих. Наиболее широкое распространение получила преципитация фосфатом кальция. Точный механизм захвата ДНК, ее включения в реципиентную клетку непонятен, однако известно, что лишь небольшое количество клеток в культуре реципиентов включают ДНК. По аналогии с бактериальной генетикой эти клетки получили название «компетентных». Количество включаемой ДНК – важнейшая характеристика используемой клеточной линии. Мышиные L-клетки включают несколько миллионов пар оснований экзогенной ДНК, человеческие фибробласты – только часть этого количества. Было проведено несколько экспериментов по выявлению максимальных размеров ДНК, передаваемой неповрежденной. Обычно не удается перенести интактную ДНК, размеры которой превышают 100 т. п. н. Неизвестно, зависит ли это от свойств клеток-реципиентов или определяется трудностями в получении таких больших фрагментов ДНК интактными. Недавние успехи в получении высокомолекулярных фрагментов ДНК позволяют проанализировать оба этих варианта.
4.2 Трансфекция ДНК с использованием фосфата кальция
Таблица. Растворы для DMGT
| Среда для роста клеток | Используйте низкофосфатную среду для роста |
| клеток, такую, как DMEM | |
| Селективная среда | |
| 2хНереэ-буфер | рН очень важен и должен быть проверен, если |
| раствор длительно хранился | |
| рН 7,1±0,05 | 50 мМ Hepes |
| 290 мМ хлорида натрня | |
| 1,5 мМ фосфата натрия (равное количество гидро- | |
| и дигидрофосфата) | |
| 1XHBS | 25 мМ Hepes |
| 145 мМ хлорида натрия | |
| 0,75 мМ фосфата натрия (равное количество гидро- | |
| 1,25 М хлорид кальция | и дигидрофосфата) |
| Раствор для глицерино- | 15% глицерина в 1XHBS |
| вого шока |
4.3 Совместный перенос и предварительная селекция
Известно, что компетентные клетки способны включать большое количество донорной ДНК, причем одна реципиентная клетка может включать несколько разных молекул донорной ДНК в один геномный сайт. Этот феномен позволяет выделять компетентные субпопуляции из общей массы реципиентных клеток и маркировать геном млекопитающих. Если донорная ДНК смешана с плазмидной, кодирующей селективный для клеток млекопитающих маркер, селекция по плазмидному гену после трансфекции позволяет выделить популяцию трансфицированных клеток. Такое обогащение облегчает дальнейшую очистку реципиентных клеток. Этот прием оказался успешным при клонировании генов, кодирующих клеточные поверхностные антигены. В данном случае для обогащения использовали антитела, а для разделения субпопуляций клеток флуоресцентный сортер.
В реципиентных клетках ДНК плазмиды, содержащей селективный маркер, лигируется с донорной геномной ДНК. Это приводит к «маркированию» последовательности ДНК клетки млекопитающего и может упростить выделение донорного гена после нескольких повторных трансфекции.
В опытах по котрансфекции мы использовали смесь из 1 мкг плазмидной и 20 мкг геномной ДНК. Смесь готовили непосредственно перед добавлением хлорида кальция.
4.4 Возможные ошибки и варианты методики
Не все клетки способны к трансфекции геномной ДНК с высокой частотой. Одни клетки вообще не трансфицируются, другие, например человеческие фибробласты, способны эффективно включать плазмидную ДНК и почти не включать геномную ДНК – Мышиные L-клетки обладают способностью к трансфекции геномной ДНК с высокой частотой и могут быть использованы в качестве положительного контроля в экспериментах по трансфекции ДНК новыми клеточными линиями. Возможно, что альтернативные способы прямого включения геномной ДНК, такие, как электропробой или липосомный перенос, смогут расширить список клеточных линий, способных к трансфекции. В противовес общепринятому мнению мы получали хорошие результаты по трансфекции L-клеток, используя преципитацию, при которой образовывался осадок как в виде слабо опалесцирующей суспензии, так и в форме агрегатов. Тем не менее, конечно, предпочтительнее соблюдать условия, при которых формируется гомогенный осадок.
Глицериновый шок увеличивает частоту трансфекции в 2– 5 раз. Оптимальные условия проведения шока для разных клеток варьируют. В каждом новом случае необходимо подбирать как концентрацию глицерина, так и время инкубации.
Похожие работы
... : генный, хромосомный и геномный. На каждом из них проявляются основные свойства материала наследственности и изменчивости и определенные закономерности его передачи и функционирования. 4. Генный уровень организации генетического аппарата Элементарной функциональной единицей генетического аппарата, определяющей возможность развития отдельного признака клетки или организма данного вида, ...
... , доступные генетическому анализу — это прежде всего скорость и полнота лизиса инфицированных клеток и круг бактерий-хозяев, поражаемых фагами. Широкое распространение в генетическом анализе бактериофагов получили мутанты с условным проявлением. Это мутанты, чувствительные к повышению и понижению температуры, — так называемые термочувствительные (ts) и холодочувствительные (cs). Они нормально ...
... 1972 год, когда в Стенфордском университете П. Берг и С. Коэн с сотрудниками создали первую рекомбинантную ДНК, содержавшую фрагменты ДНК вируса SV40, бактериофага и E. coli. Генетическая инженерия Одним из разделов молекулярной генетики и молекулярной биологии, который нашел наибольшее практическое приложение, является генная инженерия. Генная инженерия – это сумма методов, позволяющих ...
... остатки, соединяющиеся водородными связями с комплементарными основаниями матричной цепи. Рост синтезирующейся цепи происходит в направлении 3'-ОН — 3'-ОН-концам, антипараллельно матричной цепи. Репликация ДНК приводит к удвоению количества генетического материала клетки и, как правило,— к клеточному делению. Поэтому репликация происходит тем чаще, чем короче время генерации вируса или бактерии и ...
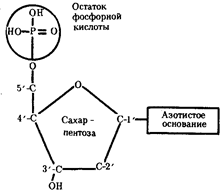
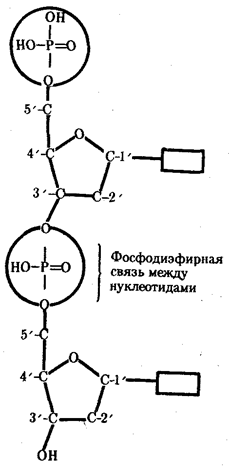
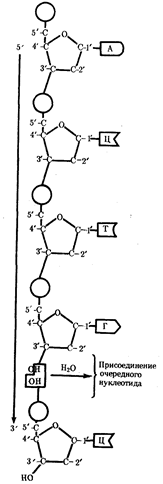
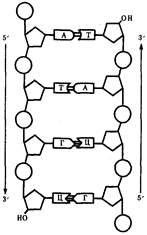
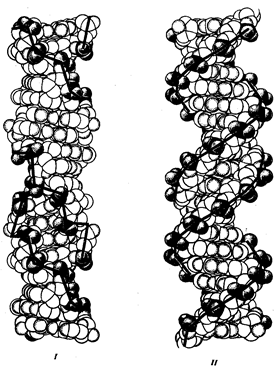
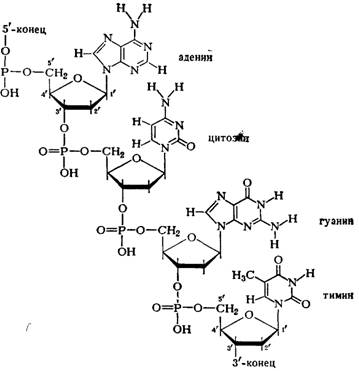
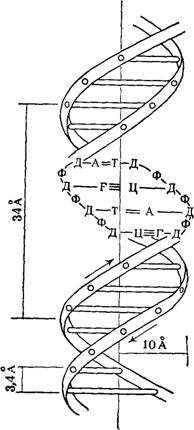
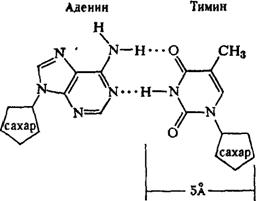
0 комментариев