Навигация
Определение общего количества микроорганизмов (КОЕ)
2.2.9 Определение общего количества микроорганизмов (КОЕ)
Сущность метода заключается в определении в 1 см3 воды общего содержания мезофильных аэробов и факультативных анаэробов при культивировании на синтетической питательной среде при температуре 40 °С в течении 24 часов. Определение начинают с приготовления разведений. Для этого в несколько пробирок наливают 10 см3 стерильной воды. В первую пробирку стерильной пипеткой добавляют 1 см3 исследуемой воды. Новой стерильной пипеткой вносят пробу в пробирку со стерильной водой, после чего этой же пипеткой набирают 1 см3 из приготовленного разведения и переносят во вторую, из второй в третью и т. д. Из каждой пробы делают посев не менее двух различных объемов, выбранных с таким расчетом, чтобы на чашках выросло от 30 до 300 колоний. По истечении 24 часов при температуре 40 °С подсчитывают число выросших колоний. Если выросло большое количество колоний, то дно чашки делят на секторы и подсчет ведут в каждом отдельном секторе. Результаты подсчета выражают в количестве бактерий на 1 см3 анализируемой воды с учетом посеянного объема.
2.2.10 Определение мутности
Мутность определяют фотометрическим методом при длине волны 540 нм и толщине поглощаемого слоя 30 мм. Определение мутности проводят до процесса высаливания. При этом исходный раствор отфильтровывают от жира. Стандартным раствором является дистиллированная вода.
2.2.11 Определение кислотности
10 см3 исследуемой жидкости вносят в коническую колбу емкостью 100-250 см3 и титруют 0,1 н раствором едкого натра в присутствии индикатора фенолфталеина до слабо-розовой окраски.
Реакция протекает по схеме:
СН3СООН + NаОН = СН3СООNа + Н2О
Содержание органической кислоты (К), г/дм3 определяют по формуле (1):
а × к ×0,006 ×1000
![]() К = = а × к ×0,6 , (1)
К = = а × к ×0,6 , (1)
10
где К – содержание кислоты, г/дм3;
а – количество 0,1 н раствора щелочи, израсходованной на титрование, см3;
к – поправка к титру едкого натра;
0,006 – количество уксусной кислоты, соответствующей 1 см3 0,1 н раствора гидроксида натрия.
2.2.12 Определение активной реакции среды
Активная реакция среды, т.е. степень ее кислотности или щелочности, характеризуется качественно концентрацией водородных ионов. Концентрацию ионов водорода выражают величиной рН.
Величину рН определяют потенциометрическим методом при помощи потенциометра со стеклянными электродами.
Перед началом измерений прибор включают в сеть при помощи тумблера и дают нагреваться в течение 20 минут.
Электроды перед погружением в раствор тщательно промывают дистиллированной водой и просушивают фильтровальной бумагой .
Вначале измерение проводят по шкале от 0 до 14 (грубое определение), а затем переключают прибор на более узкий интервал.
Перед измерением рН сточную воду хорошо перемешивают и измеряют температуру для введения необходимых поправок.
2.2.13 Биуретовый метод определения белка по Ярош
Метод используется в растворах белков с концентрацией от 0,04 до 1,6 мг/см3.
Необходимые реактивы. Биуретовый реактив – в мерную колбу на 1 дм3 наливают 400 см3 0,2н раствора NaOH, добавляют 9г калия-натрия виннокислого, перемешивают до полного растворения, добавляют 3г сульфата меди (порошка) и 5г йодистого калия, объем доводят до метки 0,2н раствором NaOH; раствор мочевины – к 300г мочевины (карбамида) прибавляют кусочек тимола величиной с горошину, приливают 700 см3 дистиллированной воды и смесь нагревают, затем прибавляют 3г активного угля, перемешивают фильтруют в мерную колбу на 1 дм3, объем доводят до метки дистиллированной водой.
Техника определения. В пробирку наливают 2,4см3 раствора мочевины, 0,1см3 раствора белка и 2,5см3 биуретового реактива. Смесь хорошо перемешивают и пробирки помещают в водяную баню при температуре 40оС на 10 минут. Затем их охлаждают до 20оС. Через 30 минут после добавления биуретового реактива раствор колориметрируют на ФЭК при длине волны 540нм. Количество белка находят по калибровочной кривой, составленной по яичному альбумину.
Для построения калибровочной кривой готовят исходные водные растворы с содержанием 10, 20, 30, 40, 50, 60 мг белка в 10см3. Из полученных растворов отбирают в пробирки по 0,1см3, добавляют 2,4см3 раствора мочевины и 2,5см3 биуретового раствора и ведут определение описанным выше методом. Калибровочный график представлен на рисунке 3
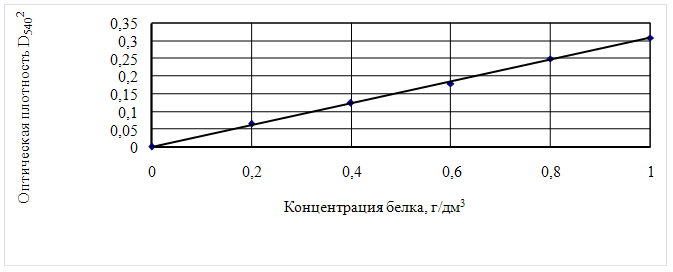
Рисунок 3 – Калибровочный график зависимости оптической плотности от содержания белка
Похожие работы
... HAC. 3.1 Изучение морфолого-физиологических и культуральных свойств микроорганизмов Целью данного этапа эксперимента являлось выделение, изучение свойств микроорганизмов и определение их видовой принадлежности. Исследуемые культуры были выделены из сточной воды после эмульсионного обезжиривания меховой овчины. Изучаемые культуры были обозначены номерами 3,7, F, G, I, Iў. Получение чистых культур ...
... в составе липидов кроме обычных кислот, своеобразные, характерные только для этих микроорганизмов миколовые кислоты, представляющие собой высокомолекулярные b-гидроксикислоты с длинной алифатической цепью в a-положении. ЖКС липидов мицелиальных грибов во многом идентичен составу растительных масел. В связи с этим грибные липиды могут найти применение в различных отраслях народного хозяйства ( ...
... использования экстрактивных веществ хмеля разработана технология производства молотого брикетированного хмеля, позволяющая уменьшить расход хмеля на 15%. Применяют так же и хмелевые экстракты в соотношении 1:1. (В.М. Бондаренко, 1959). 3 Выделение чистой культуры дрожжевых грибов В зависимости от программы исследований выбирают тот или иной метод отбора образцов, позволяющий либо только ...
... других видов, которые лизируются (разрушаются) и используются ими внутри колонии, а остатки выбрасываются. Хищные бактерии чаще обитают в илах водоёмов. Пищевые отравление немикробного происхождения, их характеристика Пищевыми отравлениями следует считать такие заболевания, которые вызываются употреблением в пищу продуктов или кулинарных изделий, получивших токсические свойства в результате ...

0 комментариев