Навигация
Выделение, изучение свойств микроорганизмов и их использование для выполнения подготовительных процессов переработки овчинно-мехового сырья
ДИПЛОМНАЯ РАБОТА
"Выделение, изучение свойств микроорганизмов и их использование для выполнения подготовительных процессов переработки овчинно-мехового сырья"
Введение
В связи с производственной активностью увеличивается антропогенное воздействие на окружающую среду. Особо остро данный вопрос стоит в Байкальском регионе, вследствие этого требуется корреляция экономической деятельности предприятий с предполагаемым уровнем техногенного воздействия на окружающую среду. Снижение объемов и токсичности сточных вод достигается либо созданием современных методов очистки и утилизации, либо совершенствованием технологии. Наиболее оптимальным является последний способ, который позволяет при сохранении качественных параметров выпускаемой продукции значительно снизить уровень токсического загрязнения. Это можно достигнуть не только уменьшением расхода используемых ингредиентов в технологических процессах, но и замене высокотоксичных веществ на менее токсичные.
Основными загрязнителями на предприятиях меховой промышленности являются синтетические поверхностно-активные вещества (СПАВ). Данные ингредиенты широко применяются для удаления жировых веществ с поверхности волосяного покрова. Сточные воды, содержащие СПАВ, трудно поддаются биодеструкции и, попадая в водоемы вредно влияют на биоценоз и могут вызвать гибель высокоорганизованных организмов.
Решение данной проблемы возможно через внедрение экологически безопасных технологий, основанных на биотехнологических методах. Одним из способов, позволяющих сохранить качество мехового полуфабриката при снижении степени загрязнения сточных вод, является проведение совмещенного микробиологического и эмульсионного методов обезжиривания.
В связи с этим, целью данной работы являлось получение концентрированного ферментного препарата, изучение его свойств и проведение на его основе процесса обезжиривания меховой овчины.
1. Литературный обзор. Механизм воздействия прокариотических микроорганизмов на спав и липазу
Представители рода Pseudomonas настолько широко распространены в природе, что их можно назвать вездесущими. Такое распространение основано на способности усваивать самые разнообразные по природе соединения и расти в различных экологических условиях /1/.
Повсеместное распространение Pseudomonas в природе обеспечивается способностью этих микроорганизмов расти в широких диапазонах температур, при высоком гидростатическом давлении, выдерживать полное обезвоживание. Некоторые из представителей этого рода могут находиться в анаэробных условиях, другие осуществляют дыхание в присутсвии цианида. Двуокись углерода в повышенных количествах подавляет рост гетеротрофных псевдомонад, но служит источником углерода для автотрофных видов этого рода. Для роста разных видов Pseudomonas могут служить самы различные среды, начиная с дистиллированной воды до сложных сред, включающих вещества животоного и растительного происхождения и производные нефти. Среди Pseudomonas найдены виды с высокой осмофильностью и галофильностью. Далеко не все из известных видов Pseudomonas подробно исследованы. Физиолого-биохимическое изучение многих видов Pseudomonas, оставшихся пока вне поля зрения исследователей, несомненно даст много новых фактов о приспособляемости микроорганизмов к разнообразным условиям обитания /2/.
Псевдомонады способны расщеплять синтетические поверхностно-активные вещества (СПАВ). Легкость расщепления СПАВ, в частности алкил- и арилсульфатов, объясняется, по-видимому, тем, что в природных условиях в почве широко распространены холин-о-сульфат, который входит в состав клеток бактерий и используется ими как источник серы после расщепления сульфогидралазой. Также ПАВ очень сильно влияют на микроорганизмы /3/.
1.1 Действие ПАВ на микроорганизмы
Специфические свойства ПАВ, в первую очередь их способность к солюбилизации и образованию мицелл, обуславливает их активность этих соединений по отношению к различным биологическим объектам. Они могут действовать совместно с бактерицидами и при мицеллярных концентрациях инактивировать вещества путем их солюбилизации. Если рассматривать биологические мембраны как сложные двойные соли с гидрофобным ядром и гидрофильным окружением, то логично предположить, что молекулы ПАВ будут взаимодействовать с ними. В этом отношении микроорганизмы представляют собой уникальную модель, с помощью которой можно изучать действие ПАВ как на структурные компоненты клетки (клеточную стенку, мембраны), так и на протекание процессов обмена веществ /4/.
Исследование действия ПАВ на клетки микроорганизмов невозможно без достаточной информации о строении самого объекта. Наиболее удобной для понимания рассматриваемой проблемы представляется схема, предложенная в 1984 году австралийским ученым А. Виккеном. Она составлена с учетом присутствия в клеточных стенках бактерий соединений, обладающих амфифильными свойствами, т.е. наиболее вероятных «мишеней» для действия ПАВ /5/.
Гидрофильные компоненты бактериальных амфифилов являются обычно заряженными большими молекулами, что можно проиллюстрировать на примере липополисахаридов грамотрицательных (Гр-) бактерий и липотейхоевых кислот у грамположительных (Гр+). Клетки бактерий дифференцируют на грамположительные и грамотрицательные в зависимости от их способности или неспособности окрашиваться в темно-фиолетовый цвет при использовании метода, предложенного в 1884 г. Грамом. Эти свойства, в свою очередь, обусловлены особенностями строения клеточных стенок бактерий /6/.
Внутренняя часть бислоя внешней мембраны грамотрицательных бактерий содержит фосфолипиды (ФЛ), протеины (Пр), липополипротеины (Лпр), которые образуют ковалентное окружение пептидогликанового слоя, лежащего над плазматической мембраной. В верхней части внешнего мембранного бислоя находятся липополисахаридные молекулы – гладкие (ЛПС) и шероховатые (РЛПС), а также гаптенные (ЭОА) и иммуногенетические (ЭОА – РЛПС) формы. Плазматическая мембрана грамположительных бактерий представлена состоящей из протеинов (Пр), фосфолипидов (ФЛ), гликолипидов (ГЛ), в верхней части – из ацилированных липотейхоевых кислот (аЛТК), чьи гидрофильные полиглицерофосфатные цепи пронизывают матрикс клеточной стенки, выходя на поверхности бактериальной клетки. Молекулы так называемых «транзитных» ЛТК могут находиться только в верхнем слое клеточной стенки и обнаруживаются в составе выделяемых комплексов. Полисахариды (ПС) также выделяются в среду, где идентифицируют комплексы трех типов: М1 – состоящие из мембранных липидов; М2 – из аЛТК, белков ФЛ и ПС; М3 – из аЛТК и белков. Если же схематически изображать структуру приведенных выше амфифилов, где четко выделяются гидрофобные (заштрихованные) и гидрофильные (заряженные) части молекул, то станет очевидным общее структурное сходство природных амфифилов с синтетическими ПАВ. Более того, бактериальные амфифилы способны образовывать мицеллярные агрегаты аналогично ПАВ. Бактерии же различных групп существенно различаются своими амфифилами как вкачественном, так и в количественном отношениях. Не удивительно, что одно и то же ПАВ оказывает зачастую неадекватное воздействие на различные бактерии. Эффекты такого рода, по-видимому, являются причиной большого числа предполагаемых механизмов действия ПАВ на клетки микроорганизмов. Основными методами оценки действия ПАВ на бактерии, определяющими, в свою очередь, тот или иной гипотетический механизм, являются электронная микроскопия, идентификация и количественный анализ отдельных компонентов (макромолекул) клеточных стенок, мембран либо содержимого цитоплазмы.
Первые электронно-микроскопические исследования по изучению влияния детергентов на клеточные стенки бактерий проводились американскими учеными А. Митчелом (1947) и М. Солтоном (1951), которые показали, что детергенты способны дезинтегрировать бактериальную клеточную стенку. В настоящее время электронная микроскопия является единственным средством, дающим наиболее полное представление о событиях, происходящих при взаимодействии ПАВ с клеточной поверхностью /7/.
В качестве конкретного примера рассмотрим делящиеся клетки характерной формы, легко обнаруживаемые во всех препаратах. После выдерживания бактериальной суспензии в буферном растворе, содержащем тритон Х-100, наблюдается отторжение цитоплазматической мембраны от клеточной стенки. Это явление наблюдали ряд авторов при обработке клеток других грамположительных бактерий холатами, цетилтриметиламмонийбромидом, и, вероятно, оно типично для большинства ПАВ. К особенностям, характеризующим их воздействие на бактериальную клетку, относится также изменение лучепропускаемости цитоплазмы: она становится темной, внутриклеточные структуры – неразличимыми. В дальнейшем наступает разрыв клеточной стенки и высвобождение цитоплазмы в окружающую среду. Заметное искажение поверхности цитоплазматической мембраны свидетельствует о взаимодействии ПАВ с мембраной, которое, очевидно, приводит к дезинтеграции последней и «рассасыванию» цитоплазматического содержимого. Подтверждению этому служит обнаруженный клеточный каркас с характерными разрывами, через которые могла произойти «утечка» цитоплазматического материала. При детальном исследовании установлено, что фрагментация клеточной стенки бактерий может происходить, во-первых, на участке перегородки, растущей в направлении к центру, и, во-вторых, сразу в нескольких местах. Соответственно можно предположить два возможных механизма действия тритона Х-100 на поверхность клеток пропионовокислых бактерий. В первом случае чувствительным к детергенту оказывается участок клеточной стенки, где обычно локализуются специфические ферменты, которые вследствие первоначальных изменений в структуре клеточной стенки, вызванных ПАВ, могут каким-то образом активироваться и способствовать ее дезинтеграции. Подобное явление наблюдалось при изучении влияния цетилтриметиламмонийбромида на клеточную стенку стафилококков. Во втором случае подходящей мишенью для тритона Х-100 мог служить белок неизвестной природы, встречающийся в клеточных стенках пропионовокислых бактерий. Учитывая тот факт, что некоторые белки в клеточных стенках грамположительных бактерий занимают отдельные участки, такой механизм кажется вполне приемлемым /8/.
В результате проведенных электронно-микроскопических исследований установлено, что взаимодействие ПАВ с поверхностью грамположительной бактериальной клетки можно разделить на несколько этапов.
1. Адсорбция ПАВ, по-видимому, первоначально происходит на участках, где его сродство с амфифильным фрагментом клеточной стенки является наибольшим. Затем следует взаимодействие молекул (или мицелл) ПАВ с белками, образующими поры, (поринами), что приводит к существенным структурным изменениям в порах бактериальной стенки. В результате нарушается ее проницаемость, а вследствие этого – сокращается цитоплазма.
2. Солюбилизирующая способность ПАВ в дальнейшем проявляется в виде частичной дезинтеграции клеточной стенки, позволяющей молекулам детергента проникать глубже в клетку и непосредственно контактировать с цитоплазматической мембраной. Обнаружены различия в дезинтегрирующем действии тритона Х-100 на делящиеся и покоящиеся клетки. В первом случае дезинтеграция клеточной стенки всегда происходит на участке перегородки, растущей к центру клетки, причем процесс активируется в результате перестроек в клеточной стенке, наступающих после действия ПАВ. Во втором случае клеточная стенка фрагментируется по участкам, которые, вероятно, содержат белковые компоненты.
3. На заключительной стадии действия ПАВ наблюдается «утечка» цитоплазматического содержимого из оставшегося клеточного каркаса, что позволяет предположить наличие в клеточных экстрактах соединений, синтезируемых данными микроорганизмами /9/.
Удалось также выяснить, что процесс взаимодействия ПАВ с поверхностью бактерий затрагивает такие важные моменты структурно-функционального единства живой клетки, как проницаемость, взаимосвязь амфифильных компонентов в поверхностных слоях и мембранах, а также целостность третичной и вторичной структур белков /10/.
Методом сканирующей электронной микроскопии установлена картина дезинтегрирующего действия 1%-го додецилсульфата натрия (ДСН) на клетки пропионовокислых бактерий. Это ПАВ в течение 1 ч инкубации с бактериальными клетками приводит их к лизису и фрагментации клеточных стенок с образованием высокомолекулярных агломератов.
Чрезвычайно разнообразны данные /4/, касающиеся воздействия ПАВ на клеточные стенки бактерий и полученные на основании биохимических экспериментов без помощи электронной микроскопии. Установлено, что механизм действия ПАВ на изолированные клеточные стенки различных грамотрицательных бактерий заключается во взамиодействии детергента с липидами, липопротеинами и липополисахаридными фрагментами клеточных стенок, а не в действии на разрыв дисульфидных (-S-S-) связей, как полагалось ранее.
При обработке клеток E.coli лизоцимом и версеном в течение 30–45 с в ледяной бане они становятся чувствительными к литическому действию неионогенного детергента бридж-58. Степень лизиса зависит от концентрации детергента. Эффективность действия этого НПАВ в тысячу раз меньше, чем ДСН и ДОХ. Разрушение клеток под воздействием ПАВ зависит от концентрации ионов магния в среде, ионной силы и времени лизиса. В присутствии Mg2+, концентрация которого составляет 70 мМ, из клеток выходят только низкомолекулярные РНК и растворимые белки, а при концентрации 40 мМ 70 S субъединицы и рибосомные фрагменты выделяются вместе с растворимым материалом. При более низких концентрациях Mg2+ в экстракционном растворе обнаруживаются полирибосомы, а при падении ее ниже 5 мМ из клеток выходит ДНК. Предполагаемый механизм действия НПАВ на клеточные стенки и мембраны можно представить следующим образом. Поверхность клетки является своеобразным молекулярныи ситом с порами, размер которых зависит от концентрации Mg2+ и ионной силы окружающей среды. Можно также предположить, что местом действия НПАВ является слой клеточных стенок бактерий /11/.
В условиях, при которых ДСН и тритон Х-100 полностью, а бридж-58 частично растворяют клеточную стенку E.coli, лаурилсаркозилат вызывает избирательную диссоциацию цитоплазматической мембраны (ЦПМ). Наличие ионов магния при обработке клеточных стенок препятствует растворению цитоплазматической фракции лаурилсаркозилатом. Тритон Х-100 в этих условиях растворял только ЦПМ и не действовал на наружную мембрану.
Изучено влияние солей KCl, NaCl, NH4Cl, (NH4)2SO4 на антимикробную активность неионных ПАВ, в частности по отношению к стафилококкам. Механизм действия одновалентных катионов в это случае связан с воздействием ПАВ на клеточную стенку способностью конкурировать с антимикробными агентами. Установлено, что мутант стафилококков, дефектный по липолисахаридам, имеет повышенную чувствительность к дезоксихолату и таким КПАВ, как гексадецилпиридинхлорид, бензаммонийхлорид. Присутствие большого количества липополисахаридов и белков с фосфолипидом на внешней мембране являются решающим фактором, который определяет устойчивость грамотрицательных микроорганизмов к детергентам. В отношении устойчивости к ПАВ бактерий-деструкторов, например псевдомонад к ДСН, полагают, что большая устойчивость штамма-деструктора по сравению с мутантным штаммом (не способным разрушать ДСН) обусловлена не столько наличием специфических ферментов, разрушающих ПАВ, сколько особенностями биохимического состава клеточной стенки /5/.
Ряд авторов /12/ отмечают также, что «молодые» бактериальные клетки, выращенные на полноценной питательной среде, Устойчивее к действию ДСН, чем клетки более поздней фазы роста. Существенное значение также заряд клеточной поверхности. При щелочном значении рН на поверхности клетки уменьшается число положительно заряженных групп, в соответствии с этим снижается и количество сорбированного на поверхности ПАВ за счет электростатического притяжения гидрофильной части молекулы ДСН, несущей отрицательный заряд. Вследствие этого количество ПАВ на поверхности обусловлено теми гидрофобными участками, с которыми взаимодействует алкильная часть молекулы ДСН. Таким образом, ПАВ способны взаимодействовать с различными компонентами клеточных стенок бактерий, включая муреиновый слой, белки, липиды, липопротеины, липолисахариды. Проникновение ПАВ внутрь клеток, если оно затруднено пространственными или электростатическими факторами, может происходить и через поры. Существенную роль в устойчивости микроорганизмов к действию детергентов играет «электростатическое экранирование», обусловленное наличием заряженных функциональных групп на поверхности их клеток, а также присутствием ионов металлов в среде /5/.
Рассмотрим общую характеристику мембран. На электронных микрофотографиях ультратонких срезов клеток бактериальная клеточная мембрана выглядит как двойная линия шириной около 8 нм. Она состоит из двух слоев фосфолипидов, в которые включены мембранные белки. Самой перспективной и наиболее убедительно трактующей современные экспериментальные данные считается метаморфно-жидкостно-мозаичная модель структуры мембраны. С ее помощью объясняется и присутствие в мембранах белков двух типов: периферических и интегральных. Первые переходят в надосадочную жидкость при отмывании мембран буферными растворами с различными значениями рН или ионной силы. Вторые – внутренние белки, сохраняющие связь с мембранами после проведения перечисленных операций и освобождающиеся только после разрушения фосфолипидного бислоя. Следует отметить, что обычно интегральные белки имеют амфифильную природу и способны к самоагрегации в водных растворах. Большая часть мембранных белков бактерий является белками-переносчиками и ферментами, ответственными за биосинтез макромолекул. В настоящее время известно около 20 различных белков бактериальных внешних мембран, некоторые из них синтезируются в больших количествах. ПАВ является уникальным инструментом для для извлечения белков из бактериальных мембран /12/.
Принципиальное сходство в действии НПАВ и АПАВ свидетельствует о том, что главным агентом фрагментациимембраны являются не заряженные гидрофильные группы детергента, а гидрофобная часть молекулы. Отсюда следует, что мицелла, соприкоснувшись с поверхностью мембраны, вероятно, изменяет свою конфигурацию, обнажая гидрофобные группы. В такой форме ПАВ взаимодействует с мембраной, главным образом за счет неполярной гидрофобной части молекул, что, по-видимому, сопровождается солюбилизацией ПАВ в гидрофобных участках мембраны. При этом последняя дробится на более или менее крупные липопротеидные фрагменты, солюбилизированные благодаря присутствию в них ПАВ /13/.
Связывание детергента с мембраной зависит от числа связывающих мест и от степени их сродства к молекулам детергента. Число мест связывания при высоком уровне сродства невелико, что, в свою очередь, слабо влияет на конформацию мембранных белков. С увеличением концентрации детергента постепенно начинают насыщать места связывания с высоким сродством к детергенту. Этим объясняется «мягкое» воздействие НПАВ на мембраны, так как значения их концентрации мицеллообразования (ККМ) ниже, чем в случае АПАВ. При изучении последовательности действий КПАВ на цитоплазматические мембраны стрептококков установлено, что в первую очередь изменяется проницаемость мембран. Этим обусловлено нарушение тех функций мембран, которые зависят от их нативной проницаемости – транспорта веществ и преобразования энергии. Действие более высоких концентраций КПАВ сопровождается солюбилизацией белковых и липидных компонентов мембран, изменением вторичной структуры белков и инактивацией их ферментных систем. Нарушение проницаемости мембран стрептококков под влиянием катионных детергентов определяется действием этих соединений на липидные компоненты мембран, что приводит к изменению структурной организации их гидрофобной области /14/.
Установлено, что КПАВ действуют на фосфолипидные компоненты мембран протопластов у стрептококков, лизис которых является результатом вторичных осмотических явлений. АПАВ, наоборот, воздействует на белковые компоненты мембран. В результате ингибирования лизиса протопластов после предварительной обработки последних ионами уранила подтверждена важная роль фосфатных групп в механизме действия ПАВ на мембрану. Предполагается, что АПАВ и КПАВ действуют на различные участки мембраны или на один и тот же участок, но различными путями. В ряду алкилсульфатов натрия ДСН обладает наибольшей литической активностью по отношению к ЦПМ протопластов дрожжей. Ряд специалистов полагают, что сорбция ионов ПАВ происходит главным образом на мембранных компонентах липидной природы, а взаимодействие с участием белковых компонентов мембраны /15/.
Советский ученый В.А. Тукмачев предложил модель действия ПАВ на мембраны, согласно которой иго ион (или молекула) сорбируется на мембране, внедряясь в нее своей липофильной частью, и действует на мембранное окружение по принципу клина. При сорбции на мембране определенного количества ионов (или молекул) ПАВ прочность мембраны резко падает, в результате чего она разрушается. Взаимодействие гидрофильных групп с мембранным окружением в этой модели не учитывается. Предполагается, что в литическом процессе это взаимодействие играет второстепенную роль. Е. Фриз (Швеция) предложил следующий механизм взаимодействия ПАВ и мембраны /8/.
1. Связывание детергента без интеграции. При низких концентрациях молекулы ПАВ связываются с мембраной, вероятно, в результате вторжения во внешний слой липидного бислоя.
2. Лизис. Как только концентрация свободного мономера ПАВ достигает определенного уровня, присутствующие молекулы ПАВ дестабилизируют мембрану.
3. Диссоциация мембраны в раствор. При высокой концентрации раствора вся мембрана оказывается окруженной молекулами ПАВ, и дальнейшее их добавление приводит к смене фаз: мембраны перестраиваются в смешанные мицеллы, содержащие детергент-липидные или детергент-белковые комплексы.
4. Освобождение белков от липидов. С увеличением концентрации добавляемого ПАВ количество липидов уменьшается до тех пор, пока все белки не освободятся от них. Экспериментальное подтверждение выдвинутой гипотезы в отношении механизма действия ПАВ было получено при изучении влияния дезоксихолата натрия (ДОХ) на вирус леса Семлики. Так, при концентрации ПАВ 1,5 мМ наблюдалось разрушение вируса и одновременное высвобождение липидов и белков; при 2 мМ ДОХ все мембранные белки освобождались от липидов и образовывали комплексы больших размеров. Увеличение содержания детергента до 5 мМ приводило к возрастанию размеров безлипидных белковых комплексов. Аналогичные результаты получены при действии на этот объект тритона Х-100 и ДСН; различными были лишь концентрации ПАВ, приводившие к одинаковому эффекту.
Причины, по которым до сих пор нет общепринятой схемы механизма действия ПАВ, известны – это отсутствие точных данных о строении и составе бактериальных мембран, а также помехи, которые возникают в результате влияния химических реагентов, присутствующих в среде выращивания. Однако в настоящее время на основе достаточно обширной научной информации можно предположить следующую модель действия ПАВ на мембраны микроорганизмов. Сначала происходит адсорбция молекул ПАВ на поверхности мембраны, изменяя ее проницаемость с последующим нарушением целого ряды функций. Затем при достижении ККМ начинается солюбилизация одного из амфифильных компонентов мембраны белка или липида в зависимости от их локализации и типа детергента. В результате солюбилизации нарушается структурная организация гидрофобных областей мембраны, ответственных за ее целостность. В свою очередь, нарушения такого рода приводят к дезинтеграции мембраны, распаду ее на фрагменты и образованию смешанных мицелл, состоящих из молекул ПАВ и мембранных амфифилов /14/.
В связи с тем, что исследование лизиса мембран под действием ПАВ является одним из активно развивающихся подходов в изучении ее структурной организации, можно ожидать новых, более точных и информативных моделей взаимодействия детергентов с биомембранами.
Другим не менее важным аспектом действия ПАВ на микроорганизмы является их влияние на процессы обмена веществ. За нарушением целостности клеточных структур в результате взаимодействия с детергентами должны последовать изменения на таких ключевых участках микробного обмена веществ, как транспорт и биосинтез молекул, реакция окислительного фосфолирования, фотосинтез /16/.
При изучении влияния твинов на изменение активности накопления a-кетоглутаровой кислоты бактериями псевдомонадами установлено, что твины 60 и 80 заметно увеличивают накопление a-кетоглутарата. Показано, что твин 80 при 0,6%-й концентрации совместно с добавками изолейцина, метионина, серина, лизина, инозита, аспарата усиливает биосинтез витамина В12 и не влияет на биогенез пропионовой кислоты при выращивании пропионовокислых бактерий на основной питательной среде, содержащей молочную сыворотку. При добавлении в питательную среду плесневелого гриба аспергилла твинов 40, 60 и 80 биомасса последнего увеличивалась в 2,5 раза, что сопровождалось накоплением алкалоидов. Максимальное (100%-ое) увеличение накопления алкалоидов наблюдалась при добавлении твина 80 0,5 – ой концентрации. В присутствии этого детергента скорость поглощения питательных веществ из среды возрастала на 27–50%. Полагают, что твин 80 непосредственно не участвует в биосинтезе алкалоидов, а действует как ПАВ, облегчает транспорт питательных веществ в клетку. Скорость образования фумаровой кислоты и ее выход в культуре гриба ризопус в присутствии твина 60 увеличивается на 43%, а при твине 40 и 60 – на 18%. При смеси двух видов твина эффект зависит от количественного состояния индивидуальных твинов /17/.
Обработка изолированных гетероцист цианобактерий катионным детергентом цетилметиламмонийбромидом повышает их проницаемость для внеклеточных нуклеотидов. Эффектом другого рода, вызванным влиянием детергентов, является изменение скорости потребления кислорода различными микроорганизмами. После обработки клеток сальмонелл лаурилсульфатом натрия значительно понижается дегидрогеназная активность клеток, гликолиз, а также потребление кислорода. Культивирование обработанных детергентом бактерий на среде в присутствии 10% глицерина приводит к восстановлению активности этих процессов. Однако выращивание энтеробактерий, устойчивых к детергентам, на среде с глюкозой и аспарагином в присутствии ДСН (10%) приводит к дополнительным энергозатратам, в результате чего урожай клеток снижается на 20%, а утилизация глюкозы и поглощение кислорода ускоряются соответственно на 30–35 и 60–75% по сравнению с выращиванием на среде без ДСН /18/.
Снижение урожая клеток на 20% происходит также при варьировании соотношения количества источников углерода и азота, при замене глюкозы другими сахарами. Полученные результаты свидетельствуют о дополнительном расходе энергии на осуществление активного транспорта соединений вследствие снижения величины мембранного потенциала в присутствии ДСН. При добавлении к суспензии голодающих клеток вибрионов твина 80 наблюдается уменьшение объема клеток, усиление потребления кислорода и возрастание теплоотдачи. Предполагают, что ПАВ влияют на способность этих бактерий использовать связанные с поверхностью питательные вещества.
В работах Р.В. Кучера с сотрудниками показано, что ПАВ комплексно влияют на процесс микробиологического окисления н-алканов, что приводит к улучшению проницаемости клеточных мембран, увеличению активности дегидрогеназ и концентрации растворимого кислорода у дрожжей, а также к солюбилизации углеводородов. ПАВ положительно воздействую на изменение растворимости гексадекана в присутствии дрожжей. Солюбилизация углеводородов является начальной стадией процесса их микробиологического окисления /19/.
При изучении взаимозависимых связей между концентрацией растворенного кислорода, удельной скоростью роста и дегидрогеназной активностью в присутствии ПАВ установлено, что детергенты при ферментации не включаются в ферментную систему, а улучшают проницаемость клеточных мембран, увеличивают аэрацию культуральной жидкости и спосбствуют транспорту кислорода и субстрата к клеткам растущей культуры. Биологическое действие ПАВ на ферментативные процессы и взаимосвязь параметров ростамикроорганизмов объясняются, по-видимому, физико-химическими причинами, связанными с образованием мицелл в культуральной жидкости /20/.
Биоэнергетические процессы в микробных клетках также оказываются затронутыми при внесении детергентов в окружающую среду. В результате исследований влияния тритона Х-100 и дезоксихолата натрия на основную дыхательную цепь и цианидрезистентный путь переноса электролитов в митохондриях установлено, что в малых концентрациях тритон Х-100 ингибирует перенос электрона в электронно-транспортных цепях хлоропластов, митохондрий и бактерий. Предполагают, что механизм его действия при низких концентрациях заключается в модификации структуры некоторых участков мембраны. Кроме того, тритон Х-100, перераспределяясь между водной и гидрофобной фазами, вызывает такие структурные перестройки в липидах, которые приводят к отрыву от мембран довольно крупных фрагментов, содержащих окислительно-восстановительные фрагменты. Это и обуславливает ингибирование переноса электронов в дыхательные цепи. Полученные данные свидетельствуют также о неоднородности распределения ферментов цепи переноса электронов по мембране и существования фонда специфических белков, не связанных с остальными компонентами цепи. Интересно отметить, что при использовании целых клеток микрококков эндогенное дыхание в них под действием тритона Х-100 падало не полностью. Это означает, по-видимому, что клеточная стенка препятствует распаду цитоплазматической мембраны на отдельные мембранные пузырьки, как это, вероятно, происходит в протопластах. Доступность внутренней поверхности цитоплазматической мембраны при действии даже значительных концентраций детергента все равно лимитируется какими-то пространственными ограничениями.
Таким образом, ПАВ выступают в качестве своеобразных регуляторов микробного обмена веществ и могут оказывать влияние на рост и развитие некоторых микроорганизмов, включая дрожжи, растущие на отходах нефтепроизводства, а также пропионовокислых бактерий – синтетиков витамина В12. Эти особенности ПАВ требуют дальнейшего изучения, что позволит в будущем использовать их в биотехнологических производствах.
ПАВ способны вызывать дезинтеграцию клеточных структур микроорганизмов и активно влиять на реакцию обмена веществ. Это свойство детергентов широко используется для лизиса микроорганизмов и имеет большое практическое значение, особенно при патогенных формах. При исследовании влияния длины углеводородной цепи ПАВ неароматических четвертичных аммониевых солей и неионных оксидов аминов на их ККМ и антимикробную активность установлено, что с ростом этой длины минимальная ингибирующая концентрация увеличивается, а значение ККМ уменьшается. Так, наибольшей антимикробной активностью обладают ПАВ при ККМ ниже 100 мгк/мл /19/.
В результате изучения генетики гибели и ультраструктуры грамположительных и грамотрицательных бактерий после воздействия алкилдиметиламмонияхлорида установлено, что низкие концентрации (0,0001%-е) оказывают выраженный бактерицидный эффект, который выше по отношению к грамположительным бактериям. Определяющим в механизме действия КПАВ является нарушение целостности цитоплазматической мембраны. В цитоплазме погибших бактерий выявлены мембранные структуры различной конфигурации и локализации, не связанные с делением клетки и явяляющиеся, по-видимому, результатом самосборки распавшихся под воздействием детергента липидных компонентов мембран. Выращиванию культуры на среде с диталаном приводит к нарушению процесса спорообразования. Показано, что клетки, находящиеся в состоянии покоя, проявляют большую устойчивость к высоким дозам детергента. Противомикробная активность КПАВ может увеличиваться при включении в их молекулы остатков пропионовой и уксусной кислот /9/.
Установлено /4/, что анионные и неионные детергенты, содержание которых не превышает 0,001–0,4%, не влияют на рост дрожжей. Однако при больших концентрациях эти ПАВ оказывают заметное фунгицидное и фунгистатическое действие. Различное влияние оказывают ПАВ при их совместном использовании с антибиотиками и другими лекарственными препаратами. Так, наблюдался эффект усиления действия тетрациклинов в отношении устойчивости грамотрицательных микроорганизмов с помощью катамина АБ, что объясняется повышенным накоплением антибиотика клетками при обработке их ПАВ. В то же время установлено, что снижение в присутствии НПАВ антибактериальной активности поливинилпироллидониода, бензолкониумхлорида и гексахлорфенола в отношении стафилококков и псевдомонад. ПАВ нашли применение и в некоторых вирусологических исследованиях. При изучении влияния различных концентраций щелочного раствора твина 20 (0,2%-го) на физические и биологические свойства вируса Сендай установлена потеря гемолитической активности и заметное уменьшение его инфекционности. В зависимости от концентрации детергента фрагментаы оболочки вируса различались чувствительностью к эритроцитам, биологической актиновностью и физическими свойствами. НПАВ оказались активными также по отношению к вирусу герпеса. Несомненно, что быстрейшее выяснение механизма действия ПАВ позволит с большим успехом применять детергенты как антимикробные средства /21/.
При изучении чувствительности микроорганизмов ПАВ установлена следующая особенность: если питательную среду, содержащую 0,05% додецилбензолсульфоната (сульфонола), подвергнуть кипячению, то в ней погибают все микроорганизмы. После посева в ней могут расти только грамотрицательные бактерии. Это свойство сульфонола использовано для стерилизации питательных сред, предназначенных для грамотрицательных микроорганизмов. Клетки бактерий, растущие при 0,05%-й концентрации детергента, а также более высокой, являлись грамотрицательными. Пороговой концентрацией в питательной среде, при которой могли расти грамположительные бактерии, была 0,008-я и более низкая. Деление бактерий по чувствительности к додецилбензолсульфонату может служить одним из признаков, на основании которых производится классификация микроорганизмов /22/.
Похожие работы
... продукции, а значит, дает значительный экономический эффект. 2. Объекты и методы исследования Целью дипломной работы являлось изучение свойств бактериальной суспензии, с последующим применением в подготовительных процессах переработки мехового сырья. Для выполнения эксперимента был составлен сетевой график, представленный на рисунке 1. Применение ферментов в кожевенной и ...
... Охрана окружающей среды Заключение Рисунок 2 – Сетевой график дипломной работы 2.1 Объекты исследования Объектом исследования в дипломной работе являлись микроорганизмы, выделенные из различных природных жиров: нерпичьего (Н), нерпичьего, выращенного на среде с шёрстным жиром (Нв), шерстного (В) и микроорганизмы, выделенные из ...



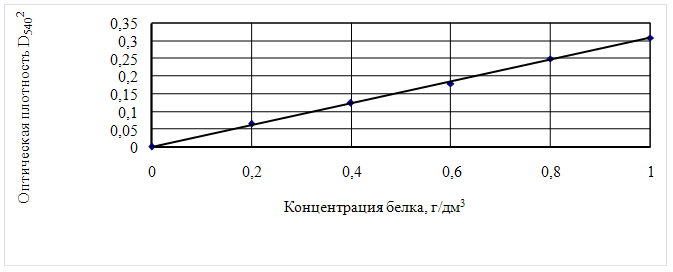
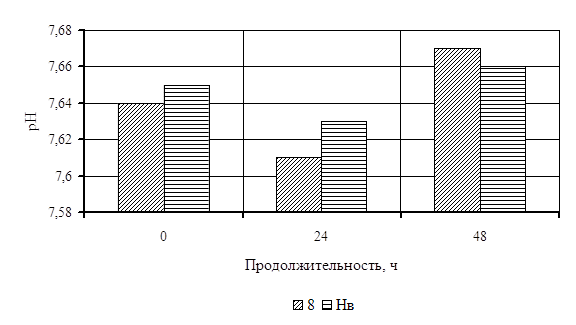
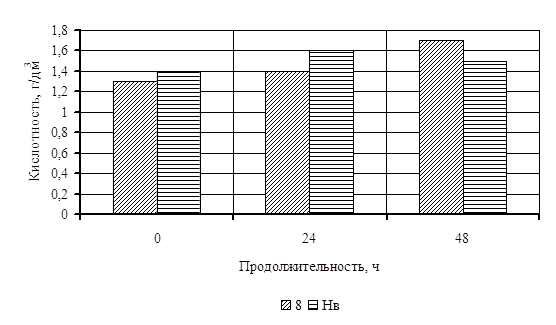
0 комментариев