Навигация
Источники энергии жизнедеятельности
2. Источники энергии жизнедеятельности
Каким же образом черпает организм необходимую ему энергию? Энергия освобождается в митохондриях клеток при окислении различных органических веществ, но используется не сразу, а накапливается в легкоутилизируемой форме в виде макроэргических (высокоэнергетических) соединений. При их расщеплении без промежуточного образования тепла химическая энергия их внутримолекулярных связей преобразуется в другие формы энергии: механическую, электрическую, световую и т. п.
Основным и главнейшим макроэргом является АТФ, состоящая из азотистого (пуринового) основания — аденина, пятиуглеродного сахара — рибозы и трех, последовательно присоединенных к ней молекул фосфорной кислоты. Отщепление от АТФ концевой и второй фосфатных групп приводит к освобождению по 30 кДж энергии на каждый моль: АТФ+Н2О->АДФ+Ф+30 кДж; АДФ+ Н2О->АМФ+Ф+30 кДж, где Ц — неорганический фосфат.
АТФ — источник энергии всех биологических процессов: движения, теплообразования, биоэлектрических явлений, различных биологических синтезов и даже нервной деятельности (схема 1). Расщепление АТФ необратимо: энергия макроэргической связи используется на внешнюю работу и уходит из сферы реакции. А так как потребность организма в АТФ исключительно велика, необходимо постоянное регенерирование этого вещества, образование новых молекул АТФ. Происходит это в процессе аэробного (с участием кислорода) или анаэробного (без него) окисления, сопряженного с фосфорилированием АДФ, а также путем креатинкиназной реакции.
В ходе аэробного и анаэробного (гликолитического) окисления образуются промежуточные макроэргические фосфорные соединения, фосфатная группа которых соответствующими ферментами «пересаживается» со всем запасом энергии на АДФ. Эти так называемые фосфо-трансферазные реакции происходят таким образом, что фермент сближает образовавшийся макроэрг и АДФ настолько, что между ними становятся возможными обмен электронами и возникновение связи фосфата с АДФ при одновременном отщеплении первого от исходного макроэрга (рис. 1).
В принципе так же протекает и креатинкиназная реакция. КФ содержится в клетках как источник макро-эргических фосфатов для регенерации АТФ в экстренных случаях. Реакция эта происходит очень быстро: она не требует ни кислорода, ни расщепления каких-либо органических веществ, так как макроэргическая связь фосфата КФ обладает таким же запасом энергии, как и макроэргические связи в молекуле АТФ: КФ +АДФ креатин + АТФ.
Реакция эта обратима в зависимости от концентраций КФ и АТФ: когда концентрация КФ высока, а АТФ низка, она идет вправо, а при обратных соотношениях — влево. Таким образом, в ходе этой реакции избыток АТФ создает предпосылки для собственной ее экстренной регенерации. Естественно, что вследствие большого и непрерывного расходования АТФ она чрезвычайно быстро обменивается: полупериод жизни ее менее 1 мин, и за 1 сут каждая молекула ее обновляется (расщепляется и вновь регенерируется) 2400 раз!
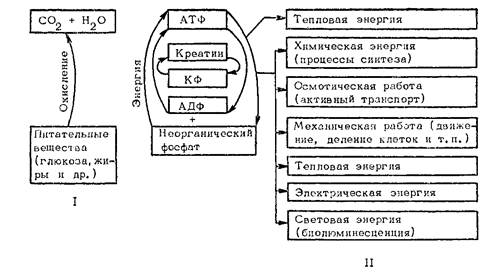
Расходование и генерирование АТФ: І — освобождение энергии, ІІ — преобразование энергии и совершаемая работа
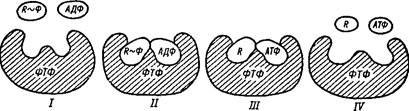
Реакция перефосфорилирования (фосфотрансферазная)
Итак, жизнь — постоянное обновление белковых структур организма. Как же происходит этот процесс?
3. Строение белков и их роль в организме
Полное или частичное расщепление белков осуществляется особыми ферментами — внутриклеточными протеиназами и пептидазами — путем гидролиза, т. е. расщепления с присоединением воды по месту разрыва связи: AB + HOH -> АН - ВОН. А вот синтез белков намного сложнее.
Основными «кирпичиками» белков служат аминокислоты — органические соединения, содержащие щелочную аминогруппу (— NH2) и кислотную — карбоксил (—СООН), т.е. являющиеся одновременно и основаниями, и кислотами:

В образовании белков участвует до 20 различных аминокислот, соединяющихся в разной последовательности в длинные цепи, называемые полипептидными. Аминокислоты в них связаны друг с другом группами —NH2 и —COOH так, что к аминогруппе одной аминокислоты присоединяется карбоксил другой и т. д. Такую связь называют пептидной:

Рассмотрим строение белков подробнее. Эти сведения понадобятся нам в дальнейшем, так как основные приспособительные изменения организма на молекулярном уровне прежде всего и главным образом касаются структуры и свойств клеточных белков. Белки — макромолекулы, в состав которых входит от 100 до нескольких тысяч аминокислотных остатков, что обусловливает их большую ММ, измеряемую десятками и сотнями тысяч атомных единиц массы, диаметром от 5 до 100 нм. Более короткие цепи (от 2 до 10) называют пептидами, а от 10 до 100 аминокислотных остатков — полипептидами. Пептидная цепь — лишь первичная структура белка, способная образовывать высшие структуры: свертывание цепи в клубок (глобулярные белки) или принятие ею нитчатой формы (фибриллярные белки). Связи между атомами, составляющими белковую молекулу, могут быть различными и обладать неодинаковой прочностью. Наиболее npo4Hbf ковалентные связи, т. е. такие, в которых пара электронов находится во владении двух смежных атомов. В белках такими связями соединены остатки аминокислот и атомы, их составляющие. Иначе говоря, первичная структура белка достаточно прочна, так как пептидная цепь построена с помощью ковалентных связей. Но есть связи и другого типа, например водородные, возникающие между двумя атомами с помощью водорода (чаще всего между атомами кислорода и азота). Дело в том, что у кислорода в местах соединения аминокислот друг с другом (т. е. в пептидной связи) имеется небольшой отрицательный заряд, а у азота — небольшой положительный, так как у ядер атома кислорода больше сродство с электронами, чем у ядер азота. Вследствие этого ковалентная пара электронов, связывающая водород с азотом, смещается — и атом водорода оказывается между двумя заряженными центрами:
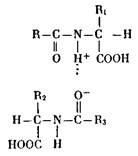
С помощью этих связей образуется вторичная структура белковой молекулы, например спирализация ее, появляются складчатые и нитчатые структуры. При образовании третичной структуры, т. е. пространственной упаковки спирализованных и неспирализованных участков белковой модекулы (например, в шарообразных, глобулярных белках), большое значение имеет возникновение мостиков за счет двух атомов восстановленной серы (R—S —S-Ri, где R и Ri — два участка полипептидной цепи). Кроме того, здесь принимают участие и электростатические (ионные) связи, появляющиеся между двумя ионизированными атомами (опять же, как правило, между азотом и кислородом):
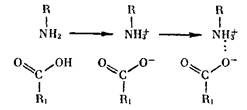
Наконец, четвертичная (наиболее сложная) структура — связь между несколькими одинаковыми или различными белками (называемыми протомерами), объединяющая их в одно целое (олигомер). Такая структура поддерживается ионными или водородными связями. Существуют и другие связи, менее прочные, чем кова-лентные, например взаимодействие свободных групп ОН и СООН, неполярных углеводородных радикалов и др.
Разрыв нековалентных связей приводит к нарушению высших белковых структур, называемому денатурацией белков. При этом белки утрачивают ряд своих функциональных свойств, становятся более доступными действию расщепляющих их ферментов. Денатурация в зависимости от степени ее и условий может быть и обратимой, и необратимой.
Похожие работы
... Половые различия динамики ответных реакций на эмоциональные стрессорные воздействия. Перенасыщенность жизни современного человека стрессорными ситуациями повышает интерес исследователей к острому воздействию на организм стресс – факторов. Тенденция к увеличению разрыва в продолжительности жизни мужчин и женщин, по-видимому, в немалой степени связана с половыми особенностями адаптации именно к ...
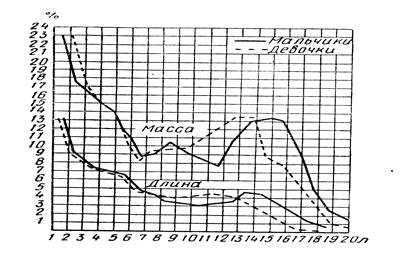
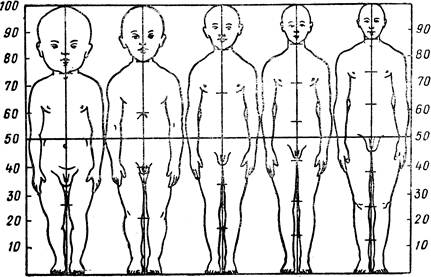
... возрастных периодов в значительной степени подвержена изменениям. Как хронологические рамки возраста, так и его характеристики определяются прежде всего социальными факторами. Рост и пропорции тела на разных этапах развития. Характерной особенностью процесса роста детского организма являются его неравномерность и волнообразность. Периоды усиленного роста сменяются его некоторым замедлением. ...
... ” и является доминирующей. В последнем мы противостоим мнению Л. Матвеева, Ф. Меерсона (1984), считающих, что “система, ответственная за адаптацию к физической нагрузке, осуществляет гиперфункцию и доминирует в той или иной мере в жизнедеятельности организма”. 5. Функциональная система предельно специфична и в рамках этой специфичности относительно лабильна лишь на этапе своего формирования ( ...
... изменений имеет большое значение для правильного определения тактики анестезии и интенсивной терапии. 2. Стресс-реакция организма на повреждение Жизнь организма представляет собой непрерывную цепь адаптационных изменений, направленных на сохранение и восстановление динамического постоянства внутренней среды или гомеостаза. В современном понимании гомеостаз – это ключевой принцип адаптации, в ...


0 комментариев