Навигация
1. Дансилхлорид,
![]()
![]() диазометан Модификация аминокислот
диазометан Модификация аминокислот
2. Карбобензоксихлорид
![]()
![]() Разделение производных аминокислот обращенно-фазовой ВЭЖХ
Разделение производных аминокислот обращенно-фазовой ВЭЖХ
![]() Индивидуальные производные аминокислот
Индивидуальные производные аминокислот
![]() Масс-спектрометрический анализ производных аминокислот
Масс-спектрометрический анализ производных аминокислот
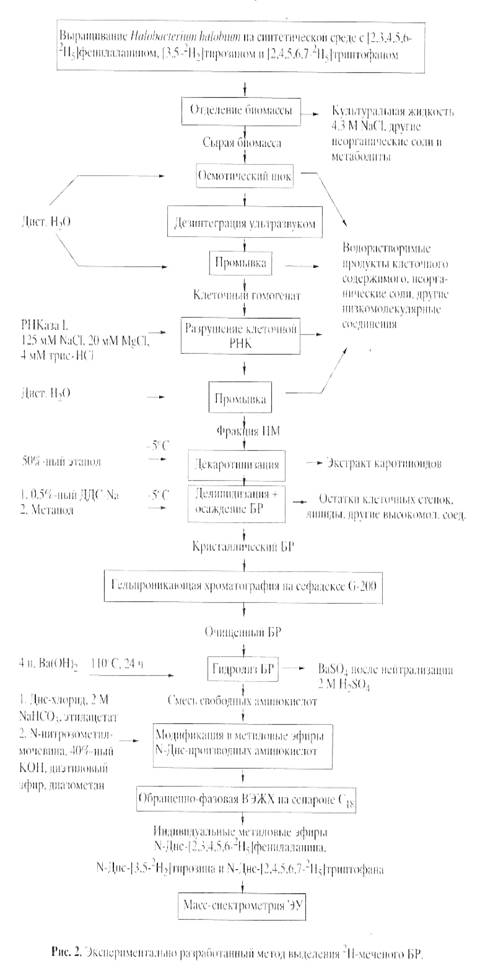
Схема получения дейтерий-меченного бактериородопсина из H. halobium и определения степени включения дейтерия в аминокислоты белка.
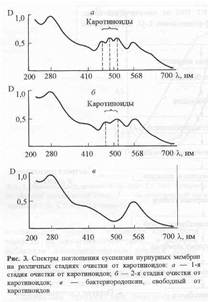
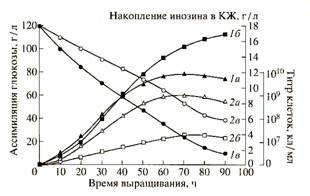
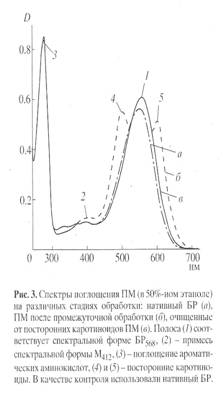
В качестве примера на рис.2,а-в изображены спектры поглощения пурпурных мембран на различных стадиях очистки от каротиноидов. Как видно из рис. 2,в, спектр поглощения бактериородопсина после экстракции от каротиноидов имеет трехполосный вид: полосы на длинах волн 568 нм и 410 нм определяются наличием хромопротеида, полоса поглощения при длине волны 280 нм определяется содержанием ароматических аминокислот в полипептидной цепи этого белка. (Для чистого бактериородопсина соотношение D280/D568 равно 2:1). Согласно предложенной схеме можно получить десятки миллиграмм дейтерий-меченного бактериородопсина, переработав 200-300 мг бактериальной биомассы. Обращенно-фазовая высокоэффективная хроматография ВЭЖХ метиловых эфиров дансилпроизводных аминокислот и бензилоксикарбонильных производных аминокислот, полученных из гидролизатов бактериородопсина показала высокие степени хроматографической чистоты выделенных аминокислот и отсутствие примесей не белковой природы в гидролизатах бактериородопсина (см. ниже).
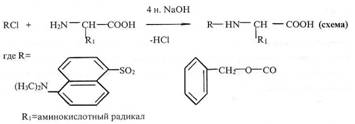
Гидролиз дейтерий-меченного бактериородопсина. Гидролиз дейтерий-меченного бактериородопсина проводили в условиях предотвращения изотопного обмена водорода на дейтерий в ходе гидролиза и сохранения остатков триптофана в белке. Для этого были рассмотрены два альтернативных варианта проведения гидролиза- кислотный и щелочной гидролиз бактериородопсина. Кислотный гидролиз белка в стандартных условиях (6 н. HCL, 24 ч, 1100 С), как известно, приводит к полному разрушению триптофана и частичному разрушению серина, треонина и некоторых других аминокислот в белке [19], которые для наших экспериментов не играют существенной роли. Другим значительным недостатком при проведении гидролиза в HCL является изотопный обмен ароматических протонов (дейтеронов) в молекулах триптофана и тирозина [20]. Модификация метода проведения кислотного гидролиза бактериородопсина заключалась в использовании дейтерий-меченных реагентов (6 н. раствор 2НCL (в 2Н2O) ) и добавлении в реакционную смесь 3 %- ного фенола. Другой вариант гидролиза бактериородопсина заключался в использовании 4 н. раствора Ba(OH)2 (1100 C, 24 ч). В этих условиях гидролиза белка реакций изотопного обмена водорода на дейтерий в ароматических аминокислотах триптофане и тирозине не происходит, и что особенно важно - не разрушается триптофан. Оба метода гидролиза бактериородопсина показали хорошие результаты. Однако вследствие высокой гидролизующей способности гидроокиси бария и лёгкости выделения свободных аминокислот из щелочных гидролизатов путём нейтрализации гидрооксида бария серной кислотой, авторы отдали предпочтение щелочному варианту гидролиза бактериородопсина. Для последующего масс-спектрометрического анализа гидролизаты бактериородопсина обрабатывали дансилхлоридом и диазометаном (и/или карбобензоксихлоридом) с получением летучих производных аминокислот, которые затем разделяли методами обращенно-фазовой ВЭЖХ.
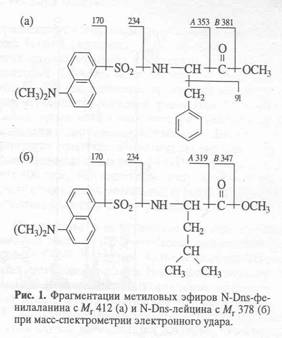
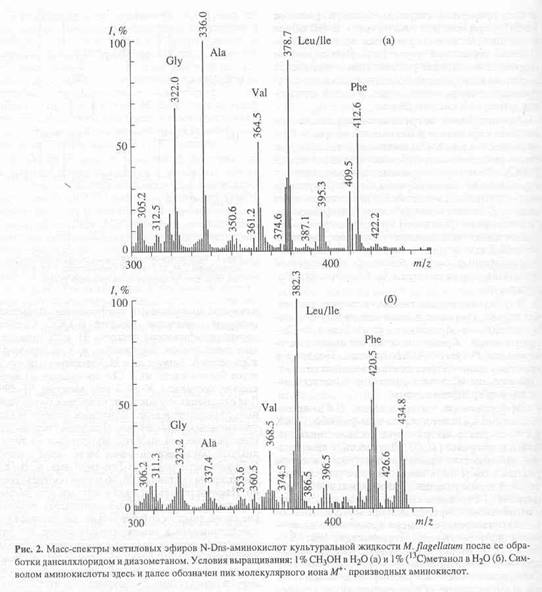
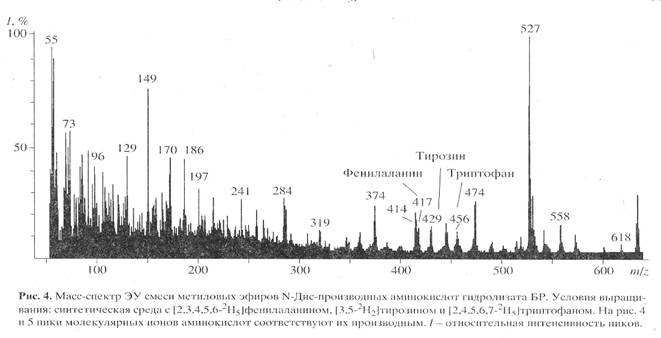
Масс-спектрометрический анализ метиловых эфиров дансильных производных L-[2,3,4,5,6-2H5]-фенилаланина, L-[3,5-2H2]-тирозина и L-[2,4,5,6,7-2H5]-триптофана, выделенных из гидролизатов бактериородопсина. Масс-спектр гидролизата бактериородопсина, полученный со среды, содержащей L-[2,3,4,5,6-2H5]-фенилаланин, L-[3,5-2H2]-тирозин и L-[2,4,5,6,7-2H5]-триптофан после обработки дансилхлоридом и диазометаном представлен на рис. 4. Как видно из представленных данных, в масс-спектре этого гидролизата бактериородопсина присутствуют пики молекулярных ионов обогащённых дейтерием метиловых эфиров дансилпроизводных -фенилаланина с М+. m/z 417 (вместо 412 для нативного фенилаланина), тирозина с М+. с m/z 429 (вместо 428) и триптофана с М+. m/z 456 (вместо 451). Полученные данные свидетельствует о высокой эффективности мечения бактериородопсина по остаткам дейтерированных фенилаланина и триптофана. Что касается изотопного обогащения тирозина в бактериородопсине (согласно данным масс-спектрометрии степень дейтерированности тирозина составляет 50%), авторы не исключают, что подобный результат мог быть обусловлен не вкладом биосинтеза тирозина de novo, а возможным (1Н-2Н)-обменом при выделении аминокислот или при химической модификации тирозина. Кроме вышеназванных аминокислот в масс-спектре модифицированного дансилхлоридом и диазометаном гидролизата бактериородопсина, изображенного на рис.3, четко детектируются пики молекулярных ионов производных других аминокислот, таких, как глицин (М+. с m/z 322), аланин (М+. с m/z 336), валин (М+. с m/z 364) и лейцин(изолейцин) (М+. с m/z 378). Как и следовало ожидать, эти аминокислоты в бактериородопсине не дейтерированы.
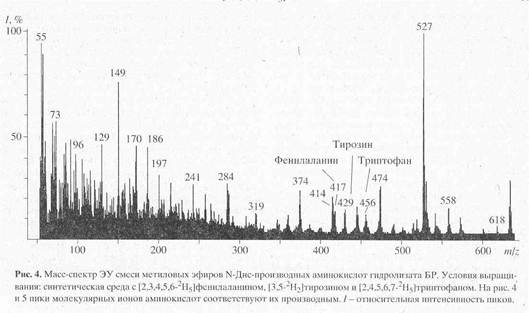
Как видно из рис.4, в масс-спектре гидролизата бактериородопсина пики молекулярных ионов, соответствующим производным ароматическим аминокислот имели недостаточно высокую интенсивность, за счет чего молекулярная область обогащения дейтерием этих соединений была сильно уширена. Поэтому было необходимо хроматографически выделять и анализировать индивидуальные дейтерий-меченные аналоги указанных аминокислот из белковых гидролизатов. Для этих целей авторы использовали метод обращенно-фазовой высокоэффективной хроматографии (ВЭЖХ), хорошо апробированный для аналитического и препаративного разделения бензилоксикарбонильных производных дейтерий-меченных аминокислот, выделяемых из других микробных объектов [17]. Этот метод был адаптирован к условиям хроматографического разделения смесей метиловых эфиров дансильных производных аминокислот бактериородопсина.
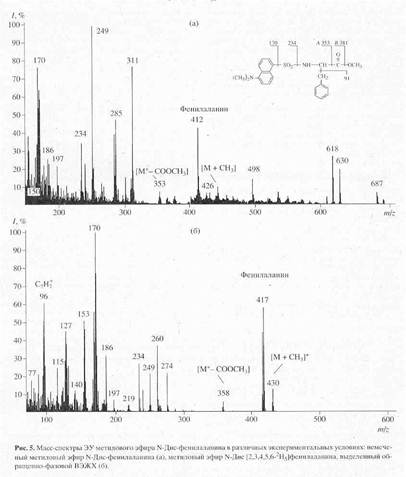
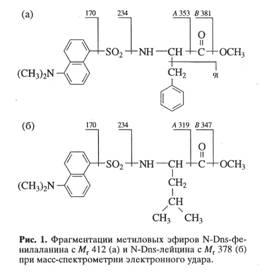
В качестве примера на рис. 5,б представлен масс-спектр чистого метилового эфира L-[2,3,4,5,6-2H5]-дансилфенилаланина, выделенного методом обращенно-фазовой ВЭЖХ из гидролизата бактериородопсина, изображенного на рис.4 (Масс спектр приведен относительно немеченного производного L-фенилаланина (а)). Доказательством наличия дейтерия в фенилаланине, хроматографически выделенном из гидролизата бактериородопсина является присутствие в масс-спектре дейтерированнного образца пика молекулярного иона дейтерированного производного L-фенилаланина (М+. с m/z 417 (вместо 412 для контрольных условий (а)) и обогащённого дейтерием бензильного фрагмента фенилаланина с m/z 96 (вместо 91 в контроле). Кроме этого, в масс спектре электронного удара метилового эфира дансил-фенилаланина зафиксированы пики фрагментов с m/z 170, 234, 250 и 353, три из которых по массе соответствуют дансильному фрагменту и продуктам его распада до N-диметиламинонафталина (эти фрагменты не дейтерированы), а низкоинтенсивный пик с m/z 353 является продуктом отщепления группы -СООСН3 из производного фенилаланина. Полученные данные свидетельствуют о том, что 5 атомов водорода в молекуле фенилаланина замещены на дейтерий, что в целом совпадает со степенью дейтерированности исходного L-[2,3,4,5,6-2H5]-дансилфенилаланина, добавляемого в среду культивирования. Согласно данным по разделению метиловых эфиров дансилпроизводных аминокислот гидролизатов бактериородопсина методом обращенно-фазовой ВЭЖХ, степень чистоты полученных метиловых эфиров L-[2,3,4,5,6-2H5]-дансилфенилаланина, L-[3,5-2H2]-тирозина и L-[2,4,5,6,7-2H5]-триптофана составляет от 96 % для производных L-фенилаланина и L-тирозина до 98% для производного L-триптофана.
Таким образом, полученные данные свидетельствуют о высокой эффективности мечения бактериородопсина по остаткам дейтерий-меченных ароматических аминокислот. В дальнейшем также планируется получать по разработанному методу полностью дейтерированные препараты бактериородопсина для реконструкции функционально активных систем мембранных белков в из очищенных компонентов в 2Н2O с участием дейтерий-меченных липидов и других дейтерированных биологически активных соединений (данные по получению полностью дейтерированного бактериородопсина будут опубликованы в отдельной статье). Эти исследования позволят дать ответ на вопрос как функционирует дейтерий-меченный бактериородопсин в составе нативных мембран в условиях, близким к адаптации организма к 2Н2О.
ЛИТЕРАТУРА.
1. Oesterhelt D. and Stoeckenius W. // Nature New Biol. - 1971. - V.233. - P.149.
2. Spudich John L. // Ann. Rev. Biophys. Chem. - 1988. - V.17. - P.193-215.
3. Creuzet F., McDermott A., Gebhard R., Hoef K., van der Spijker, Assink M. M., Herzfeld J., Lugtenburg J., Levitt M.H., Griffin R.G. // Science. - 1991. - V.251. - P.250-286.
4. Argade P.V., Kenneth J., Rothscild K.J., Kawamoto A.H., Herzfeld J., and Herlihy W.C. // Proc. Natl. Acad. Sci. USA. -1981. - V.78. - No.3. - P.1643-1646.
5. Rothschild K.J., Braiman M.S., Yi-Wu He, Marti T. and Khorana H. G. // J. of Biological Chemistry. - 1990. - P.16985-16990.
6. Otto H., Marti T., Holz M., Mogi T., Stern L.J., Engel F., Khorana H.G. & Heyn M.P. // Proc. Natl. Acad. Sci. U.S.A. - 1990. - V.87. - P.1018-1022..
7.Vetter W. , in: Biochemical Applications of mass-spectrometry (Walles G.R., and Dormor O.C.). - 1980. -First supplementary volume. - Wiley - Interscience. - N.Y. - USA. - P.439.
8. Hackett N.R., Stern L.J., Chao B.H., Kronis K.A. and Khorana H.J. // J. Biol. Chem. - 1987. - V.262. - P.9270-9277.
9. Rosenbach V., Goldberg R., Gilon C. and Ottolenghi M. // Photochem. Photobiol. - 1982. - V.36. - P.197-201.
10. Plotkin B.J., Sherman M.V. // Biochem. - 1984. - V.23. - P.5353-5360.
11. Griffiths D.V., Feeney J., Roberts G.C.and Burgen A.S. // Biochim. et Biophys. Acta. - 1976. - V.446. - P.479-585.
12.Matthews H.R., Kathleen S., Matthews K. and Stanley J. // Biochim. et Biophys. Acta. - 1977. - V.497. P.1-13.
13. Onishi H., McCance M.E., and Gibbons N.E. // Canad. J. of Microbiol. - 1965. - V.11. - P.365-373.
14. Oesterhelt D., Hess B. // Eur. J. Biochem. - 1973. - V.37. - N.1. - P.316-326.
15. Tokunada F., Ebrey T. . // Biochemistry. - 1978. - V.17. - N.10. - P.1915-1922..
16. Гринштейн Дж, Виниц М. Химия аминокислот и пептидов. - М.:Мир. - 1965. - С. 387-390. 16.
17. Егорова Т.А., Мосин О.В., Еремин С.В., Карнаухова Е.Н., Звонкова Е.Н., Швец В.И. // Биотехнология. - 1993. - Т.8. - С.21-24.
18. Oesterhelt D. & Stoeckenius W. // Methods Enzymol. - 1974. - V.31. - P.667-678.
19. Звонкова Е.Н., Зотчик Н.В., Филлипович Е.И., Митрофанова Т.К., Мягкова Г.И., Серебренникова Г.А // Химия биологически активных природных соединений. - М.: Химия, 1970. - С.65-68.
20. Cohen J.S., Putter I. // Biochim. Biophys. Acta. - 1970. - V.222. - P.515-520.
O.V. МОSIN
Moscow State Academy of Fine Chemical Technology named after M.V. Lomonosov, 117571.
PREPARATION OF BACTERIORHODOPSIN LABELED WITH DEUTERIUM ON AROMATIC RESIDUES OF AROMATIC AMINO ACIDS L-PHENYLALANINE, L-TYROSINE AND L-TRYPTOPHAN.
The samples of membrane protein bacteriorhodopsin wich contained selective deuterated analoques of aromatic amino acids such as L-phenylalanine, L-tyrosine and L-triptophan were obtained biosynthetically. It was achieved through the cultivation of a strain of halophilic bacterium H. halobium ЕТ 1001 on synthetic medium containing instead of natural amino acids the chemically synthetized L-[2,3,4,5,6-2H5]-phenylalanine, L-[3,5-2H2]-tyrosine and L-[2,4,5,6,7-2H5]-tryptophan. The data on cultivation of H. halobium on media containing the deuterated analoques of amino acids and preparation of deuterared bacteriorhodopsin are presented. The analysis of deuterium enrichment of amino acids obtained from hydrolizates of bacteriorhodopsin was perfomed by the electron impact mass-spectrometry method of methyl esters of dansyl-amino acids and benzyloxycarbonyl- amino acid derivatives after preparative separation using reverse-phase high perfomance liquid chromatofraphy (HPLC). It was shown, that in mass spectra of derivatives of amino acids obtained from hydrolizates of bacteriorhodopsin molecular ions of deuterated aromatic amino acids are presented and practically absent their native non-labelled analoques. The data obtained testified to the high efficiency of labelling of bacteriorhodopsin in those experimental conditions.
Похожие работы
... . Так, в Phe детектировалось 80,5 % метки, в Ala - 95 %, в Gly - 90% (см. табл. 6). Во всех экспериментах степени включения дейтерия и изотопа углерода 13С в метаболически связанных аминокислотах обнаружили определённую коррелляцию. Так, степени изотопного обогащения валина и лейцина (семейство пирувата), фснилаланина и тирозина (семейство ароматических аминокислот} совпадают (табл. 6). Степени ...
... при котором отсутствует (1Н-2Н)-обмен в аминокислотах и сохраняются остатки фенилаланина, тирозина и триптофана. При щелочном гидролизе возможная рацемизация аминокислот не влияет на результат последующего масс-спектрометрического определения уровней включения дейтерия в аминокислоты. Для получения летучих производных аминокислоты переводили в метиловые эфиры N-Dns-аминокислот или N-Cbz- ...
ращенно-фазовой ВЭЖХ. Выбор стратегии биосинтеза 2Н-меченого БР c использованием штамма экстремальной галофильной бактерии Halobacterium halobium определялся целью исследования, связанной с изучением принципиальной возможности получения 2Н-меченых препаратов мембранного белка в микропрепаративном количестве для реконструкции искусственных мембран. При выборе [2, 3, 4, 5, 6-2Н5]фенилаланина, ...
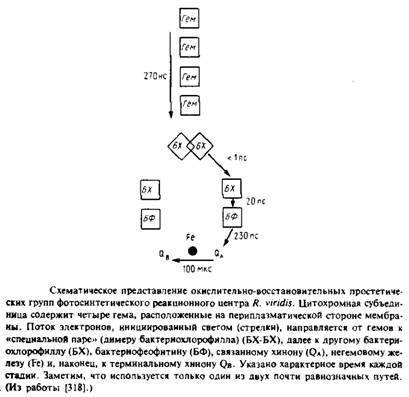
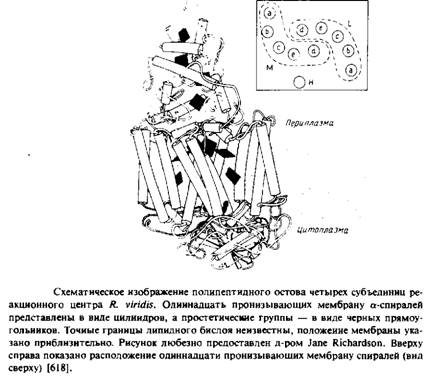
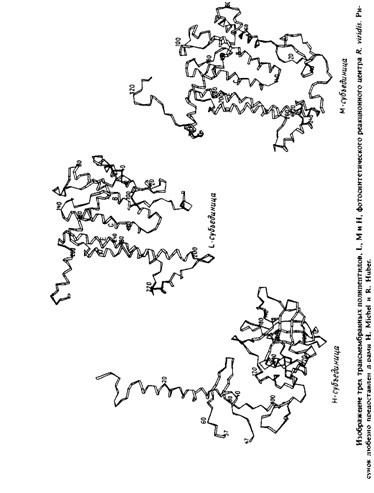
... методов. Наиболее известными структурами являются реакционные центры R. viridis и R. sphaeroides, исследование которых с помощью рентгеновской дифракции было весьма успешным. Еще одна наиболее полно изученная структура - бактериородопсин Н. halobium; для его исследования применялся метод реконструкции изображения, а также другие подходы. Порин и родственные белки наружной мембраны Е. соЧ изучали ...
0 комментариев