Навигация
Получение ацетона и бутанола в ходе бактериального брожения представителей рода Сlostridium
1.3.2 Получение ацетона и бутанола в ходе бактериального брожения представителей рода Сlostridium
Ацетон и бутанол – единственные важные химические вещества, которые в больших количествах получают путем бактериального брожения.
Ацетоно-бутиловое брожение вызывают бактерии рода Сlostridium, а именно Сlostridium acetobutylicum и другие виды. Бутанол-изопропаноловое брожение вызывает Сl. butulicum, а масляно-уксуснокислое брожение – Сl. buturicum.
Продуценты. Почти все виды рода Сlostridium осуществляют ацетоно-бутанол-этанольную ферментацию. Но для получения растворителей используют два вида – это Сl. acetobutulicum McCoy et. al. и Сl. beijerinckii Donker. Недавно обнаружены новые виды, полезные для получения ацетона и бутанола: Сl. aurantibutyricum и Сl. tetanomorphum (группа Накамуры, Япония). Штамм Сl. tetanomorphum образует бутанол как главный продукт брожение при небольшом количестве этанола, уксусной и масляной кислоты, но не ацетона.
Споры клостридий широко распространены в почве. Большое число штаммов (240) выделено из жидкости рубца. Бактерии ферментируют глюкозу, целлобиозу, крахмал. Известны три штамма с целлюлазной активностью.
Сl. acetobutylicum – спорообразующий, облигатный анаэроб, имеет форму сигареты, размеры клеток 0,6 – 0,9 X 2,4 – 4,7 мкм. Грамположительные клетки, подвижные за счет перитрихиального жгутикования, делятся поперечной перегородкой, образуя цепочки. Хотя споры не образуют растворители, наиболее сильные спорообразователи синтезируют наибольшее количество растворителей. Сl. acetobutylicum при высеве на плотную среду образуют колонии 4 типов: I – с темным центром и свелым краем, после нескольких пассажей на богатой среде появляются колонии типа II – с коричневым центром и узкой зоной периферического роста, типа III – с коричневым центром без светлого края и типа IV – светло-коричневые без периферического роста. Способность к образованию растворителей снижается в ряду I > II > III. Колонии IV типа практически не образуют растворителей. Из колоний типа II и III реверсий к типу I не обнаруживается.
Оптимальная температура для роста 37°С, рН 6,5. Сl. acetobutylicum сбраживает крахмал, гексозы или пентозы с превращением их примерно на 30% в смесь растворителей, а остальное составляют газы Н2 и СО2 в соотношении 40 : 60. Смесь растворителей состоит из н-бутанола (60%), ацетона (30%) и около 5–10% приходится на этанол. Сl. beijerinckii сбраживает глюкозу и крахмал с образованием главным образом н-бутанола и в меньших количествах изопропанола и этанола. Необычный вариант Сl. saccharo-butyl-liquefaciens плохо сбраживает мелассы, но дает прекрасный выход продуктов в крахмальной среде и высокое образование бутанола; соотношение ацетон : бутанол : этанол равно 19 : 78 : 3. У Сl. toanum при росте в сахарной среде с добавлением обезжиренных рисовых отрубей выход растворителей составляет ~ 30%, а их соотношение как 52,9 (бутанол) : 42,5 (изопропанол) : 3,2 (этанол) : 1,4 (ацетон). Для производства бутанола в промышленности используют Сl. acetobutylicum. При росте, в фазе образования кислот и бутанола, одновременно из глюкозы и реассимилированного бутирата Сl. acetobutylicum образует внеклеточный полимер, который может реутилизироваться культурой как резервный источник углерода. Предположительно полимер представлен ацетилированным полисахаридом.
Обнаружено, что промышленный штамм в конце экспоненциальной фазы роста выделяет вещество аутобактериомицин, обладающий антибиотическим действием по отношению к продуценту, а также к четырем штаммам сем. Baciallaceae. Бактериологический эффект аутобактериомицина возрастает с возрастом клеток и концентрации бутанола. Это аутолизин. Аутобактериомицин оказывает влияние на концентрацию биомассы и образование растворителей. Причем установлено, что если аутолизин прикреплен к клеточной стенке, то он играет положительную роль для роста. Если он освобождается и выделяется в среду в конце экспоненциальной фазы, то он вызывает лизис клеток. Освобождение аутолизина происходит в связи с отсутствием дивалентных катионов в среде. Если в среду добавить Mg2+, то увеличивается устойчивость культуры к бутанолу. Тот же результат получают с помощью ультрафильтрации, которая позволяет термально денатурировать аутолизин в течение всей ферментации.
Ингибирование синтеза бутанола аутолизином служит первостепенным ограничением типичной ацетоно-бутаноловой ферментации. Поэтому ведутся исследования по получению Lyt–- штаммов, и один такой «без аутолизиновый» штамм получен.
Методом химического мутаногенеза нитрозогуанидином в присутствии бутанола получен мутант Сl. acetobutulicum штамм 77. У мутанта более высокая удельная скорость, в два раза больше накопление биомассы по сравнению с исходным типом. В процессе ферментации дикий штамм потребляет 65г глюкозы, образуя при этом 20 г·л -1 растворителей в течении 53 ч. Рост мутантного штамма менее подвержен ингибирующему действию бутанола.
Получение растворителей в промышленности. Для приготовления инокулята есть разные способы. Например, проводят тепловой шок, а затем последовательные пересевы для уничтожения вегетативных клеток, слабых спор, а также для индукции прорастания спор. Нагревание осуществляют по-разному: 100°С – 50 с, 100°С – 2 мин, 95°С – 30 мин, 80°С – 5 мин, 75°С – 2 мин и 70°С – 90 с. Считают, что увеличение времени теплового шока при каждом субкультивировании способствует отбору самых «сильных» спор и, возможно, самых активных бродильщиков. На производстве культура бактерий хранится в виде спор. Инокулят вносится в ничтожном количестве 1 : 3000, но его специальная подготовка имеет решающие значение для процесса. Замечено, что лучшими продуцентами нейтральных продуктов служат культуры, споры которых выдерживают наиболее высокую температуру. Считают, что клетки инокулята должны быть подвижными. С сильно подвижными клетками получают больше растворителей. Важно также последовательные манипуляции делать во время максимальной подвижности клеток и минимального значения рН. Если в качестве посевного материала используют клетки в стадии максимальной подвижности, то выход бутанола увеличивается 2,5 – 3 раза. Первую, вторую и третью генерации проводят в лаборатории. Для Сl. acetobutulicum первая генерация проводится в среде, приготовленной на 5% сухих злаков и без питательных добавок, при температуре 37°С в течении 24 ч. Содержимое пролбирки вносят в 300 мл мелассной или крахмальной среды с питательными добавками, налитой в колбу на 500 мл и инкубируют в течении 24 ч. Далее содержимое колбы вносят в 4-литровую колбу, содержащую 2900 мл той же среды. Одна из таких колб с культурой служит инокулятом для первого сосуда на заводе. Через колбы интенсивно продувают инертный газ и рН снижается до 3,9-4,5. Когда посевной материал переносят из колбы, количество углеводов должно быть наполовину потреблено.
Культивирование. Периодическое выращивание. При периодическом выращивании следят за уровнем источника углерода и рН. Определенный исходный уровень источника углерода обусловлен токсичностью образуемых из него продуктов. Растворители, и в первую очередь бутанол, ингибируют процесс, поэтому при периодическом выращивании редко образуются более 20 кг растворителей в 1 м3. Типичные выходы для этого режима: 0,2 – 0,6 кг/м3*ч в зависимости от субстрата и условий культивирования. Для удаления конечных продуктов ферментации в качестве экстрактантов в ферментер добавляют несмещивающиеся органические растворители. Наилучшие результаты получены при добавлении олеилового спирта и смеси олеилового спирта (50%) в бензилбензоате. В обычной ферментации в периодических условиях поглощения глюкозы приблизительно 80 кг/м3. Удаление бутанола в процессе в процессе экстракции увеличило скорость его образования, и максимальная объемная производительность по бутанолу увеличилась более чем на 60% по сравнению с обычной периодической ферментацией.
Проточное культивирование. Чтобы увеличить продуктивность и снизить цены на продукты ферментации, предложено проточное культивирование.
При одностадийном проточном культивировании с низкими скоростями протока можно одновременно достигать роста клеток и максимального превращения сахаров в растворители. Но при низких скоростях разведения, благоприятных для синтеза растворителей, возникает нестабильность процесса и достичь стационарного состояния бывает очень трудно. Для промышленного применения такой проточный процесс не подходит, так как он должен быть стабильным в течение нескольких недель или лучше нескольких месяцев. Стабильность – один из важнейших критериев непрерывного процесса.
Причину нестабильности усматривают в токсичности бутанола на клетки при его высокой концентрации и во флоккуляции бактерий. Для устранения флоккуляции клеток, которая возникает в условиях высокой концентрации растворителей, рекомендовано добавление к синтетической среде солей хлора (NaCl, KCl, CaCl2).
При высокой концентрации растворителей стабильность ферментации можно улучшить в двустадийном проточной культуре: рост клеток оптимизируют в первой стадии, а продукцию растворителей – во второй.В оптимальных условиях такая конфигурация приводит к длительной стабильности на более чем один месяц, даже при высокой концентрации растворителя (21 г/л). При одностадийном проточном культивировании 20% глюкозы не используется клетками и остается в среде. В двустадийном процессе 87,5% глюкозы превращается в растворители. Комбинируя две техники: двустадийный проточный реактор и рециклирование клеток во втором ферментере, достигают как увеличенную продуктивность, так ихорошую стабильность с высокой концентрацией растворителей (17 г/л).
Проточный процесс ведут при лимитизации по фосфатам (или по сульфатам, но не по азоту или субстрату) в синтетической среде. Растворители образуются в пределах рН 4,3 – 4,7. Первая стадия – это индукция к синтезу растворителей, вторая – непосредственно образование растворителей. Поскольку фосфор почти полностью исчерпан ко времени второй фазы, рост клеток останавливается. При низкой концентрации протока выход растворителей в непрерывной культуре такой же, как в периодической: 0,29 г/г глюкозы.
При культивировании Сl. acetobutylicum в хемостате на синтетической среде с витаминами – биотином (0,01 мг/л) и р-аминобензойной кислотой (1 мг/л) – установили, что рост и образование растворителей лимитируется витаминами. продуктивность увеличивается в 4 раза приувеличении концентрации витаминов в среде. В строго анаэробных условиях выход растворителей в 1,5 раза выше, чем при доступе воздуха. В оптимальных условиях продуктивность растворителей равна ~2,0 г/л·ч.
Среды. Ферментация. Используют три типа сырья как источников углерода и энергии: зерно (крахмал), паточную (неочищенную мелассу) и очищенную мелассу. В качестве субстратов будущего рассматривают различные отходы, гидролизованную древесину, гидролизаты отбросов, сыворотку, сульфитные жидкости: гидрол – побочный продукт производства глюкозы из зерна. Среды из зернового крахмала готовят следующим образом. Мука вносится в количестве 60% к воде, туда же добавляют сброженным остаток ферментации после отгонки растворителей. Конечная концентрация должна составить 8,5% исходного зерна.
При использовании мелассы концентрация сахара должна быть 5,5-7,5%. К среде добавляют суперфосфат и аммоний. Последний вносят постепенно в случае очищенных меласс для поддержания рН на уровне 5,6–6,0 в количестве 2,2–1,3% NH3 по отношению к концентрации сахара или сразу в случае паточных меласс, которые сильно забуферены. В среду вносят 25–50% горячего остатка после отгонки растворителей. Это увеличивает выход растворителей, снижает количество добавляемых питательных веществ, сокращает затраты на нагревание и дает большую экономию пара, необходимого для выпаривания остатка. Ферментер и среду стерилизуют. Брожение протекает под избыточным давлением газов для создания анаэробных условий. Начальный рН 6,0, который снижается до ~ 5,4 через 24 ч.
Концентрация растворителей (при использовании крахмальной среды) через 50–56 ч ферментации 22,5 г/л, а соотношение ацетона, бутанола и этанола 30 : 60 : 10. Ферментация в мелассных средах завершается за 40–45 ч, а в крахмальных (с питательными добавками) – за 50–60 ч, в крахмальной без питательных добавок за 70–80 ч. Проточное выращивание бактерий ведется с работой серии из пяти ферментеров. За 18 дней получают продуктивность в 3 раза выше, чем при периодическом культивировании, но выходы растворителей низкие в связи с высоким образованием кислот в начальной фазе.
Выделение продуктов. Дистилляция – традиционный способ выделения этанола, ацетона, бутанола из разведенных водных растворов. При дистилляции продуктов ацетоно-бутилового брожения можно использовать тепло, выделяющиеся при охлаждении стерилизованного нагреванием ферментера. Дистилляция – достаточно гибкий процесс, при котором возможно фракционирование и выделение каждого продукта.
Более современными методом выделения продуктов являются мембранные процессы, например ультрафильтрация и обратный осмос. Выделение продуктов проводятся по принципу первапорации; это мембранный процесс, в котором движущей силой служит большой вакуум с одной стороны мембраны, свойства которой определяют эффективность разделения.
Хорошие результаты получают при селективной адсорбции растворителями на силикате (цеолите). Этот процесс можно интегрировать с ферментацией и работать с боле концентрированными растворами. Комбинирование ферментации и выделения продуктов возможно только при проточном культивировании. Возможно применение химического выделения. Это новый метод, основанный на обратимой химической реакции.
Хотя многие из перечисленных методов применяют в лабораториях и на пилотных установках, в большой промышленности они не внедрены в силу недостаточности данных или высокой стоимости. Наиболее реально внедрение в промышленность способа предварительного удаления воды (обратный осмос) с последующей традиционной дистилляцией (Воробьева, 1989).
Похожие работы
... группы – эксфолиативные токсины, вызывающие спецефическое поражение кожного покрова и энтеротоксины. Энтеротоксины. Классический взгляд на энтеротоксины обусловлен рассмотрением их в качестве причины тяжелых пищевых отравлений, вызванных поступлением в желудочно-кишечный тракт экзопродуктов стафилококкового происхождения предварительно накопившихся в продуктах питания (Wieneke et al., 1993). ...
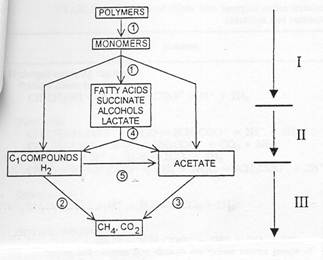
... ; 2-водородокисляющие метаногены; 3-ацетатпотребляющие метаногены; 4-вторичные бродильщики; 5-ацетогенные бактерии. (Schink,1997). Данная схема применима и к анаэробным сообществам микроорганизмов, разлагающих аминоароматические субстраты. Разделение метаболических функций и их распределение среди метаболически разных микроорганизмов является компенсацией отсутствия ...
... два других отдела, отделенных мембраной, пирреллюлозому или рибоплазму, которая содержит рибосомы и связанные белки, и свободный от рибосом парафоплазму (Glockner, 2003). 3. Характеристика общих свойств микроорганизмов Микроорганизмы - это организмы, невидимые невооруженным глазом из-за их незначительных размеров. Этот критерий - единственный, который их объединяет. В остальном мир ...
... в какой последовательности и как глубоко учащиеся будут изучать материал. По программе Сивоглазова В.И., Сухова Т.С., Козлова Т.А. в книге для учителя «Биология: общие закономерности» тема «Биогеохимическая деятельность микроорганизмов» не рассматривается как самостоятельная на отдельном уроке, а является составной частью других тем. Например, на уроке по теме «Значение прокариот в биоценозах, их ...
0 комментариев