Навигация
Применение ботулинического токсина в медицине
1.4 Применение ботулинического токсина в медицине
О существовании ботулинического токсина было известно на протяжении сотен лет, однако его благотворное воздействие было оценено по достоинству лишь в последние десятилетия. В 1895 году бельгийский профессор Эмиль Пьер Ван Ерменгем (Emile Pierre van Ermengem) из городка Элизель, Бельгия, идентифицировал бактерию Bacillus botulinus. Эта бактерия, впоследствии переименованная в Clostridium botulinum, производит нейротоксин, который является основной частью комплекса токсина ботулизма типа А.
В 1946 году доктор Эдвард Шанц (Edward J. Schantz) и его коллеги получили очищенный токсин ботулизма типа А в кристаллической форме. Таким образом, у исследователей впервые появился необработанный материал, который был необходим им для более детального изучения. Первый серьезный результат исследований появился в 1950-х годах, когда доктор Вернон Брукс (Vernon Brooks) обнаружил, что при введении в гиперактивную мышцу токсин ботулизма типа А блокирует высвобождение ацетилхолина из окончаний двигательных нервов, вызывая тем самым временное расслабление инъецированной мышцы. Открытие доктора Брукса вызвало новый интерес к ботулиническому токсину как к потенциально значимому терапевтическому средству.
В 1960-1970-х годах офтальмолог Алан Скотт (Alan B. Scott) из Центра исследования глаза Смита Кеттлуэлла (Калифорния,США) провел на приматах ряд опытов по введению токсина ботулизма типа А для лечения косоглазия. Целью опытов было определить возможность применения препарата для лечения косоглазия типа «офтальмологической дистонии» у людей.
В конце 1970-х годов доктор Скотт организовал собственную компанию - Oculinum, Inc., где продолжил изучение токсина ботулизма типа А. В 1978 году доктор Скотт получил разрешение FDA (Управления по контролю за продуктами и лекарствами) на исследование использования ботулинического токсина типа А на людях-добровольцах.
В 1988 году компания Allergan приобрела права на распространение разработанного доктором Скоттом препарата Oculinum, основанного на токсине ботулизма типа А, и проведение клинических исследований эффективности препарата при других показаниях, включая цервикальную дистонию.
В 1989 году компания Oculinum, Inc. получила разрешение FDA на продажу препарата Oculinum в США, как препарата для лечения косоглазия и блефароспазма, включая идиопатический блефароспазм или нарушение VII нерва у пациентов в возрасте от 12 лет.
Вскоре после этого компания Allergan Inc. приобрела компанию доктора Скотта. На основе успешного применения токсина ботулизма типа А в лечении косоглазия и блефароспазма, связанных с дистонией, компания Allergan получила разрешение FDA на изменение названия препарата на BOTOX®. Эта замена названия отразила стратегию Allergan, касающуюся развития других областей применения препарата.
BOTOX® используется в России уже более 10 лет с момента его первой регистрации в 1994 году для лечения блефароспазма и гемифациального спазма. В течение последних 10 лет неизменно возрастало количество показаний для применения BOTOX®. В настоящее время они включают цервикальную дистонию, детский церебральный паралич, спастичность, возникшую в результате инсульта, и подмышечный гипергидроз.
Перед употреблением нейротоксин ботулизма проходит специальную очистку и связывается с альбуминами. Такая связь делает токсин более устойчивым, сохраняет его биологическую активность, обеспечивает локальное действие препарата. Нейротоксин блокирует передачу двигательного импульса с нерва на мышечное волокно. После введения препарата наступает выраженное расслабление мимических мышц. Атрофии мышц не наблюдается, так как их кровоснабжение остаётся прежним. В среднем максимум терапевтического эффекта проявляется на 14-15 день. Нейротоксин блокирует передачу импульса не только на мышцы, но и на потовые железы и, т.о., уменьшает потоотделение. Препараты успешно применяются для лечения повышенного потоотделения на ладонях, в подмышечных впадинах и на стопах.
Продолжительность действия составляет 6-9 месяцев, иногда — до 1 года. Подвижность мускулатуры частично восстанавливается через 3-4 месяца, полное восстановление наблюдается через 5-8 месяцев. После повторных инъекции продолжительность эффекта доходит до 6-12 месяцев. Для достижения стойкого и длительного эффекта рекомендуется введение препаратов 2-3 раза в течение года. При местном введении в терапевтических дозах ботулинический токсин типа А не вызывает системного (на весь организм) действия, продолжительность лечения им неограниченна.
Относительные противопоказания: миастения, нарушения свёртываемости крови, воспалительный и/или инфекционный процесс в областях предполагаемых инъекций, общие заболевания в стадии обострения, приём лекарственных средств (антибиотиков, антикоагулянтов, антиагрегантов, реланиума, баклофена), хронические обструктивные заболевания лёгких, беременность и период грудного вскармливания, возраст младше 12 лет, нежелательно проводить процедуру в первые дни менструального цикла.
Возможные осложнения, такие как обратимое опущение верхнего века(частота возникновения 0,14%), опущение бровей (менее 1%), двоение в глазах (2%), отёк век (0,14%), не связаны с самими препаратами, они могут возникнуть при неправильном выборе способа и места введения, неадекватной дозе или при несоблюдении стерильности. Важно помнить, что все они бесследно исчезают со временем. Побочные эффекты: болезненность в месте инъекции (частота возникновения 1,3%), головная боль (2%), кровоизлияния в месте введения (6%), онемение в месте инъекции (менее 1%), аллергия (менее 1%). Нечувствительность к нейротоксину встречается редко (менее 0,1%) (www. BOTOX.com).
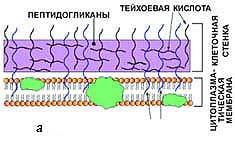
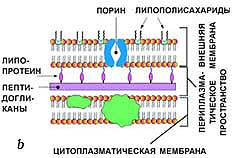
Род Clostridium включает анаэробные, грамположительные спорообразующие палочки, широко распространенные во внешней среде. Они обнаруживаются в почве, отложениях морских и пресных вод, кишечном тракте людей и животных. Представители рода могут быть патогенны для человека и животных, вызывая раневую инфекцию или кишечные заболевания, однако находят и практическое применение в промышленности (в парфюмерной промышленности, для получения в промышленном масштабе ацетона и бутанола), в медицине (для лечения блефароспазма, гемифациального спазма, цервикальной дистонии, детского церебрального паралича, спастичности, возникшей в результате инсульта, и подмышечного гипергидроза). Описано много видов, их количество в настоящее время превышает 100, однако многие из них остаются слабо изучены (Пивоваров, 2000).
Глава 2. Объекты и методы исследований
Похожие работы
... группы – эксфолиативные токсины, вызывающие спецефическое поражение кожного покрова и энтеротоксины. Энтеротоксины. Классический взгляд на энтеротоксины обусловлен рассмотрением их в качестве причины тяжелых пищевых отравлений, вызванных поступлением в желудочно-кишечный тракт экзопродуктов стафилококкового происхождения предварительно накопившихся в продуктах питания (Wieneke et al., 1993). ...
... ; 2-водородокисляющие метаногены; 3-ацетатпотребляющие метаногены; 4-вторичные бродильщики; 5-ацетогенные бактерии. (Schink,1997). Данная схема применима и к анаэробным сообществам микроорганизмов, разлагающих аминоароматические субстраты. Разделение метаболических функций и их распределение среди метаболически разных микроорганизмов является компенсацией отсутствия ...
... два других отдела, отделенных мембраной, пирреллюлозому или рибоплазму, которая содержит рибосомы и связанные белки, и свободный от рибосом парафоплазму (Glockner, 2003). 3. Характеристика общих свойств микроорганизмов Микроорганизмы - это организмы, невидимые невооруженным глазом из-за их незначительных размеров. Этот критерий - единственный, который их объединяет. В остальном мир ...
... в какой последовательности и как глубоко учащиеся будут изучать материал. По программе Сивоглазова В.И., Сухова Т.С., Козлова Т.А. в книге для учителя «Биология: общие закономерности» тема «Биогеохимическая деятельность микроорганизмов» не рассматривается как самостоятельная на отдельном уроке, а является составной частью других тем. Например, на уроке по теме «Значение прокариот в биоценозах, их ...
0 комментариев