Навигация
4. Методы клонирования ДНК
После того, как ДНК сшита в пробирке, ее необходимо размножить.
Существует два подхода к клонированию ДНК. Первый подход предполагает использование бактериальных или дрожжевых клеток для размножения введенной в них чужеродной ДНК. Второй способ представляет собой амплификацию ДНК in vitro.
Клонирование ДНК in vivo
Используя микроорганизмы, можно создавать два типа библиотек ДНК: геномную и клоновую (кДНК).
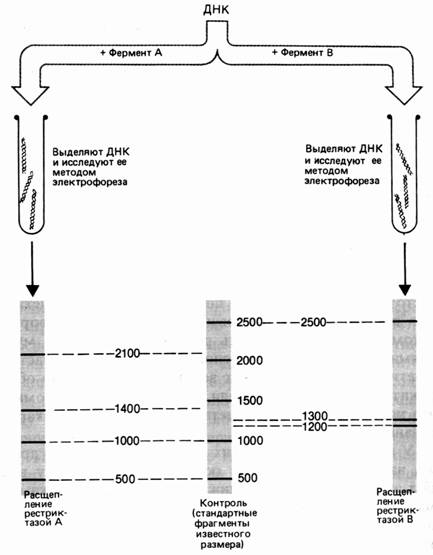
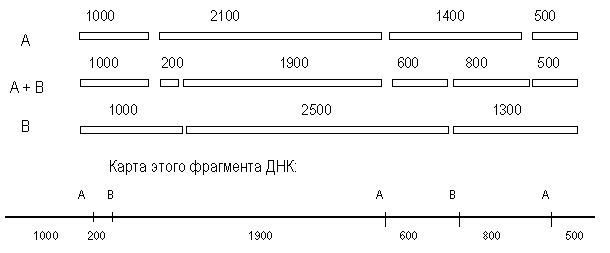
Геномная библиотека. Если геном какого-либо организма разрезать, вставить в плазмидные или вирусные вектора и ввести в клетку, то в таком виде его можно сохранить. При разрезании плазмидной или фаговой ДНК вероятность выпадения целых и неизмененных кусков генома довольно высока.
Такой способ получения геномной библиотеки получил название «метод дробовика», так как геном в данном случае представлен отдельными фрагментами.
Принципы создания плазмидных и вирусных векторов общие, поэтому рассмотрим их на примере плазмидных. Следует отметить, что из вирусных ДНК лучше использовать ДНК фагов, так как они имеют большую емкость и позволяют вставлять более крупные куски генома.
Очищенные кольцевые молекулы ДНК обрабатывают рестриктазой, получая линейную ДНК. Клеточную ДНК обрабатывают той же рестриктазой, добавляют к плазмидной, добавляют лигазы. Таким образом получают рекомбинантную плазмидную ДНК, которую вводят в бактериальные или дрожжевые клетки. Плазмида реплицируется с образованием многих копий. Многие плазмиды несут ген устойчивости к антибиотикам, и если в рекомбинантной плазмиде есть такой ген, то клетки легко выявлять, выращивая на среде с антибиотиком.
Каждая такая колония представляет собой клон или потомство одной клетки. Плазмиды одной колонии содержат клон геномной ДНК, а совокупность плазмид можно назвать библиотекой геномной ДНК. Недостаток такого метода в том, что фрагменты ДНК образуются в огромном количестве. Разрезание геномной ДНК определяется случаем, поэтому лишь часть фрагментов содержат полноценные гены. Некоторые фрагменты могут содержать только часть гена или же интронные последовательности.
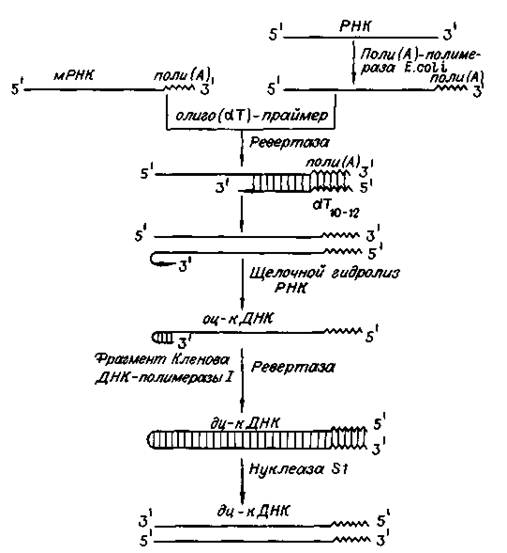
Библиотека кДНК. Создание кДНК начинается с синтеза на матрице РНК с помощью обратной транскриптазы комплементарной нити ДНК. Затем создают щелочные условия, разрушают цепь РНК на нуклеотиды, после чего с помощью ДНК-полимеразы синтезируют комплементарную цепь ДНК. При этом образуется фрагмент ДНК с тупыми концами. Такую ДНК встраивают в плазмиды и вводят в клетки бактерий. При амплификации плазмиды образуется клон комплементарной копии ДНК (кДНК).
Преимущества клоновой ДНК перед клонами геномной ДНК в том, что кодирующая белок нуклеотидная последовательность гена ничем не прерывается.
Гены эукариот содержат интроны, которые должны удаляться из транскриптной РНК перед превращением ее в матричную, после чего следует сплайсинг (сращивание). Бактериальные клетки не могут осуществлять такую модификацию РНК, образовавшуюся путем транскрипции гена эукариотической клетки. Поэтому если преследуют получение белка путем экспрессии клонированного гена, то лучше использовать банк кДНК, полученной на основе матричной РНК.
Методы клонирования ДНК
Полимеразная цепная реакция
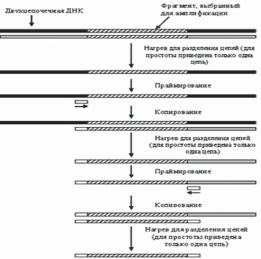
В 1985 году К. Мюллис с сотрудниками разработали метод клонирования последовательностей ДНК in vitro, который получил название полимеразной цепной реакции (ПЦР).
К анализируемому образцу ДНК добавляют в избытке 2 синтетических олигонуклеотида - праймера размером около 20 нуклеотидов. Каждый из них комплементарен одному из 3’-концов фрагмента ДНК. ДНК нагревают для разделения цепей двойной спирали, а при охлаждении происходит гибридизация праймеров с комплементарными участками фрагментов ДНК. В результате в растворе будут находиться однонитевые ДНК с короткими двухцепочечными участками - затравками (праймерами). При добавлении нуклеотидов и ДНК-полимеразы синтезируются комплементарные цепи и образуются идентичные фрагменты ДНК (первый цикл, рис. 43). Реакция останавливается и ДНК снова денатурируется прогреванием.
В процессе охлаждения праймеры, находящиеся в избытке, вновь эффективно гибридизуются, но уже не только с цепями исходной ДНК, но и с вновь синтезированными. Внесение в систему ДНК-полимеразы инициирует второй цикл полимеразной реакции. Многократное повторение описанной процедуры позволяет провести 30 и более циклов ферментативного удлинения праймеров. При этом число сегментов ДНК, ограниченных с обоих концов используемыми праймерами, с каждым циклом ПЦР увеличивается экспоненциально (приближается к зависимости 2n, где n — число циклов). Выход всех других продуктов реакции увеличивается по линейной зависимости (рис. 44). Таким образом, в процессе рассматриваемой реакции эффективно амплифицируется только та последовательность ДНК, которая ограничена праймерами.
Первоначально для ПЦР использовали фрагмент Кленова ДНК-полимеразы I E. coli. Однако недостатком данного подхода являлось то, что после каждого цикла реакции необходимо было вносить в реакционную смесь новую порцию фермента. Кроме того, в оптимальных температурных условиях такой полимеразной реакции (37 °С) появлялись вторичные участки связывания праймеров и наблюдалась амплификация незапланированных сегментов генома, т. е. специфичность амплификации не была полной. Существенное улучшение метода полимеразной цепной реакции было достигнуто после замены фрагмента Кленова на ДНК-полимеразу термофильной бактерии Thermus aquaticus (Taq-полимераза). Температурный оптимум реакции, направляемой Taq-полимеразой, находится в районе 70 °С. Другим важным свойством является то, что данная полимераза не инактивируется после длительной инкубации при 95 °С.
Используя Taq-полимеразу, удалось решить сразу две проблемы. Во-первых, термостабильная полимераза не инактивируется на этапе денатурации ДНК, и поэтому нет необходимости после каждого цикла реакции добавлять новую порцию фермента. Такое упрощение процедуры позволило автоматизировать проведение ПЦР, так как теперь требовалось лишь перенесение образца с определенным интервалом времени в разные температурные условия: 90—95 °С (температура денатурации) и 60—70 °С (температура ренатурации ДНК и ферментативной реакции). Во-вторых, высокий температурный оптимум реакции, катализируемой Taq-полимеразой, позволяет подбирать жесткие температурные условия отжига, обеспечивающие гибридизацию праймеров только в заданном районе изучаемого генома, что существенно повышает специфичность и чувствительность метода.
Используя метод ПЦР, можно in vitro селективно обогащать препарат ДНК фрагментом с определенной последовательностью в миллион и более раз. Это позволяет надежно выявлять однокопийные гены и их варианты в таких больших и сложных геномах, каким является геном человека. Чувствительность метода такова, что амплифицировать в ПЦР и выявить целевую последовательность можно даже в том случае, если она встречается однажды в образце из 105 клеток. Получаемый сегмент ДНК надежно выявляется в виде дискретной полосы после электрофоретического разделения молекул ДНК и окраски их этидиум бромидом. Если к праймеру пришить фермент, то ферментная метка будет накапливаться при амплифицировании. Продукт амплификации проверяется по принципу ИФА, то есть добавляется субстрат и отмечается изменение окраски. В качестве метки можно использовать стрептавидин (см. главу 3). Его можно пришивать как к праймеру, так и к нуклеотидам. В последнем случае нуклеотиды, меченные стрептавидином, добавляются к обычным, идущим на синтез комплементарной цепи ДНК. Этим достигается еще большее усиление сигнала.
Размноженный in vitro фрагмент получают в количествах, достаточных для его прямого секвенирования. Поскольку при этом не требуется промежуточный этап клонирования фрагмента ДНК в молекулярных векторах, ПЦР иногда называют бесклеточным молекулярным клонированием (cell-free molecular cloning). Автоматизированная процедура Taq-полимеразной цепной реакции, состоящая из 30 и более циклов, занимает 3—4 часа, что существенно быстрее и проще процедуры клонирования определенного
5.Контроль над исследованиями рекомбинантных ДНК
Споры о роли генетики начались задолго до современного расцвета генной инженерии. Еще в 1970-х годах не только ученое сообщество, но и широкая публика принялись обсуждать вопросы, связанные с противоречивыми перспективами новых биологических технологий. В чем же заключался основной вопрос? Основной темой споров была рекомбинантная ДНК, которую называли также химерной ДНК. В лабораторных условиях стало возможным создавать искусственные ДНК, комбинируя между собой гены разных видов и получая такие сочетания, которые бы никогда не встретились в природе. Большинство искусственных ДНК синтезируются в научных целях. Это контролируемые эксперименты, на основе которых ученые стремятся получить новые сведения об изучаемых ими биологических системах. Однако в некоторых случаях исследователям просто любопытно «посмотреть, что получится». Часто получаются ожидаемые результаты, но порой происходит нечто неожиданное. И это вполне объяснимо с научной точки зрения: ведь мы никогда не можем заранее все знать и все предсказать. Поэтому ученые никогда не могут обещать, что полученные ими клетки с рекомбинантными ДНК будут абсолютно безопасными. Именно такая неуверенность и послужила отправной точкой для дискуссий по поводу опасностей современной генетики.
С такой проблемой столкнулись молекулярные биологи, изучавшие в 1970-х годах гены вирусов, вызывающих возникновение рака, и внедрявшие их в бактерии Е. coli. При этом они руководствовались благими намерениями: изучить функции раковых генов на примере простых биологических систем. Но с помощью данной технологии можно было бы создать и вредные канцерогенные бактерии, заражающие людей. По мере развития технологии ученые все более приходили к мысли об опасном направлении своей работы и задумывались о ее глобальных последствиях. В конце концов, 11 известных молекулярных биологов опубликовали открытое письмо в престижных журналах «Nature» и «Science», призвав своих коллег наложить мораторий на определенные виды экспериментов и с большей осторожностью относиться к остальным опытам. В частности, они предлагали ввести запрет на эксперименты с генами устойчивости к антибиотикам, генами токсинов и генами канцерогенных вирусов; призывали организовать дискуссию на эту тему; просили Национальный институт здоровья США (NIH) разработать правила и принципы проведения подобных экспериментов.
Для ученого сообщества это был шаг огромной важности: перед лицом неизвестной и в общем-то не вполне определенной опасности ученые осознанно воздерживались от проведения экспериментов. Подписавшиеся под этим письмом, по всей видимости, не ожидали, какой резонанс вызовет их заявление во всем мире.
Как только о письме стало известно средствам массовой информации, широкая публика восприняла потенциальную опасность, как вполне реальную. «Если бы эти эксперименты не были так опасны, — часто рассуждали люди со стороны, — то разве ученые стали бы их запрещать?» Однако технология получения рекомбинантных ДНК открыла совершенно новые направления исследований. Перспективы получения Нобелевской премии и огромных экономических выгод также смущали ученых. Ко времени проведения дискуссий многие из них уже стремились не столько обсудить возможные этические проблемы, сколько убедить публику в безопасности своих работ. То, что начиналось как ответственный поступок, превратилось в нежелание допускать в свои планы непосвященных. И хотя многие противоречия к нашему времени уже удалось более или менее разрешить, да и накал страстей снизился, было бы полезно кратко напомнить о сути этих споров.
С 24 по 27 февраля 1975 года ряд известных во всем мире молекулярных биологов собрался в Аси-ломаре, близ города Монтерей в штате Калифорния. Некоторые из собравшихся заявили, что этические опасения преувеличены и потребовали продолжения важных исследований. Другие были обеспокоены возможными законодательными постановлениями или судебными преследованиями, если будет доказано, что исследования представляют опасность для здоровья. Многие же просто считали, что они попусту тратят время. На конференции было принято постановление продолжать исследования и заменить мораторий на ряд принципов, которых следует придерживаться при проведении экспериментов с различной степенью риска. Были высказаны следующие предложения:
увеличить число уровней безопасности для экспериментов, представляющих высокую степень потенциального риска;
использовать ослабленные разновидности генетически измененных микроорганизмов в специальных лабораторных условиях.
Главная трудность тогда (впрочем, как и сейчас) заключалась в том, чтобы оценить степень риска таких обстоятельств, о которых еще мало что известно. Национальный институт здоровья, финансирующий большую долю биологических проектов, взял инициативу в свои руки и разработал ряд положений, предложив их для открытого обсуждения. Для определения правил проведения исследований был образован Комитет по рекомбинантной ДНК, состоявший из экспертов разных областей биологии, а также из представителей частных компаний, использующих новые технологии. Последующие дискуссии также развертывались в основном вокруг возможных опасностей. И хотя от представителей промышленных компаний стоило ожидать того, что они будут ратовать за практически свободное экспериментирование, многие из них проявили ответственность и высказались за регулирование исследований. Они тоже опасались возможных негативных последствий и судебных исков в случае нанесения ущерба с их стороны, а потому также предложили разработать основные принципы. Другие же ученые утверждали, что им не дают работать, хотя исследования в области рекомбинантной ДНК помогли бы решить такие глобальные проблемы, как голод и инфекционные болезни.
23 июня 1976 года Дональд Фредериксон, директор Национального института здоровья, утвердил ряд формальных правил исследований в области рекомбинантной ДНК, придерживаться которых должны были все, кто получает гранты от этого института. В них были определены четыре уровня физической безопасности исследований согласно оцененной степени их риска. Первый уровень — безвредные эксперименты с использованием стандартных биологических технологий. С каждым последующим уровнем количество ограничений и предостережений возрастало настолько, что для экспериментов четвертого уровня — вроде тех, что показаны в фильме «Штамм Андромеды», — подходящих лабораторий не существовало вплоть до 1978 года. Кроме того, три штамма Е. coli были распределены по трем уровням биологической безопасности. Стандартные лабораторные штаммы обозначили как ЕК1. Штаммы ЕК2 были определены как характеризующиеся преднамеренно вызванной мутацией, способные выжить вне лаборатории с вероятностью 1 х 10-8. ЕКЗ — те же штаммы, только совершенно не способные выжить в организмах животных и растений или вне лаборатории. Для того чтобы вырастить ослабленный штамм Е. coli, в который можно было бы внедрить рекомбинантную ДНК, Рой Кер-тисс, член комитета при Национальном институте здоровья, разработал штамм хи-1776 (в честь 200-летия провозглашения независимости США), содержащий 15 отдельных блоков для нормального размножения. Роль, которую образованная публика может сыграть при решении вопросов, связанных с регулированием потенциально опасных научных исследований, прояснилась в ходе одного из обсуждений в Кембридже (штат Массачусетс). В тот день, когда были опубликованы правила проведения генетических экспериментов, мэр Кембриджа Альфред Ве-луччи открыл публичные слушания по поводу предложения построить специальную лабораторию по переносу генов животного вируса SV40 в Е. coli. Это предложение выдвинул Марк Пташне, ученый Гарвардского университета. На этом слушании присутствовал один из авторов этой книги. В Кембридже, где располагаются Гарвардский университет и Мас-сачусетский технологический институт, конечно же уже имелись многочисленные лаборатории, где проводились генетические эксперименты, но строительство нового здания требовало разрешения городского совета, и предложение Пташне, получившее широкую огласку, решили обсуждать на открытом заседании.
В течение двух с половиной часов перед представителями телевидения, радио и прессы, а также перед сотнями собравшихся выступали сторонники и противники строительства. Одни ученые приводили аргументы о необходимости строительства, утверждая, что такая лаборатория необычайно полезна для изучения рака, тогда как риск выведения опасных бактерий «крайне невелик». Другие ученые и представители общественности утверждали, что непредвиденные инциденты уже неоднократно происходили в самых надежно защищенных лабораториях и что, если будут выведены опасные микроорганизмы, их уже нельзя будет остановить. Вопросы мэра и его советников показывали, что они хорошо подготовились к слушаниям и ознакомились с материалом. В заключение мэр потребовал наложить двухлетний мораторий на все исследования рекомбинантной ДНК, проводимые в Кембридже, но городской совет предложил создать Экспериментальный гражданский совет по пересмотру (CERB) в составе восьми членов, не принадлежащих к кругу ученых. В него вошли четыре мужчины и четыре женщины: врач, философ, агент по продаже горючего, инженер-проектировщик, клерк, медсестра, социальный работник и домохозяйка. Члены совета ознакомились с необходимыми специальными сведениями из молекулярной биологии и в январе 1977 года вынесли единогласное решение — одобрить строительство лаборатории. Этот комитет создал прецедент для последующих слушаний подобного рода по поводу исследований в области рекомбинантной ДНК. Данный случай показал, что обычные граждане вполне способны понять научные проблемы и вынести здравое решение, не препятствующее развитию науки и не представляющее опасности для общества.
В Великобритании вопрос о рекомбинантной ДНК был решен иным образом. Правительство учредило Консультативную группу по генетическим манипуляциям (Genetic Manipulation Advisory Group, GMAG), в состав которой вошли политики, ученые и представители профсоюзов. Все предлагаемые эксперименты в области рекомбинантной ДНК должны получить одобрение GMAG, принятое на основе современных данных. Основное отличие от американской практики состоит в отсутствии общественного обсуждения, в объединении в одном органе представителей правительства, частного сектора и ученых и в том, что решение может быть изменено в свете последующих научных открытий. В настоящее время как минимум семь стран Европы учредили комитеты по генной инженерии. Канадский Медицинский исследовательский совет придерживается постановлений Национального института здоровья, но уделяет особое внимание вирусам и клеточным культурам млекопитающих.
Генетически модифицированные организмы
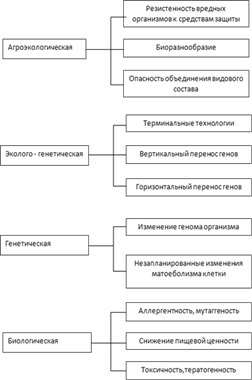
Вопросы общественного влияния на генетику и регулирования научных исследований в этой области, во многом не решены до сих пор. По мере совершенствования микробиологических технологий и методов появляются все новые и новые поводы для беспокойства. В настоящее время речь уже идет не о том, чтобы добавить несколько новых генов лабораторным бактериям. В наше время вполне доступной стала технология создания в коммерческих целях генетически модифицированных организмов, то есть трансгенных растений и животных с заданными признаками. Многие трансгенные организмы до сих пор содержатся в лабораториях для тестирования, но некоторые уже выпущены на рынок. Трансгенные технологии стали очередным поводом для жарких споров, так как здесь сошлись интересы получения выгоды и сохранения окружающей среды и здоровья людей. Вопрос сводится к тому, насколько безопасно внедрять в организм чужую ДНК и насколько далеко можно предвидеть результаты такого внедрения. Последние десять с лишним лет, в течение которых генетически модифицированные продукты использовались достаточно широко, доказали, что эти технологии не такие уж безвредные. Например, в некоторых случаях инсулин, полученный от трансгенных бактерий, приводил к неблагоприятным последствиям. Однако и особо опасных ситуаций еще не возникало. Национальный институт здоровья пересмотрел некоторые свои рекомендации, и теперь генетики могут пользоваться значительной свободой в своих экспериментах, хотя наиболее опасные из них по-прежнему находятся под контролем. Вопросы по поводу модифицированных организмов остаются, и стоит упомянуть хотя бы некоторые из них.
Первыми генетически модифицированными организмами были бактерии центров кристаллизации льда и помидоры сорта Flavrsaver, выведенные еще в 1970-х годах. Бактерии предназначались для того, чтобы после распыления на растениях они образовывали центры кристаллизации льда; таким образом можно было бы немного повысить устойчивость сельскохозяйственных культур к холоду и увеличить период роста. Помидоры должны были созревать позднее обычного, чтобы дольше сохраняться на складе. Планировалось также уменьшение отходов из-за помятых и слишком мягких экземпляров. После шумных протестов общественности разведение этих организмов запретили.
Многие генетики восприняли шум вокруг модифицированных продуктов как своего рода бурю в стакане воды, и, действительно, за первыми протестами последовало несколько относительно спокойных лет. Но два события показали, что некоторые представители общественности настроены резко против внедрения достижений современной генетики в повседневную жизнь. Сначала в 1993 году некто по прозвищу Унабомбер (позже выяснилось, что его настоящее имя Теодор Качински) послал почтой бомбу ведущему американскому генетику Чарльзу Эпштейну в знак протеста против «новой генетики». Этот инцидент получил широкое освещение в прессе. Позже, в 1996 году, многие газеты и журналы обошли фотографии, на которых члены организации «Гринпис» протестуют против генетически модифицированных продуктов. Это было довольно серьезное, хорошо организованное мероприятие с сотнями участников на надувных лодках «Зодиак» и большими плакатами с надписью «Остановим генетическое загрязнение». Своей мишенью «гринписовцы» выбрали грузовые суда, доставлявшие трансгенную сою из Северной Америки в Европу. Для ванкуверских генетиков (таких, как А. Гриффите и Д. Сузуки, авторов этой книги) это событие стало поистине двойным потрясением, поскольку организация «Гринпис», поначалу боровшаяся с китобойным промыслом и испытаниями ядерного оружия, зародилась именно в Ванкувере. Каким же ударом было узнать, что в разряд своих врагов она включила и «злых генетиков»! За последние несколько лет лихорадка протеста распространилась быстрыми темпами и охватила весь цивилизованный мир. Многочисленные демонстрации против генетически модифицированных продуктов стали обычным явлением; решительно настроенные члены радикальных группировок выражают свое гражданское неповиновение тем, что уничтожают трансгенные растения и даже пытаются разрушить фабрики по их производству и научные центры. Недавно вышел номер журнала «Экономист», на обложке которого была изображена чудовищная картофелина «Франкенфуд», восклицающая: «Кто боится ГМ-пищи?» (ГМ — генетически модифицированный продукт). В то же время и надежды ученых на то, что с помощью генетически модифицированных продуктов удастся накормить бедные страны и решить проблему голода, также не сбылись. Об этом мы поговорим далее.
Технологии в контексте Одна из сторон возникшей проблемы — научное просвещение. Как шутят агенты по продаже недвижимости, три ключевых элемента, помогающих продать дом, — это его место, место и еще раз место. Точно так же и в научном просвещении основные три момента — это контекст, контекст и еще раз контекст. Без знания контекста все новые открытия ученых подобны воздушным шарам — красивым, но ничего не значащим для остального человечества. Неприятие достижений современной генетики во многом коренится в том, что неизвестен контекст их применения, и поэтому мы должны для начала рассмотреть новые генетические технологии в свете технологии вообще.
Во всякой технологии есть свои положительные и отрицательные стороны. Многие согласятся с тем, что промышленная революция XIX века, основанная на научных достижениях в области физики и химии, повысила уровень жизни в индустриально развитых странах. Однако обратная сторона прогресса налицо. Например, промышленная революция подарила человечеству двигатель внутреннего сгорания, с помощью которого передвигаются автомобили и другие машины. Автомобиль люди любят за скорость, за то, что в нем легко перемещаться в удаленные места, но при этом он наносит большой ущерб окружающей среде и здоровью людей своими выхлопными газами, не говоря уже о том, что для производства автомобилей добывают в шахтах металлы, выкачивают из недр земли нефть; для строительства шоссе вырубают леса, уменьшая тем самым биологическое разнообразие. С развитием транспортной сети города растут и еще более уменьшают площадь нетронутых участков природы. Только в одной Канаде ежегодно около 16 тыс. смертей относят на счет загрязнения атмосферы транспортными средствами. К этому количеству нужно добавить тысячи тех, кто гибнет в автомобильных авариях. И эти смерти реальны, а не гипотетичны. Хотя все трагические случаи близко затрагивают членов семьи погибших, общество относится к ним снисходительно и считает неизбежной платой за те блага, которые принес двигатель внутреннего сгорания.
Химическая промышленность тоже производит огромные загрязнения. Химическая революция прошлого века (проходившая под лозунгом «Химия даст нам лучшие вещи для большего комфорта») подарила нам пластмассы, синтетические красители и многие другие полезные материалы. Но она же стала причиной пищевых отравлений инсектицидами, дыр в озоновом слое, загрязнения водоемов, радиоактивных отходов и тысяч ядовитых отстойников по всему миру. Химическая промышленность несет ответственность не только за многие болезни людей, но и за гибель бесчисленных растений и животных в естественных экосистемах.
Генетически модифицированные организмы следует рассматривать в таком же контексте. Конечно, никто не спорит с тем, что современные биотехнологии имеют свои отрицательные стороны с социальной, экологической и медицинской точек зрения, даже если до сих пор практически не было сообщений о заболеваниях, вызванных потреблением модифицированных продуктов. Но потенциальный вред любой технологии нужно рассматривать вместе с потенциальным благом от ее применения, и в этом отношении генетические технологии стоят вровень с другими технологиями.
Современные дискуссии по поводу применения генетических технологий следует вести с учетом опыта прошлого и использования в будущем любых технологий. Человечество уже достаточно ошибалось в прошлом, пора научиться осторожности. Таков основной принцип осторожности: при условии выбора тактики и при ограниченных возможностях предвидеть последствия, действовать так, чтобы причинить минимум вреда, и так, чтобы любой шаг был обратим. В любом случае не следует принимать важных решений, пока не будут тщательно рассмотрены все стороны проекта. Такая тактика основана на том, что в прошлом уже принимались безответственные решения об использовании новых технологий, не имеющих прецедентов, а возможность переносить гены из одного организма в другой действительно не имеет прецедентов. Когда обнаружилось, что ДДТ может убивать насекомых, то с помощью этого вещества надеялись навсегда покончить с вредителями. В 1948 году открывший его Пауль Мюллер получил Нобелевскую премию. И хотя генетики понимали, что отбор резистентных мутантов неизбежен, а экологи знали, что вредные насекомые представляют собой лишь небольшую часть всех насекомых, широкое применение инсектицида казалось вполне приемлемым способом контроля над извечными врагами полей. Никто и не предполагал, что ДДТ и другие химикаты распространятся в природе настолько, что войдут в пищевые цепи. Химикаты накапливаются в жировой ткани и вместе с пищей переходят в организм других животных. В процессе биомагнификации концентрация этих веществ увеличивается в тысячи, и даже сотни тысяч раз, достигая критического уровня в скорлуповых железах птиц и молочных железах женщин. Этот феномен обнаружили только после того, как начали исчезать многие хищники. Никакие меры предосторожности не помогали предотвратить столь непредвиденную опасность. Не было возможности предвидеть последствия применения и хлорфторуглеродов, которые в первое время называли чудом современной химии. Эти вещества химически инертны и служат прекрасными переносчиками химических веществ в аэрозольных баллончиках. Никто не знал, что хлорфторуглероды будут накапливаться в верхних слоях атмосферы и свободные радикалы хлора начнут разрушать озоновый слой. Природа революционных технологий такова, что мы не можем предусмотреть всех последствий их использования.
Заключение
Генетическая инженерия, а в частности работа с рекомбинантными ДНК на сегодняшний день является важнейшей и наиболее быстро развивающейся составной частью биотехнологии. Методы генной инженерии преобразуют клетки бактерий, дрожжей и млекопитающих в "фабрики" для масштабного производства любого белка. Это дает возможность детально анализировать структуру и функции белков и использовать их в качестве лекарственных средств. В настоящее время кишечная палочка (E. coli) стала поставщиком таких важных гормонов как инсулин и соматотропин. Ранее инсулин получали из клеток поджелудочной железы животных, поэтому стоимость его была очень высока. Для получения 100 г кристаллического инсулина требуется 800-1000 кг поджелудочной железы, а одна железа коровы весит 200 - 250 грамм. Это делало инсулин дорогим и труднодоступным для широкого круга диабетиков. В 1978 году исследователи из компании "Генентек" впервые получили инсулин в специально сконструированном штамме кишечной палочки. Инсулин состоит из двух полипептидных цепей А и В длиной 20 и 30 аминокислот. При соединении их дисульфидными связями образуется нативный двухцепочечный инсулин. Было показано, что он не содержит белков E. coli, эндотоксинов и других примесей, не дает побочных эффектов, как инсулин животных, а по биологической активности от него не отличается. Впоследствии в клетках E. coli был осуществлен синтез проинсулина, для чего на матрице РНК с помощью обратной транскриптазы синтезировали ее ДНК-копию. После очистки полученного проинсулина его расщепили и получили нативный инсулин, при этом этапы экстракции и выделения гормона были сведены к минимуму. Из 1000 литров культуральной жидкости можно получать до 200 граммов гормона, что эквивалентно количеству инсулина, выделяемого из 1600 кг поджелудочной железы свиньи или коровы.
Соматотропин - гормон роста человека, секретируемый гипофизом. Недостаток этого гормона приводит к гипофизарной карликовости. Если вводить соматотропин в дозах 10 мг на кг веса три раза в неделю, то за год ребенок, страдающий от его недостатка, может подрасти на 6 см. Ранее его получали из трупного материала, из одного трупа: 4 - 6 мг соматотропина в пересчете на конечный фармацевтический препарат. Таким образом, доступные количества гормона были ограничены, кроме того, гормон, получаемый этим способом, был неоднороден и мог содержать медленно развивающиеся вирусы. Компания "Genentec" в 1980 году разработала технологию производства соматотропина с помощью бактерий, который был лишен перечисленных недостатков. В 1982 году гормон роста человека был получен в культуре E. coli и животных клеток в институте Пастера во Франции, а с 1984 года начато промышленное производство инсулина и в СССР. При производстве интерферона используют как E. coli, S. cerevisae (дрожжи), так и культуру фибробластов или трансформированных лейкоцитов. Аналогичными методами получают также безопасные и дешевые вакцины.
На технологии рекомбинантных ДНК основано получение высокоспецифичных ДНК-зондов, с помощью которых изучают экспрессию генов в тканях, локализацию генов в хромосомах, выявляют гены, обладающие родственными функциями (например, у человека и курицы). ДНК-зонды также используются в диагностике различных заболеваний.
Технология рекомбинантных ДНК сделала возможным нетрадиционный подход "белок-ген", получивший название "обратная генетика". При таком подходе из клетки выделяют белок, клонируют ген этого белка, модифицируют его, создавая мутантный ген, кодирующий измененную форму белка. Полученный ген вводят в клетку. Если он экспрессируется, несущая его клетка и ее потомки будут синтезировать измененный белок. Таким образом можно исправлять дефектные гены и лечить наследственные заболевания.
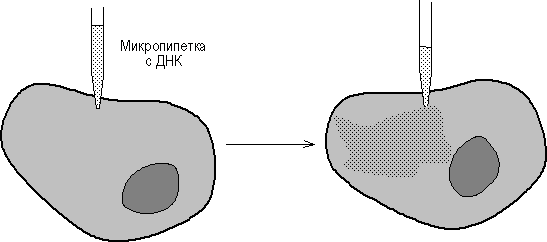
Если гибридную ДНК ввести в оплодотворенное яйцеклетку, могут быть получены трансгенные организмы, экспрессирующие мутантный ген и передающие его потомками. Генетическая трансформация животных позволяет установить роль отдельных генов и их белковых продуктов как в регуляции активности других генов, так и при различных патологических процессах. С помощью генетической инженерии созданы линии животных, устойчивых к вирусным заболеваниям, а также породы животных с полезными для человека признаками. Например, микроинъекция рекомбинантной ДНК, содержавшей ген соматотропина быка в зиготу кролика позволила получить трансгенное животное с гиперпродукцией этого гормона. Полученные животные обладали ярко выраженной акромегалией.
Сейчас даже трудно предсказать все возможности, которые будут реализованы в ближайшие несколько десятков лет.
Список литературы
1. Баурин В.В., Мирошниченко О.И., Захарченко В.И. и др. // Генноинженерные сельскохозяйственные животные, Москва, 1995, с. 154-165.
2. Бондарук В.В., Захарченко В.И., Беляева Р.Х. и др. // Генноинженерные сельскохозяйственные животные, Москва, 1995, с. 138-153.
3. Брем Г., Зиновьева Н., Эрнст Л.К. // С.-х. биология, 1993, № 6, с. 3-27.
4. Брем Г., Кройслих Х., Штранцингер Г. Экспериментальная генетика в животноводстве // М.: РАСХН, 1995, 326 с.
5. Васильев И.М., Шихов И.Я., Некрасов А.А. и др. // Доклады АН СССР, 1989, № 1, с. 206-209.
6. Гольдман И.Л., Башкеев Е.Д., Гоголевский П.А. и др. // Доклады РАСХН, 1992, № 9-10, с. 25-30.
7. Гольдман И.Л., Разин С.В., Эрнст Л.К. и др. // Биотехнология, 1994, № 2, с. 3-12
8. Ениколопов Г.Н., Захарченко В.И., Гращук М.А. и др. // Доклады АН СССР, 1988, т. 299, № 5, с. 1246-1249.
9. Зеленина И.А., Семенова М.Л., Алимов А.А. и др. // Генетика, 1991, Т. 27, № 12, с. 2182-2186.
10. Зиновьева Н.А. // Автореф. докт. дисс.: Дубровицы, 1998, 36 с.
11. Зиновьева Н., Безенфельдер У., Мюллер С. и др.// Биотехнология, 1998а, № 1, с. 3-11
12. Зиновьева Н., Безенфельдер У., Мюллер С. и др.// С.-х. биология,1998б, № 6, с. 31-34.
13. Зиновьева Н., Безенфельдер У., Мюллер М. // Биотехнология, 1998в, 4, 17-31.
14. Зиновьева Н.А., Эрнст Л.К., Брем Г. Трансгенные животные и возможности их использования: молекулярно-генетические аспекты трансгенеза в животноводстве // Дубровицы, 2000, 128 с.
15. Кузнецова И.В., Кузнецов А.В., Сигаева В.А. и др. // Биотехнология, 1993, т. 11-12, с.2-5.
16. Ларионов О., Добровольский В., Лагутин О. // «Новые направления биотехнологии», Пущино, 1994, 127.
17. Козикова Л.В., Медведев С.Ю., Булла Й. И др. // «Биотехнология в растениеводстве, животноводстве и ветеринарии», Москва, 2001, с. 160-161.
18. Колесников В.А., Алимов А.А., Барминцев В.А. и др. // Генетика, 1990; Т. 26, № 12, с. 2122-2126.
19. Колесников В.А., Зеленина И.А., Семенова М.Л. и др. // Онтогенез, Т. 26, № 6, 467-480.
20. Кузнецов А.В., Кузнецова И.В. // Онтогенез, 1995, Т.26, № 4, с. 300-309.
21. Кузнецова И.В., Кузнецов А.В., Сигаева В.А. и др. // Биотехнология, 1993, № 11-12, с. 2-5.
22. Кузнецова И.В., Щит И.Ю.; Кузнецов А.В. // С.-х. биология, 1998; № 6, с. 40-44.
23. Мирошниченко О.И., Захарченко В.И., Прокофьев М.И. и др. // Доклады ВАСХНИЛ, 1988, № 5, с. 31-32.
24. Прокофьев М.И., Ларионов О.А., Мезина М.Н. и др. // «ДНК-технологии в клеточной инженерии и маркировании признаков сельскохозяйственных животных», Дубровицы, 2001, с. 114-115.
25. Розенкрантц А.А., Ячменев С.В., Соболев А.С. // Доклады АН СССР, 1990, Т. 312, № 2, с. 493-494.
26. Рядчиков В.Г., Солодухина Л.И., Соколов Н.В. и др. // Генноинженерные сельскохозяйственные животные, Москва, 1995, с. 73-84.
27. Савченкова И., Зиновьева Н., Булла Й. и др. // Успехи совр. биологии, 1996, 116 (1), 78-91.
28. Титова В.А., Зиновьева Н.А., Савченкова И.П. и др. // Доклады РАСХН, 2001, № 6, с. 29-31.
29. Чистяков Д.А., Захарченко В.И., Мезина М.Н. и др. // Генноинженерные сельскохозяйственные животные, Москва, 1995, с. 127-137.
30. Шафен Р.А., Зеленина И.А., Семенова М.Л. и др. // Онтогенез, 2000, Т. 31, № 5, с. 388-394.
31. Эрнст Л.К. // Сельскохозяйственная биология, 1987, № 11, с. 11-17.
32. Эрнст Л.К. Проблемы селекции и биотехнологии сельскохозяйственных животных // Москва, 1995, 359 с.
33. Эрнст Л.К. Генная инженерия – важный фактор селекции сельскохозяйственных животных // «ДНК-технологии в клеточной инженерии и маркировании признаков сельскохозяйственных животных», Дубровицы, 2001, с. 7-18.
34. Эрнст Л.К., Георгиев Г.П., Ениколопов Г.Н. // Вестник с.-х. науки, 1987, № 9, с. 68-73.
35. Эрнст Л.К., Гольдман И.Л., Кадулин С.Г. // Биотехнология, 1993, № 5, с. 2-14.
36. Эрнст Л.К., Брем Г., Махаев Е.А. // Генноинженерные сельскохозяйственные животные, Москва, 1995а, с.48-53.
37. Эрнст Л., Гольдман И., Зиновьева Н. и др.// Доклады РАН, 1995б, 345 (4), 555-558.
38. Эрнст Л.К., Гольдман И.Л., Семенова В.А. и др. // Овцеводство, 1991, № 5, с. 14-16.
39. Эрнст Л.К., Гольдман И.Л., Семенова В.А. и др. // Доклады ВАСХНИЛ, 1990, № 6.
40. Эрнст Л.К., Кузин Б.А., Ениколопов Г.Н. и др. // Доклады ВАСХНИЛ, 1989, № 9, с. 45-49.
Похожие работы
... , вызванные динамическими му-тациями.-----------------------T-----------T-------T-----T------T------T----------------------¬ Болезнь, номер по ¦ Ген, лока-¦Триплет¦Норма¦Прему-¦Мута- ¦Литература ¦ МакКьюсику (MIM) ¦ лизация ¦ ¦ ¦тация ¦ция ¦ ¦ -----------------------+-----------+-------+-----+------+------+----------------------+ Синдром ломкой X-хро- ¦FMR1, FRAXA¦(CGG)n ...
... . Совокупность сцепленных генов одной хромосомы, контролирующих аллогруппу, называют гаплотипом. Значение: 1) изучение причин и динамики генотипической изменчивости, составляющей основу эволюционной генетики; 2) уточнение происхождения отдельных животных; 3) определения моно- и дизиготных двоен; 4) построение генетических карт хромосом; 5) использование биохимических систем в качестве генетических ...
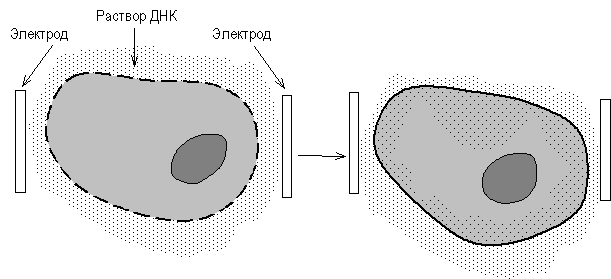
... векторов для экспрессии. 2.2 Способы прямого введения гена в клетку Прямое введение гена в клетку осуществляют несколькими способами: 1. Трансфекция 2. Микроинъекция 3. Электропорация 4. Метод «мини-клеток» 5. Упаковка в липосомы 6. Электронная пушка При трансфекции ДНК адсорбируется на кристаллах фосфата кальция (Грэхем Ван дер Эб, ...
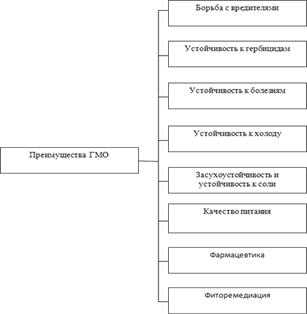
... применением методов генной инженерии; В работе используется понятие «генетически модифицированные продукты (организмы)», под которыми понимаются продукты питания содержащие результаты генно-инженерной деятельности. 1. Технология ГМО 1.1 Технология получение ГМО Процедура получения ГМО включает в себя несколько основных этапов: • Выделение и идентификация отдельных генов (соответствующих ...

0 комментариев