Навигация
Определение радиальной скорости роста
2.5 Определение радиальной скорости роста
Определение радиальной скорости роста грибов проводили на плотной питательной среде за определенный промежуток времени. После 48 часов инкубации при 25±20С измеряют диаметр выросших на чашках колоний при помощи линейки. Эту операцию повторяют через каждые двое суток в течение двух недель.
За диаметр отдельной колонии в данный момент времени принимают среднее арифметическое измерение. Вычисление радиальной скорости проводят по формуле:
Kr= (r – ro) / (t – to),
где k – радиальная скорость роста;
ro – радиус колоний в начальной момент времени to;
r – радиус колоний в момент времени t (Паников, 1991).
3. Исследование роста микромицетов рода Aspergillus на различных источниках углеродного питания
Объектами исследования явились различные виды микроскопических грибов рода Aspergillus: A. niger, A. ustus, A. terreus, A. flavus и A. fumigatus. В качестве источника углерода использовали из легкоусвояемых: сахара (сахароза, лактоза, ксилоза, арабиноза, галактоза, мальтоза), многоатомные спирты (глицерин, манит, сорбит), крахмал; из трудноразлагаемых (нефть, целлюлоза, гербицид, пестицид).
В результате посева исследуемых видов Aspergillus на среду Чапека с различными источниками углерода и среду Частухина с целлюлозой было установлено, что изменение экологических условий оказывает существенное влияние на развитие микромицетов. Была изучена способность штаммов использовать различные легкоусвояемые и трудноусвояемые источники углерода методом определения радиальной скорости роста выросших колоний. Оценка возможности потребления различных источников углерода показала, что они способны утилизировать многие источники углеродного питания, но ни один из исследуемых видов не разлагал такие трудноусвояемые вещества, как гербицид и пестицид. Динамика роста видов на разных средах при одинаковых условиях инкубации, не одинакова.
В таблице приложения и на рисунках 1–15 приведены зависимости радиальной скорости роста от времени у изученных грибов на различных источниках углерода.
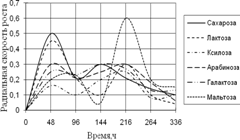
Рис. 1. Радиальная скорость роста A. niger на сахарах
Уже на первые сутки культивирования A. niger хорошо развивается во всех средах, кроме среды с ксилозой. Затем наблюдается скачок роста на средах с сахарозой и галактозой. К концу времени инкубации скорость роста колоний уменьшается и наибольшей становится на среде с мальтозой. Наибольшие биологические ритмы приходятся на 48–96 ч. и 144–264 ч. времени культивирования.
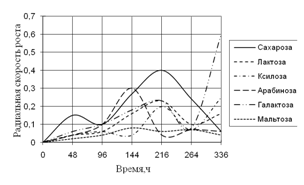
Рис. 2. Радиальная скорость A. terreus на сахарах
В первые дни культивирования наибольшая скорость роста A. terreus наблюдается на средах с сахарозой, арабинозой и галактозой. Затем происходит скачок роста на средах с сахарозой и арабинозой. На 14-е сутки культивирования наблюдается резкий скачок в росте на среде с галактозой. Биологические ритмы максимальны на 144–264 ч. дни инкубации.
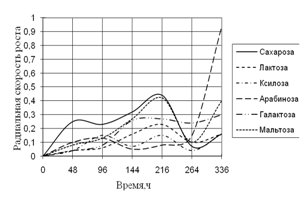
Рис. 3. Радиальная скорость роста A. fumigatus на сахарах
Наибольший рост A. fumigatus наблюдается на среде с сахарозой. Затем на этой среде рост уменьшается и происходит резкий скачок радиальной скорости на среде с арабинозой. К концу времени культивирования наблюдаются наибольшие биоритмы.
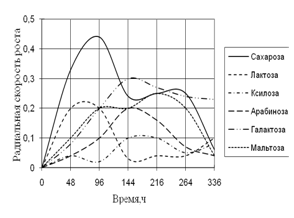
Рис. 4. Радиальная скорость роста A. flavus на сахарах
Из данных рисунка 4 видно, что A. flavus хорошо растет на среде с сахарозой. Но к концу культивирования наибольшая скорость роста наблюдается с галактозой. Максимальные биоритмы приходятся на начальный момент времени культивирования – 48–144 ч.
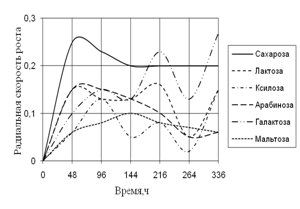
Рис. 5. Радиальная скорость роста A. ustus на различных сахарах
По данным рисунка 5 видно, что наибольшую скорость в течение всего времени инкубации A. ustus проявляет на среде с сахарозой, и резкий скачок в росте наблюдается на среде с галактозой. На протяжении всего времени инкубации рост A. flavus характеризуется высокими биоритмами.
Таким образом, сахара легко усваиваются всеми исследуемыми штаммами. Наибольшие биологические ритмы наблюдаются в течение всего времени экспозиции, как и в начальные часы, так и в конце инкубации.
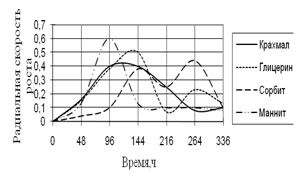
Рис. 6. Радиальная скорость роста A. niger
Наибольшая скорость роста A. niger наблюдается вначале культивирования на среде с маннитом. Затем скорость роста резко падает и становится минимальной на этой среде. На других источниках углерода также наблюдаются скачки роста, которые к концу инкубации заметно уменьшаются. Максимальные биоритмы приходятся на начальный момент времени культивирования – 48–144 ч.
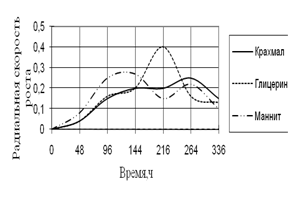
Рис. 7. Радиальная скорость роста A. terreus
Рост A. terreus наблюдается на всех легкоусвояемых источниках углерода, кроме среды с сорбитом. Вначале и в конце культивирования радиальная скорость роста примерно одинаковая. В середине инкубации наблюдаются скачки роста, особенно на среде с глицерином. Наибольшие биологические ритмы приходятся на 144–264 ч. времени культивирования.
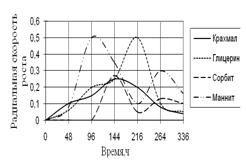
Рис. 8. Радиальная скорость роста A. fumigatus
По данным графика видно, что рост A. fumigatus имеет большие скачкообразные изменения, особенно проявляющиеся на средах с маннитом и глицерином. Наибольшая скорость роста проявляется на среде с маннитом, к середине инкубации наблюдается скачок роста на среде с глицерином. Биологические ритмы характеризуются большими колебаниями и приходятся на середину времени экспозиции – 96 ч. и 216 ч.
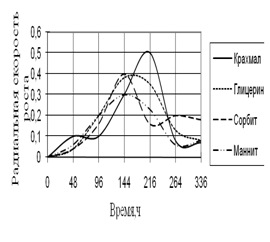
Рис. 9. Радиальная скорость роста A. flavus
Радиальная скорость роста A. flavus вначале и в конце культивирования примерно одинаковая. В середине инкубации наблюдаются скачки роста, особенно на среде с крахмалом. Высокие биоритмы наблюдаются на 144–264 ч. инкубации.
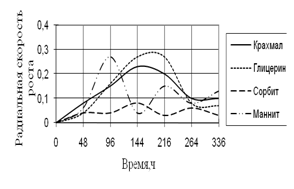
Рис. 10. Радиальная скорость роста A. ustus
Наибольшая скорость роста A. ustus наблюдается на средах с маннитом и глицерином. Скорость роста на среде с сорбитом наименьшая и в течение всего времени культивирования значительно не изменяется. Также как и A. fumigatus, A. ustus проявляет большие биоритмы на 144–216 ч.
В целом, рост микромицетов на многоатомных спиртах и крахмале характеризуется высокими биологическими ритмами, приходящимися на середину времени культивирования – 144–264 ч.
Ни один из исследуемых штаммов не растет на средах с единственными источниками углерода в виде пестицида и гербицида.
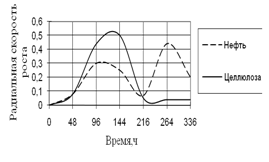
Рис. 11. Радиальная скорость A. niger на трудноразлагаемых источниках углерода
На трудноразлагаемых источниках углерода рост A. niger наблюдается на средах с целлюлозой и нефтью. В начале инкубации скорость роста на обеих средах одинакова, затем резко увеличивается на среде с целлюлозой, но к концу культивирования она становится минимальной, и происходит скачок роста на среде с нефтью. Максимальные биологические ритмы приходятся к середине времени культивирования – к 96–216 ч.
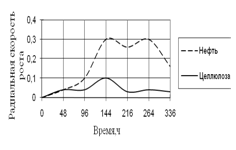
Рис. 12. Радиальная скорость роста A. terreus на трудноразлагаемых источниках углерода
Из трудноразлагаемых источников углерода A. terreus использует такие, как нефть и целлюлоза. Радиальная скорость роста на обоих источниках в начале культивирования была одинаковой, затем на среде с нефтью резко увеличивается к середине инкубации. На среде с целлюлозой резких скачков роста не наблюдается. Высокие биоритмы также находятся в центре экспозиции – 144–264 ч.
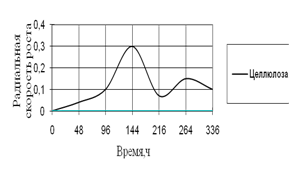
Рис. 13. Радиальная скорость роста A. fumigatus на трудноразлагаемых источниках углерода
На трудноусвояемых источниках углерода рост A. fumigatus наблюдается только на среде с целлюлозой. На 7-е сутки культивирования наблюдается резкий скачок роста, затем он уменьшается до начальной величины. Максимальные биоритмы приходятся на время инкубации – 96–216 ч.
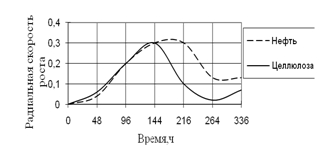
Рис. 14. Радиальная скорость A. flavus на трудноразлагаемых источниках углерода
Скорость роста на обоих источниках вначале культивирования была примерно одинаковой, максимальной – к середине инкубации, а затем она резко уменьшается. К концу культивирования наибольшая скорость роста A. flavus наблюдается на нефти.
Высокие биологические ритмы приходятся на середину времени экспозиции – 96 ч. и 216 ч.
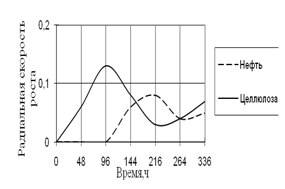
Рис. 15. Радиальная скорость роста A. ustus на трудноразлагаемых источниках углерода
Также как и другие виды, A. ustus проявляет свой рост только на средах с нефтью и целлюлозой. В начале культивирования на среде с целлюлозой наблюдается максимальная скорость роста. На 7-е сутки инкубации происходит скачок роста на среде с нефтью. К концу времени инкубации скорость роста A. ustus на обеих средах примерно одинаково. Наибольшие биоритмы характерны 48–144 ч.
Рост исследуемых штаммов на трудноразлагаемых источниках углерода характеризуются высокими биоритмами в середине экспозиции.
Таким образом, при определении способности штаммов использовать различные легкоусвояемые источники углерода, было выяснено, что на сахарах наибольшая скорость роста A. niger наблюдается на среде с мальтозой. A. terreus, A. fumigatus и A. ustus проявляют наибольшую скорость роста на средах с галактозой, а A. flavus – на среде с сахарозой. На крахмале и многоатомных спиртах все исследуемые штаммы проявляли высокую скорость роста, за исключением A. terreus, рост которого на среде с сорбитом вообще не наблюдался.
Из трудноразлагаемых источников углерода исследуемые штаммы утилизировали только нефть и целлюлозу, кроме A. fumigatus, который проявлял способность к росту только на среде с целлюлозой. Причем все виды имели высокую радиальную скорость роста на обеих средах.
Максимальные биологические ритмы при росте на сахарах наблюдаются в течение всего времени экспозиции. Это объясняется тем, что они легко усваиваются микромицетами. На крахмале, спиртах и трудноусвояемых источниках углерода наибольшие биоритмы приходятся на 96–216 ч. – середину инкубации.
Выводы
1) Была определена способность исследуемых штаммов использовать легкоразлагаемые источники углерода. При определении способности штаммов использовать различные легкоусвояемые источники углерода, было выяснено, что из сахаров A. niger отдает предпочтение мальтозе. A. terreus, A. fumigatus и A. ustus предпочитают среду с единственным источником углерода в виде галактозы, а A. flavus – среде с сахарозой. На крахмале и многоатомных спиртах все исследуемые штаммы проявляли высокую скорость роста, за исключением A. terreus, рост которого на среде с сорбитом вообще не наблюдался.
2) Определена способность штаммов использовать такие трудноразлагаемые источники углерода, как нефть и целлюлоза. Отсутствие роста на средах с гербицидом и пестицидом объясняется сильным токсическим действием их на микромицеты и не способностью изученных штаммов использовать данные вещества в качестве источника углерода.
СПИСОК ЛИТЕРАТУРЫ
1) Андреюк, Е.И. Микробная коррозия и ее возбудители [Текст] / Е.И. Андреюк, В.И. Билай, Э.З. Коваль, И.А. Козлова. – Киев: Наук. думка, 1980. – 286 с.; 22 см. – Библиогр.: с. 156. – 200 экз.
2) Бабьева, И.П. Изменения численности микроорганизмов в почвах при загрязнении тяжелыми металлами [Текст] / И.П. Бабьева, С.В. Левин, Н.С. Решетова // Тяжелые металлы в окружающей среде. – М.: Изд-во Моск. ун-та, 1980. – С. 115. – Библиогр.: с. 75.
3) Бабьева, Е.Н. Сравнительно-экологические исследования микромицетов из почв отдаленных географических районов [Текст] / Е.Н. Бабьева // Микология и фитопатология. Сер. 17. – 1983. – №2. – С. 452–453. – Библиогр.: с. 452–453.
4) Биоповреждения [Текст] / Под ред. В.Д. Ильичева. – М.: Изд-во Моск. ун-та, 1987. – 352 с.; 24 см. – Библиогр.: с. 207–208. – 200 экз. – ISBN 5–02634–675–3.
5) Блажеевская, Ю.В. Сравнительный анализ скорости радиального роста микромицетов, выделенных из различных экотопов [Текст] / Ю.В. Блажеевская, В.В. Вембер, Н.Н. Жданова // Микробиологический журнал. – 2002. – Т. 64. – №3. – С. 3–11. – Библиогр.: с. 49–50.
6) Богомолова, Е.В. Морфологические особенности микроколониальных грибов, изолированных с поверхности камня [Текст] / Е.В. Богомолова, М.С. Зеленская, Д.Ю. Власов // Микология и фитопатология. Сер. 35. – 2001. – №3. – С. 6–13. – Библиогр.: с. 17.
7) Бухало, А.С. Высшие съедобные базидиомицеты в чистой культуре [Текст] / А.С. Бухало. – Киев: Наук. думка, 1988. – 144 с.; 21 см. – Библиогр.: с. 76. – 3000 экз.
8) Великанов, Л.Л. Некоторые биохимические аспекты в экологии грибов [Текст] / Л.Л. Великанов, И.И. Сидорова // Успехи микробиологии. Сер. 3. – 1983. – №18. – С. 112–132. – Библиогр.: с. 128.
9) Воронин, Л.В. Микрофлора некоторых видов рыб Куйбышевского водохранилища [Текст] / Л.В. Воронин // Биология внутр. вод. – 1999 – №76. – С. 11–15. – Библиогр.: с. 13.
10)Гарибова, Л.В. Основы микологии: Морфология и систематика грибов и грибоподобных организмов [Текст]: учеб. пособие / Л.В. Гарибова, С.Н. Лекомцева – М.: Товарищество научных изданий КМК, 2005. – 202 с.; 25 см. – Библиогр.: с. 196–199. – 2000 экз. – ISBN 5–87317–265-X.
11)Григорьев, А.М. Изучение роста фрагментов мицелия Fusarium oxysporum в условиях разной кислотности среды [Текст] / А.М. Григорьев, М.В. Горленко, О.Е. Марфенина // Микология и фитопатология. – 2004. – №3. – С. 29–35. – Библиогр.: с. 30–31.
12)Долгова, А.В. Рост колоний Penicillium chrysogenum Thom. при постоянных и переменных температурах [Текст] / А.В. Долгова, В.В. Зданович // Микология и фитопатология. Сер. 31. – 1997. – №1. – С. 52–56. – Библиогр.: с. 55.
13)Дудка, И.А. [Текст] Водные несовершенные грибы СССР / И.А. Дудка. – Киев: Наук. думка, 1985. – 188 с.; 24 см. – Библиогр.: с. 154. – 1500 экз. – ISBN 5–137–06374–4.
14)Евдокимова, Г.А. Микробиологическая активность почв при загрязнении тяжелыми металлами [Текст] / Г.А. Евдокимова // Почвоведение. – 1982. – №6. – С. 125 – 132. – Библиогр.: с. 130.
15)Звягинцев, Д.Г. Биология почв [Текст]: учебник / Д.Г. Звягинцев, И.П. Бабьева, Г.М. Зенова – 3-е изд., испр. и доп. – М.: Изд-во МГУ, 2005. – 445 с.: ил.; 25 см. – Библиогр.: с. 373–375 – 3000 экз. – ISBN 5–211–04983–7.
16)Иванова, А.Е. Жизнеспособность фрагментов мицелия почвенных микроскопических грибов в разных экологических условиях [Текст]: автореф. канд. дис…; утверждена; защищена 30.03.99. / Иванова Анна Евгеньевна. – М.: МГУ, 1999. – 30 с.
17)Иванова, А.Е. Влияние экологических факторов на способность к росту фрагментов мицелия и прорастание спор микроскопических грибов [Текст] / А.Е. Иванова, О.Е. Марфенина // Микробиология. – 2001. – №2. – С. 235–240. – Библиогр.: с. 236.
18)Коваль, Э.З. Микодеструкторы промышленных материалов [Текст] / Э.З. Коваль, Л.П. Сидоренко. – Киев: Наук. думка, 1989. – 192 с.; 22 см. – Библиогр.: с. 135–136. – 300 экз. – ISBN 5–015–02369–7.
19)Кочкина, Г.А. Радиальная скорость роста грибов в связи с их экологией [Текст] / Г.А. Кочкина, Т.Г. Мирчинк, П.А. Кожевин, Д.Г. Звягинцев // Микробиология. – 1978. – №5. – С. 964–965. – Библиогр.: с. 964.
20)Лилли, В. Физиология грибов [Текст] / В. Лилли, Г. Барнетт. – Москва: Изд-во иностр. литературы, 1953. – 532 с.; 25 см. – Библиогр.: с. 152, 174–184. – 2000 экз. – ISBN 5–248–00487–4.
21)Марьиновская, Ю.В. Микробиологическая деструкция целлюлозосодержащих отходов [Текст] / Ю.В. Марьиновская, Н.Н. Севастьянова // Микробиология. – 2006. – №3. – С. 75 – 81. – Библиогр.: с. 78.
22)Мирчинк, Т.Г. Почвенная микология [Текст]: учебник / Т.Г. Мирчинк: – М.: Изд-во МГУ, 1988. – 220 с.; 22 см. – Библиогр.: с. 154 -165. – 2940 экз. – ISBN 5–211–00157–5.
23)Мюллер, Э. Микология [Текст] / Э. Мюллер, В. Леффлер; перевод с немецкого канд. биол. наук К.Л. Тарасова. – М.: Мир, 1993. – 535 с.; 25 см. – Библиогр.: с. 90–94, с. 139–140. – 2000 экз. – ISBN 5–214–01254–7.
24)Ниязова, Г.А. Концентрирование цинка и свинца различными микроорганизмами, обитающими в почве Сумсарского свинцово-цинкового субрегиона [Текст] / Г.А. Ниязова, С.В. Летунова, Б.Н. Золотарева // Микробиология. – 1982. – №4. – С. 650–656. – Библиогр.: с. 654.
25)Паников, Н.С. Кинетика роста микроорганизмов [Текст] / Н.С. Паников. – М.: Наука, 1991. – 309 с.; 22 см. – Библиогр.: с. 245. – 1500 экз. – ISBN 3–271–00356–5.
26)Пидопличко, Н.М. Грибная флора грубых кормов [Текст] / Н.М. Пидопличко. – Киев: Наук. думка, 1953. – 482 с.; 21 см. – Библиогр.: с. 246. – 700 экз.
27)Практикум по микробиологии [Текст] / Под ред. А.И. Нетрусова. – М.: Академия, 2005. – 608 с.; 28 см. – Библиогр.: с. 239–240. – 5100 экз. – ISBN 5–7695–1809-X.
28)Романов, Ю.А. Биологические ритмы на разных уровнях биологической организации [Текст] / Ю.А. Романов // Проблемы космической биологии. – 1980. – №4. – С. 10–25. – Библиогр.: с. 11.
29)Сычугова, О.В. Рост и развитие микромицетов на сополимере этилена и винилацетата с добавками крахмала [Текст] / О.В. Сычугова, Н.Н. Колесникова // Вестн. Моск. ун-та. Сер. 16, Биология. – 2003. – №4. С. 27–31. – Библиогр.: с. 28.
30)Терехова, В.А. [Текст] Микромицеты в экологической оценке водных и наземных экосистем / В.А. Терехова. – М.: Наука, 2007. – 215 с.; 21 см. – Библиогр.: с. 33–35. – 2000 экз. – ISBN 5–453–06754–3.
31)Фомин, В.А. Биоразлагаемые полимеры: состояние и перспективы использования [Текст] / В.А. Фомин, В.В. Гузеев // Пластические массы. – 2001. – №2. – С. 42–46. – Библиогр.: с. 42–43.
32)Шаркова, Т.С. Цитохимическая характеристика спорулирующей и вегетативной зон культуры Trichothecium roseum F r. [Текст] / Т.С. Шаркова // Микология и фитопатология. – 1971. – №6. – С. 490–493. – Библиогр.: с. 492.
33)Шевцова, В.М. Программы развития и возможный принцип их генетического контроля у микромицетов рода Verticillium [Текст] / В.М. Шевцова // Микология и фитопатология. – 2001. – №21. – С. 73–81. – Библиогр.: с. 76.
34)Ellis, M.B. Dematiaceous hyphomycetes. Commonwealth. Kew [Text] / M.B. Ellis. – New York: Academic Press, 1971. – 608 p.; 25 cm. – Bib.: p. 246. – 3000 copy.
35)Lodder, J. The Yeasts, a taxonomical study. 2 ed. North – Holland [Text] / J. Lodder. – Amserdam, London: Publishing Corp, 1970. – 1385 p.; 21 cm. – Bib.: p. 642. – 2500 copy.
36)Barnett, J.A. A quide for identyifying and classifying yeasts [Text] / J.A. Barnett, R.W. Payne, D. Yarrow. – Cambridge, England: University Press, 1979. – 1315 p.; 26 cm. – Bib.: p. 756. – 1500 copy.
37)Hopper, H. Involment of clay type and pH in the mechanisms of soil suppressiveness to Fusarium wilt of flax [Text] / H. Hopper, C. Steinberg, C. Alabouvette // Soil Boil. Biochem. – 1995. – Vol. 27. – №7. – P. 955–967. – Bib.: p. 961.
38)Margollin, A.S. The effects of various carbohydrates upon the growth of some fungi, thesis [Text] / A.S. Margollin. – West Virginia University, 1942. – 327 p.; 25 cm. – Bib.: p. 234. – 5000 copy.
39)Moore, D. Metabolism and biochemistry of hyphal systems [Text] / D. Moore // Fungal morphogenesis. – 2001. – №4. – P. 26–134. – Bib.: p. 36.
40)Parton, W.J. Chemical aktivites of fungi [Text] / W.J. Parton, J.B. Stewart, C.V. Cole // Biogeochemistry. – 1988. – №5. – P. 109 – 131. – Bib.: p. 115.
41)Watanabe, T. Pictorial atlas of soil and seed fungi. Morphologies of cultured fungi end key to species [Text] / T. Watanabe. – Florida, 2000. – 411 p.
Похожие работы
... , который включает в себя не только поддержание определенных условий в помещении музея, микробиологический мониторинг, а также обработку экспонатов специальными средствами, предотвращающими развитие плесневых грибов. Плесневые грибы уличных памятников в основном представлены такими родами как, Aspergillus niger, Trichoderma и Aspergillus flavus. Чаще данные рода встречаются в почве и воздухе, ...
0 комментариев