Навигация
Самосборка микротрубочек и ее регуляция
4.1.2 Самосборка микротрубочек и ее регуляция
В любой живой клетке происходит агрегация тубулина с образованием микротрубочек и распад этих структур. Вопрос о том, как регулируются процессы сборки и деструкции микротрубочек имеет первостепенное значение для понимания многих проявлений жизнедеятельности клетки.
Изучение in vitro полимеризации тубулина, выделенного из нервных клеток, оказалось ценным источником информации для понимания механизма сборки микротрубочек in vivo и путей управления этим процессом. Если нейротубулин находится в растворе в виде димеров в присутствии связанных с ним белков, то в определенных условиях легко идет процесс самосборки. Полимеризация происходит в условиях умеренной ионной силы, при слабо кислом рН (около 6,6—0,7), в присутствии нуклеотидов (GTP) и ионов, магния. Направление реакции зависит также, от температуры: in vitro при физиологических температурах идет полимеризация тубулина с образованием микротрубочек, а снижение температуры до 0°С вызывает их быструю деполимеризацию (рис. 8).
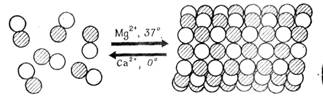
Рисунок 8. «Реакция полимеризации димеров тубулина с образованием микротрубочек. Указано влияние двухвалентных ионов и температуры».
4.2 Микрофиламенты
Микрофиламенты эукариотических клеток представляют собой длинные нитевидные структуры толщиной 5-7 нм, находящиеся в цитоплазме. Они состоят главным образом из актина (хотя можно обнаружить и другие белки), в связи, с чем их часто называют актиновыми филаментами (или нитями). Они иногда образуют группы или пучки, а в некоторых высоко специализированных клетках, например в мышечных волокнах, упорядоченные и стабильные структуры. Чаще, однако из микрофиламентов формируются нестабильные пучки или тонкие сетчатые структуры, их форма и локализация в клетке изменяются в зависимости от фазы жизненного цикла клетки, ее движения и т. п. Это означает, что, подобно цитоплазматическим микротрубочкам, микрофиламенты немышечных клеток представляют собой изменяемые структуры, способные к самосборке или деполимеризации на составляющие их молекулы в зависимости от нужд клетки.
Морфологию микрофиламентов и их поведение в процессе клеточного движения и цикла развития клетки много изучали на культуре животных клеток с помощью флуоресцирующих антител против актина, а также против других белков (миозин, тропомиозин и а-актинин), которые часто обнаруживаются в микрофиламентах. Когда клетки находятся в состоянии покоя и прикреплены к стенкам сосуда, в котором живут, в них можно наблюдать длинные пучки микрофиламентов, тянущиеся сквозь всю клетку, по-видимому, непосредственно под клеточной мембраной. В «возбужденные» выступы клетки с нестабильными, как бы волнующимися краями они обычно не заходят. Пучки микрофиламентов называются стрессовыми, типичны для нормальных клеток и отсутствуют в клетках, трансформированных онкогенными вирусами. Когда клетки движутся, в дополнение к стрессовым волокнам появляются топкие пучки актиновых нитей, рассеянные в цитоплазме; они особенно заметны в направленных вперед выступах клеток.
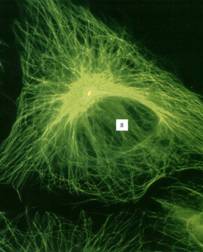
Рисунок 9. «Сеть микротрубочек, окрашенная мечеными антителами к тубулину в клетке культуры ткани в Gj-периоде». В клеточном центре желтым окрашена центриоль, связанная с антителами к γ-тубулину, Я – ядро.
4.2.1 Свойства актинов немышечных клеток
Актин широко распространен во всех эукариотических клетках. Его можно обнаружить как в растворимой мономерной форме, так и в полимерной — в виде филаментов. В некоторых активно передвигающихся клетках (амебы, макрофаги, тромбоциты) актин преобладает среди белков клеточного экстракта: его содержание может достигать 20—30% от общего белка, В менее подвижных клетках содержание актина заметно меньше—1—2% от общего белка. Однако если вспомнить, что в эукариотической клетке одновременно присутствуют многие, тысячи различных белков, то такое небольшое количество весьма существенно.
Благодаря относительно высокому его содержанию актин удается выделить из клеточных систем. Более акриламидном геле в присутствии додецилсульфата натрия. Выявились три основных полипептида, один из которых соответствует актину. Два других белка (мол. массы 230 000 и 250000), по-видимому, ответственны за I поддержание актина в неполимеризованном состоянии. Обработка протеолитическим ферментом (трипсином) позволяет отделить мономерный актин от высокомолекулярных белков. Акросомальную реакцию у сперматозоидов Thyone можно вызвать различными актива- I торами; повышение, внутреннего рН освобождает актин от связанных с ним белков, делая тем самым возможной полимеризацию. Процесс полимеризации инициирует 1 специфическая структура, которую можно увидеть на дне акросомальной чаши и которая называется актомером. Она представляет собой пучок из примерно 25 коротких микрофиламентов, заключенный в плотное аморфное вещество. В момент активации актомер начинает действовать как ядро полимеризации, из которого вырастают микрофиламенты.
Па основании этих и других данных высказано предположение, что полимеризацией и ростом микрофиламентов управляют какие-то организующие центры, подобно тому, как центр, управляющий жгутиковым синтезом, регулирует сборку микротрубочек.
Специфические точки роста актиновых филаментов обнаружены в семенных клетках Mitylus и Limulus, a также при формировании кишечных ворсинок; вполне возможно, что они есть и во многих других объектах. Действительно, в немышечных клетках часто видно, что микрофиламенты прикреплены к определенным точкам клеточной мембраны, однако пока неясно, управляют ли эти точки сборкой микрофиламентов или же прикрепление к ним происходит уже после.
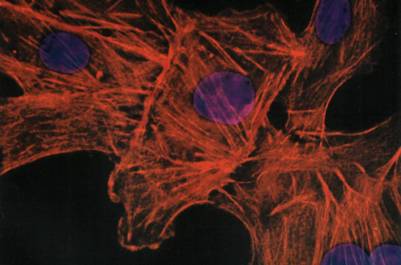
Рисунок 10. «Пучки актиновых микрофиламентов в клетках культуры ткани, окрашенных флуоресцирующими антителами Ядра – фиолетовые».
Похожие работы
... подавления активности ферментов служит одним из способов расшифровки механизма их действия. Подходом к решению последней задачи является изучение специфичности действия ферментов. В свою очередь, это требует корректного измерения кинетических параметров в присутствии изучаемого аналога субстрата. Рассмотрим способы определения характера взаимоотношений субстратов, их аналогов и ингибиторов ...
... Escherichia coti около 1 мкм за 25 с. Кроме того, способ сегрегации может определяться скоростью роста микроорганизма: у медленно растущих клеток Escherichia coii он близок к биполярному, а у быстро растущих становится днсперсивным. Построение клеточной перегородки В изучении механизмов регуляции данного этапа клеточного цикла важную роль сыграли специфические мутанты, особенно мутанты ...
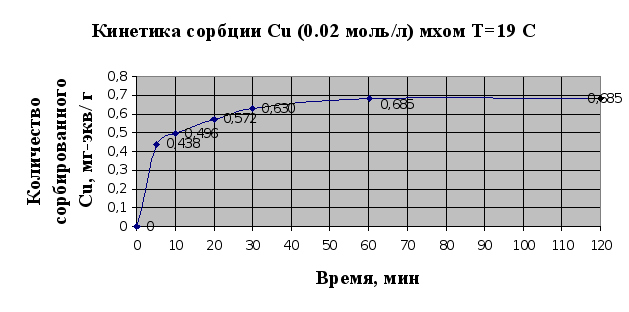
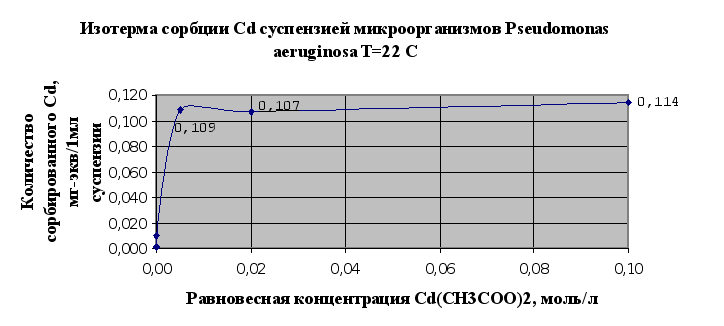
... Листов Пров. 1 2 Консульт. БГТУ 7140607 2004 Н. контр. Утв. Целью данной дипломной работы является изучение сорбционных свойств мха по отношению к микроорганизмам и тяжелым металлам, а также изучение сорбционной способности системы «мох-микроорганизмы» и выявление доли участия каждого компонента этой ...
... переломов ослабленных костей / Тр. конгресса Человек и его здоровье. СПб, 1999 - с. 55. 44. Воложин А.И., Курдюмов С.Г., Орловский В.П., Баринов С.М. и др. Создание нового поколения биосовместимых материалов на основе фосфатов кальция для широкого применения в медицинской практике // Технологии живых систем. 2004. Т.1, №.1. С. 41-56. 45. Безруков В.М., Григорян А.С. Гидроксилапатит как ...
0 комментариев