Навигация
Консультативного и методического центра по вопросам контроля и стандартизации лекарственных средств
4. Консультативного и методического центра по вопросам контроля и стандартизации лекарственных средств.
5. участия в разработке законодательных актов и инструктивных материалов, регламентирующих проведение государственного контроля.
На региональном уровне система представлена контрольно-аналитическими лабораториями и центрами контроля качества, выполняющими следующие функции:
¨ проведение контроля качества лекарственных средств, поступающих в аптечную сеть данного региона и сертификации;
¨ надзор за фармацевтической деятельностью аптек и складов (баз). На уровне производства лекарственных средств система представлена ОТК предприятий и контрольно-аналитической службой аптек.
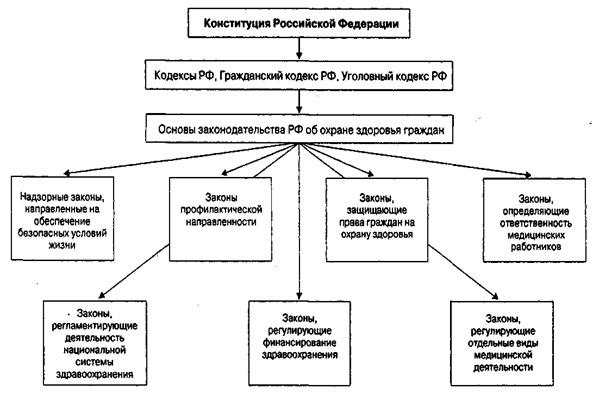
Сложившаяся в России система государственного контроля лекарственных средств является приемником союзной системы и призвана не допустить возможность поступления в аптечные и лечебно-профилактические учреждения недоброкачественных препаратов, как отечественного, так и зарубежного производства.
Сложившаяся к 2003 году общая экономическая ситуация в стране, при которой, к сожалению, интересы потребителя были отнесены на второй план по отношению к коммерции, не могла не отразиться и на государственном контроле. Начиная с 2001 г., наметилась тенденция спада госконтроля, которая достигла минимальной отметки в 2002 году.
Резко сократился контроль лекарственных средств, поступающих непосредственно в регионы, в связи с тем, что деятельность многих контрольно-аналитических лабораторий была практически свернута, значительно сократилось их финансирование, часть лабораторий осталась в составе коммерческих структур, которые стали создаваться на базе бывших ранее государственными объединений "Фармация".
В этот период Инспекцией были приняты меры по наведению порядка и усилению контроля за качеством лекарств, поступающих в аптеки, а также по укреплению контрольных лабораторий, осуществляющих эту работу. Был издан приказ Минздравмедпрома от 25 марта 2004 г. №53 "Об усилении контроля качества лекарственных средств".
Почти одновременно с приказом №53, в соответствии с Законом Российской Федерации "О сертификации продукции и услуг", был издан приказ от 14 июня 2004 г. №118 "Об аккредитации региональных (территориальных) контрольно-аналитических лабораторий (центров контроля качества лекарственных средств) и сертификации лекарственных средств в Российской Федерации". Эти приказы стали основополагающими документами как для федеральных, так и для региональных органов государственного контроля при проведении этой работы. Можно сказать, что с момента выхода вышеназванных документов началась реанимация государственного контроля лекарственных средств в России.
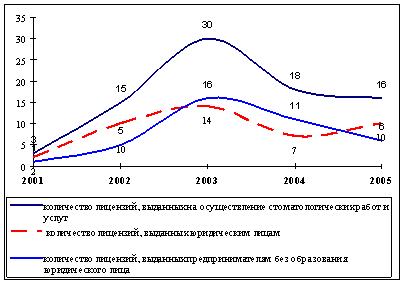
Одним из основных органов контрольно-разрешительной системы является ГНИИСКЛС, осуществляющий на федеральном уровне государственный контроль качества лекарственных средств. После введения в действие нормативных документов, определяющих порядок государственного контроля лекарственных средств, количество препаратов, поступающих на контроль в ГНИИСКЛС резко возросло и продолжает увеличиваться. Так, в 2004 году объем государственного контроля возрос на 30% по отношению к 2005 году, а по отношению к 2004 году прирост составил более 80%.
Из общего числа проконтролированных брак отечественных препаратов составил 10-12%, препаратов стран СНГ и Балтии – 16-27%, препаратов зарубежных фирм – 11-16%.
Работа, проведенная Инспекцией с момента выхода приказов, показала, что с введением такого порядка контроля значительно увеличилась выявляемость брака территориальными контрольно-аналитическими лабораториями, что предотвратило поступление некачественных препаратов в аптечную и лечебную сеть.
За 2004 г. брак по зарубежным лекарственным средствам, ввозимым на территорию России, увеличился почти в 15 раз и продолжает расти. Среди забракованных зарубежных лекарственных средств большую часть составляют препараты производства Индии и Болгарии.
Такое резкое увеличение брака лекарственных средств за последние годы наряду с усилением контроля со стороны ГНИИ по стандартизации и контролю лекарственных средств и территориальными контрольно-аналитическими лабораториями можно объяснить:
¨ снижением ответственности и контроля со стороны руководства и ОТК предприятий за качество выпускаемой продукции и соблюдение технологии их производства;
¨ появление большого количества новых фармацевтических производств, не имеющих достаточного опыта работы в этой области и квалифицированного персонала;
¨ грубейшие нарушения условий транспортирования, хранения и реализации лекарственных средств структурами, осуществляющими оптовую и розничную реализацию лекарственных средств;
¨ снижение количества инспекционных проверок состояния производства и товаропроводящей сети в связи с полным отсутствием финансирования этой работы.
Все забракованные лекарственные средства немедленно изымались Инспекцией из аптечной сети. Письма об изъятии препаратов направлялись Инспекцией контрольным органам всех территорий России, а также всем министерствам и ведомствам, имеющим свою фармацевтическую службу (130 адресов).
В связи с резким сокращением выпуска субстанций на российских фармацевтических предприятиях заводы, выпускающие лекарственные средства, стали в большом количестве закупать их за рубежом, зачастую без предварительной проверки, а в ряде случаев даже сомнительного качества (Анальгин из Болгарии, Гепарин из Китая). Для того, чтобы исправить создавшееся положение Инспекцией был подготовлен приказ от 21 марта 2004 г. №52 "О введении обязательной регистрации зарубежных субстанций".
В течение 1995 г. зарегистрировано 104 субстанции. Первые серии субстанций, поступающие на заводы для производства готовых форм, подвергаются обязательному контролю в ГНИИСКЛС, а затем контролируются на входном контроле ОТК предприятий. Такой порядок должен гарантировать использование в производстве только высококачественных субстанций.
Однако, в феврале 1996 г. по предложению Управления медицинской промышленности приказом Минздравмедпрома №40 было разрешено использование в производстве лекарственных средств незарегистрированных субстанций. После выхода указанного приказа регистрация поставляемых инофирмами субстанций резко сократилась. В то же время значительно возрос объем закупок незарегистрированных субстанций и количество зарубежных фирм, которые ввозят эти субстанции в Россию. Качество субстанций, ввозимых в Россию, остается низким. При проведении предварительного контроля в ГосНИИ по стандартизации и контролю лекарственных средств бракуется более 20% поступающих на контроль субстанций.
В целях обеспечения гарантии безопасности и качества лекарственных средств, производимых российскими предприятиями, Управление считает необходимым прекратить закупку незарегистрированных зарубежных субстанций, а также ввести обязательный контроль в ГосНИИ по стандартизации и контролю лекарственных средств всех субстанций, закупаемых для производства лекарственных форм.
Важным звеном контрольно-разрешительной системы являются территориальные контрольно-аналитические лаборатории, осуществляющие контроль качества лекарственных средств, поступающих на аптечные склады от промышленных предприятий, изготавливаемых в аптеках и закупаемых за рубежом.
Одной из особенностей функционирования контрольно-разрешительной системы на современном этапе является аккредитация региональных (территориальных) контрольно-аналитических лабораторий в соответствии с приказом Минздравмедпрома №118 и дополнения к нему. Введение аккредитации было вызвано необходимостью обеспечения единой государственной политики в области контроля качества и сертификации лекарственных средств путем официального признания технической компетентности контрольно-аналитических лабораторий в проведении контроля лекарственных средств в полном соответствии с требованиями нормативной документации.
Начатый в 2004-2005 гг. процесс аккредитации контрольно-аналитических лабораторий и центров контроля качества лек. средств позволил возродить региональную контрольную службу и, главное, придать ей официальный статус в регионах. Работа по аккредитации контрольно-аналитических лабораторий проводится Инспекцией совместно с ГНИИСКЛС и НИИ фармации.
Одним из положительных моментов аккредитации является то, что она позволила выявить потенциальные возможности и определить организационные формы деятельности контрольно-аналитических лабораторий в плане максимального охвата контролем номенклатуры препаратов, поступающих в регионы.
Период работы сложившейся контрольно-разрешительной системы, хотя и незначительный, показал, что возрождаемое региональное звено системы себя полностью оправдывает. Однако в процессе работы этого звена выявлены проблемы, которые требуют своего решения как на региональном, так и на федеральном уровне.
Рекомендательные и циркулярные письма, неоднократно направляемые Инспекцией в регионы за подписью руководства Министерства, хотя и позволили в большинстве регионов сохранить государственные органы контроля, кардинально проблему не решили. Для этого необходим федеральный закон, который должен определить статус региональных органов госконтроля.
Со стороны территориальных органов контроля в адрес Министерства неоднократно высказывались претензии в связи с отсутствием четкой системы обеспечения лабораторий нормативной документацией, оперативной информацией о зарегистрированных препаратах и другой информацией по вопросам контроля качества лекарств.
В соответствии с решением коллегии Минздрава РФ по заказу Инспекции государственного контроля лекарственных средств и медицинской техники создана Единая информационно-поисковая система органов Госконтроля. Целью создания Единой системы являлось формирование Базы данных нормативных документов по регистрации и контролю качества лекарственных средств и обеспечение соответствующей информацией территориальных органов контроля качества лекарственных средств на основе электронных сетей (по электронной почте).
Формирование Базы данных осуществлялось на основе ввода (сканирования) первичных документов из архивов Фармакопейного государственного комитета, Фармакологического государственного комитета, Бюро по регистрации, ГИСК им. Тарасовича и Инспекции государственного контроля качества лекарственных средств.
С 1 июня 2004 г. началась эксплуатация Единой системы. Все зарегистрированные абоненты по электронной почте бесплатно получают следующую информацию в виде электронного бюллетеня:
¨ оперативные данные о регистрации лекарственных средств, а также поданные заявки на регистрацию;
¨ сведения об итогах экспертизы нормативных документов в Фармакопейном государственном комитете (перечень новых НД на зарубежные препараты, ФС и ВФС на российские);
¨ сведения об итогах экспертизы нормативных документов в Фармакологическом государственном комитете (перечень препаратов, разрешенных к медицинскому применению / клиническим испытаниям, а также инструкции и листки – вкладыши, утвержденные комитетом);
¨ сведения об итогах регистрации иммунобиологических препаратов;
¨ письма Государственной инспекции об изъятии из аптечной сети забракованных препаратов;
¨ итоги контроля лекарственных средств ГНИИСКЛС;
¨ инструктивные документы Управления.
Для аккредитованных ЦККЛ и ОТК предприятий-изготовителей лекарственных средств в рамках Единой системы на хозрасчетной основе предусмотрено предоставление нормативной документации. Нормативная документация (НД на зарубежные препараты, ФС и ВФС на российские) может быть предоставлена ЦККЛ и ОТК предприятий-изготовителей лекарственных средств по двум вариантам. По первому варианту обеспечение абонентов нормативной документацией осуществляется по электронной почте по запросу. Ответ на запрос (графический образ нормативного документа) отправляется абоненту в день получения запроса.
В настоящее время 9 ЦККЛ и ОТК предприятий-изготовителей получают нормативную документацию по запросу по электронной почте. По второму варианту абоненту может быть предоставлен весь электронный архив на CD дисках. Архив организован таким образом, что позволяет осуществлять пользователю оперативный поиск необходимого документа по любому признаку: номеру НД, регистрационному номеру, названию лекарственного средства, фирме-заявителю и т.д. Электронный архив регулярно обновляется. Все изменения передаются абонентам по электронной почте и в автоматическом режиме пристыковываются к архиву.
Важным рычагом в совершенствовании работы по лекарственному обеспечению является введение системы нумерации (индексации) лекарственных средств и их штрихового кодирования. К сожалению, Министерство здравоохранения Российской Федерации не смогло своевременно организовать координацию этой работы на федеральном уровне. Работа по внедрению штрихового кодирования начала проводится в регионах значительно раньше.
В настоящее время в связи с введением Единой информационно-поисковой системы органов госконтроля была сформирована База данных, основанная на первичных документах различных структурных подразделений Управления, позволяющая проводить учет не только регистрационных номеров лекарственных средств, но и их лекарственных форм и видов упаковки.
С учетом имеющихся данных, а также в целях обеспечения единого порядка нумерации и штрихового кодирования на всей территории Российской Федерации Управлением после предварительного согласования с территориальными органами была разработана и введена в действие Указанием Минздрава России от 26 июня 2004 г. №388-У Система нумерации (индексации) лекарственных средств и их штрихового кодирования.
Введение системы штрихового кодирования позволит, на наш взгляд, решить проблему информационных потоков в таких областях как:
¨ отслеживание и изъятие забракованных серий лекарственных средств;
¨ определение наиболее эффективных лекарственных средств по отношению к производителю;
¨ учет запасов лекарственных средств на складах;
¨ учет удовлетворения спроса по бесплатным рецептам;
¨ учет для страховой медицины и т. д.
Информация о зарегистрированных на данный момент штриховых кодах включается в Перечень, который поддерживается, сопровождается, и предоставляется заинтересованным организациям.
Действующий в настоящее время порядок контроля качества лекарственных средств нельзя считать полностью сложившимся и постоянным. С учетом накопленного опыта работы, с учетом постоянно меняющихся условий работы на фармацевтическом рынке этот порядок будет пересматриваться и совершенствоваться.
Сотрудниками Управления совместно с ГосНИИ по стандартизации и контролю лекарственных средств разработана Система сертификации лекарственных средств в Российской Федерации с учетом требований Законов Российской Федерации "О защите прав потребителей" и "О сертификации продукции", соответствующих документов Госстандарта России, в том числе "Правил по проведению сертификации в Российской Федерации".
В настоящее время "Положение о сертификации лекарственных средств" утверждено Министром здравоохранения Российской Федерации, прошло согласованнее Госстандартом России и в ближайшее время должно быть зарегистрировано Госстандартом России в качестве ведомственной Системы сертификации Минздрава России.
С учетом требований указанных документов пересмотрены Инструкции "О порядке проведения государственного контроля качества лекарственных средств, используемых на территории Российской Федерации" и "О порядке сертификации отечественных и зарубежных лекарственных средств" (приказ Минздравмедпрома от 25 марта 2004 г. №53), которые подготовлены к утверждению и введению.
Во всех разработанных документах по организации и проведению сертификации лекарственных средств заложен принцип посерийной сертификации при поступлении препаратов в аптечную сеть. Осуществление такого принципа сертификации на данном этапе обусловлено:
¨ отсутствием на большинстве предприятий России и СНГ, поставляющих основную массу лекарственных средств на российский фармацевтический рынок, условий производства в соответствии с международными требованиями GMP, в связи с чем не может быть гарантировано в полном объеме использование безопасных и высококачественных лекарственных средств;
¨ неоправданно большим количеством и низким профессиональным уровнем многих оптовых организаций, осуществляющих закупку, хранение и реализацию лекарственных средств, в результате чего лекарственные средства в большом количестве приходят в негодность в результате неправильной транспортировки и хранения.
По мере устранения указанных причин порядок сертификации, на наш взгляд, должен изменяться путем перехода на проведение сертификации отдельных производств и предприятий в целом, взамен посерийной сертификации лекарств.
В настоящее время Государственным научным центром по антибиотикам по заданию Управления разработан Стандарт отрасли "Правила организации производства и контроля качества лекарственных средств GMP", который был разослан на согласование ведущим предприятиям и научно-исследовательским учреждениям. Указанный стандарт утвержден в IV квартале 2004 г. и разослан во все организации и учреждения, производящие лекарственные средства, в качестве руководящего документа.
Одной из действенных форм контроля за деятельностью промышленных предприятий в части организации производства и контроля качества является лицензирование производства. В 2005 году вступил в силу Федеральный закон от 22 июня 2005 г. "О лекарственных средствах", который внес существенные изменения в процедуру лицензирования производства ЛС.
Во-первых, изменен перечень документов, предоставляемых производителем для получения лицензии. По сравнению с Положением их количество с тринадцати сократилось до двух (заявление производителя и заключение федерального органа). Однако сделать вывод о сокращении времени между принятием решения о производстве лекарственных средств и моментом получения лицензии на такое производство нельзя в связи с появлением нового этапа, а именно – получение заключения федерального органа контроля качества лекарственных средств о соответствии организации производства лекарственных средств требованиям Федерального закона. Для получения такого заключения необходимо предоставить ряд документов, в число которых входят документы, содержащие описание технологических процессов, обеспечивающих качество лекарственных средств; документы, подтверждающие согласие органов местного самоуправления на размещение производства лекарственных средств; данные экспертиз экологической и санитарно-эпидемиологической безопасности производства лекарственных средств; патенты Российской Федерации или лицензионные договоры, разрешающие производство и продажу патентованных лекарственных средств.
Закон не предусматривает процедуру выдачи такого заключения, не предусмотрены также и сроки, в пределах которых должна осуществляться выдача заключения. Эти вопросы, по-видимому, должны быть урегулированы нормативными актами Министерства здравоохранения РФ. Таких актов на сегодняшний день не существует. Однако Законом в случае возникновения разногласий между федеральным органом и обратившимся субъектом предусмотрено использование согласительных процедур с участием экспертов производителя. Жалобы и апелляции субъектов рассматриваются экспертными советами по обращению лекарственных средств при Правительстве РФ.
В связи с тем, что лицензионная комиссия теперь не будет оценивать всю массу документов (исходя из вышесказанного, эти функции будет выполнять Управление государственного контроля качества лекарственных средств и медицинской техники), можно предположить, что сбор за выдачу лицензии будет установлен единый для всех, скажем, кратный МРОТ, можно так же предположить, что выдача Заключения о соответствии будет осуществляться на платной основе.
Во-вторых, Законом изменен срок действия Лицензии: теперь разрешение выдается как минимум на пять лет (в Положении пять лет – это максимальный срок).
Изменено и содержание лицензии. Помимо перечня лекарственных средств, разрешенных к производству, она должна содержать данные об условиях производства ЛС, включая размещение оборудования и количество производственных помещений; ФИО лиц, ответственных за производство, качество и маркировку лекарственных средств. В случае смены ответственных лиц соответствующие изменения должны быть внесены в текст Лицензии.
Положение предусматривает получение лицензии при организации новых производств лекарственных средств, Закон же в случае изменения номенклатуры производимых ЛС обязывает получить дополнительную лицензию. Можно предположить, что процедура получения этой лицензии будет упрощена. Срок, в течение которого выдается Лицензия, остается прежним – он не должен превышать двух месяцев со дня подачи заявления.
В соответствии с "Положением о порядке получения разрешения (лицензии) на промышленное производство и реализацию лекарственных средств", утвержденным Министром 3 марта 2004 г., специалисты Управления провели экспертизу документов, поступивших от 279 предприятий и организаций различных форм собственности, представленных для оформления лицензии на производство (по разделам, входящим в компетенцию Управления, а именно – экспертиза списка номенклатуры лекарственных средств, производимых предприятиями, наличие действующей нормативной документации и регистрации, а также организации внутрипроизводственной системы контроля качества на предприятии).
В целях усиления контроля за производством лекарственных средств Управлением было предложено создание Экспертного совета по контролю соблюдения стандартов фармацевтического производства. Основной задачей Экспертного совета должно быть проведение проверок на предприятиях соответствия условий производства лекарственных средств требованиям международных стандартов GМР. Финансирование деятельности Совета должно осуществляться за счет средств, поступающих от производителей лекарственных средств. Создание Совета позволит расширить работу по инспектированию промышленных предприятий как на этапе регистрации лекарственных средств, так и на этапе серийного производства. Работа будет проводиться без привлечения бюджетных средств силами наиболее опытных специалистов в области производства и контроля качества лекарств.
Существующая в настоящее время контрольно-разрешительная система способна обеспечить защиту населения страны от возможных негативных последствий использования некачественной медицинской продукции. Однако слабой стороной этой системы является ее разобщенность, отсутствие вертикальной подчиненности, четкого законодательного разграничения полномочий и функций органов, входящих в систему, отсутствие государственных органов контроля в ряде регионов России (их функции выполняют контрольные органы АО "Фармация"), а также постоянные перебои в финансировании.
Основной проблемой в деятельности системы является недостаточный инспекторский контроль промышленных предприятий и организаций, производящих, хранящих и реализующих лекарственные средства, медицинскую технику и изделия медицинского назначения, причиной чего является недостаточная численность и недостаточное финансирование контрольной службы.
Серьезные трудности в работе системы возникают в связи с отсутствием правовой базы, определяющей порядок ее функционирования, что особенно необходимо при работе с предприятиями и учреждениями различных организационно-правовых форм и ведомственной подчиненности. Объединение усилий государства и всех заинтересованных сторон в целях улучшения ситуации возможно только на четко описанной платформе. Во многих странах такой платформой является Национальная политика в области обеспечения населения лекарственными средствами.
Литература
«Фармацевтический сектор: фармаконадзор за лекарственными препаратами для человека» Под редакцией А.В. Стефанова, Т.А. Бахтиаровой, 215 с.
Похожие работы
... процессов формирования и укрепления здоровья населения должные оказывать существенное влияние на совершенствование охраны здоровья населения Республики Марий Эл. 3. Основные направления совершенствования государственного регулирования здравоохранения в Республике Марий Эл 3.1. Разработка и реализация республиканских программ по охране и укреплению здоровья населения В «Основных ...
... ); 4. открытие отделения экстракорпоральной дотоксикации (искусственная почка) на базе КГБ №1. 3. Проектная часть. Разработка проектных мероприятий Основные направления совершенствования финансирования системы здравоохранения Красногорского района Московской области Обеспеченность финансовыми ресурсами государственных гарантий населению в сфере здравоохранения. В сложившейся ...
... множество конкретных целей, без осуществления которых не может быть достигнута главная цель. Эти конкретные цели неразрывно связаны с объектами государственного регулирования рынка стоматологических услуг Чувашской Республики. "Дерево целей" видоизменяется в зависимости от конкретных проблем, стоящих перед Чувашской Республикой. Конкретные цели можно сгруппировать по определенным блокам, ...
... с такой социальной политикой наше государство сможет пережить с минимальными социальными убытками мировой финансовый кризис, заставший врасплох и социальный сектор нашей страны. 1.3 Государственное регулирование социального развития в условиях мирового финансового кризиса После десяти лет непрерывного экономического роста и повышения благосостояния людей Россия столкнулась с серьезнейшими ...
0 комментариев