Навигация
Методические рекомендации к определению и выведению гемограммы у животных
Министерство сельского хозяйства Российской Федерации
Ульяновская государственная сельскохозяйственная академия
Кафедра физиологии сельскохозяйственных животных и зоологии
Методические рекомендации к определению и выведению гемограммы у животных
Ульяновск, 2005 г.
УДК
Н.А.Любин, Л.Б.Конова.
Методические рекомендации к определению и выведению гемограммы у сельскохозяйственных и лабораторных животных при патологиях.
Для студентов и аспирантов факультетов ветеринарной медицины и технологического. Ульяновск, ГСХА, 2005, с.
При подготовке настоящих рекомендаций был использован опыт работы…
РЕЦЕНЗЕНТ: В.А.Ермолаев, доктор ветеринарных наук, профессор
Рекомендовано к изданию
методической комиссией
факультета ветеринарной медицины
Протокол № от 2005 г.
Ульяновская государственная сельскохозяйственная академия, 2005 г
МЕТОДИКА ПРИГОТОВЛЕНИЯ МАЗКОВ КРОВИ ДЛЯ ИССЛЕДОВАНИЯ
А. ВЗЯТИЕ КРОВИ И ПОЛУЧЕНИЕ МАЗКА
Циркулирующая в сосудистой системе кровь представляет более или менее равномерную взвесь в плазме форменных элементов: эритроцитов, лейкоцитов и кровяных пластинок (у птиц, рептилий и амфибий — тромбоцитов). Абсолютное количество и соотношение отдельных групп клеток в крови различных видов животных неодинаковы. Наибольшие колебания дают эритроциты: от 3,5 млн. в 1 мм 3 крови кур до 14,4 млн. в том же объёме крови коз. Несколько меньше видовые колебания количества белых кровяных телец: в 1 мм 3 крови млекопитающих содержится от 5 до 15 тыс. лейкоцитов. Количество лейкоцитов в крови птиц значительно выше: у кур, например оно, доходит до 35 тыс., а у гусей до 38 тыс. в 1 мм 3. Наконец, содержание кровяных пластинок в 1 мм3 крови колеблется от 200 до 400 тыс.
В крови, взятой из различных участков сосудистой системы, находится далеко не одина- ковое количество кровяных телец, особенно, и это наиболее важно, лейкоцитов. Значительно колеблется при этом и соотношение отдельных форм белой крови (табл.1,2).
Таблица1
Количество лейкоцитов в различных участках кровяного русла у кроликов
| Название органа или сосуда, ткани | % | Название органа или сосуда, ткани | % |
| Паренхима печени | 83,9 | Лёгкие . | 74,4 |
| Паренхима селезенки | 385, 3 | Vena. Pulmon. | 43,9 |
| Почки | 103,8 | Мышцы сердца | 61,7 |
| Надпочечники | 73,8 | Костный мозг | 128,29 |
| Vena mesent. | 89,0 | Vena. femoralis | 62,4 |
| Art. mesent. | 84,4 | Аrt . femoralis | 69,9 |
| Vena cava caud. | 4.9 | Vena. renalis | 60,5 |
Если принять среднее количество лейкоцитов в 1 мм3 крови из ушной вены за 100%, то в крови из сосудов других органов содержится:
Поэтому важно брать кровь для анализа всегда из одного и того же сосуда или группы сосудов. У всех сельскохозяйственных млекопитающих таким местом являются вены уха, у кур — гребень, у уток и гусей — мякоть ступни ноги.
Таблица 2 Состав белой крови свиней
| Кровь | Базофилы | Эозино-филы | Нейтрофилы | Лимфо-циты | Моноциты | ||
| Юные | Палочко ядерные. | Сегменто ядерные. | |||||
| Из вены уха | 0,5 | 2,5 | 1,0 | 5,5 | 31,5 | 55,5 | 3,5 |
| Из сердца | до 0,1 | 0,4 | 1,0 | 10,0 | 62,0 | 24,5 | 4,0 |
Количество лейкоцитов зависит и от физиологического состояния животного.
У многих сельскохозяйственных и лабораторных животных заметно выражены пищеварительный лейкоцитоз (особенно у собаки), менее у лошади, и колебания количества лейкоцитов и (особенно) эритроцитов при мышечной работе. При некоторых патологических состояниях имеет место ретенция белых кровяных телец в сосудах печени и надпочечника. Лейкоцитоз наблюдается также во второй половине беременности.
Место взятия крови тщательно выстригается и если нужно, промывается водой с мылом, затем спиртом (или спиртом с эфиром). Рекомендуется тщательно растирать место взятия крови ваткой со спиртом и эфиром, что вызывает местную гиперемию и вместе с тем помогает избежать случайных колебаний лейкоцитарной формулы, связанных с некоторым застоем крови в мелких венах уха. Особенно следует иметь в виду возможное избирательное скопление в них эозинофилов.
Хорошие мазки крови можно получить только на очень чистых, обезжиренных предметных стёклах, тщательно промытых сначала горячей водой с мылом, а затем, после высушивания, — спиртом с эфиром. Промывание в спирте с эфиром особенно важно для полного обезжиривания стёкол. Если используются уже бывшие в употреблении стёкла, то их необходимо предварительно прокипятить в воде с содой.
Прокол тканей для получения крови лучше всего производить иглой Франка, но можно употреблять и обыкновенную иглу или специальное перо для уколов.
Первую выступившую на поверхность каплю крови быстро и тщательно стирают с места укола, а из второй и последующих приготовляют мазки.
Приготовление мазка крови. Чистое предметное стекло держат, как показано на рисунке 1, между большим и средним пальцами левой руки. В правой руке, теми же или большим и указательным пальцами держат чистое покровное или тонкое шлифованное предметное стекло. По крайней мере, одно ребро таких стёкол должно быть уже ширины того предметного стекла, на котором приготовляют мазок. Обычно это достигается подбором или обламыванием углов шлифованного стекла.
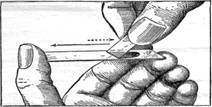
Рис. 1. Приготовление мазка крови.
Поверхностью предметного стекла, зажатого в левой руке, осторожно, но быстро касаются выступившей из прокола капли крови, стараясь сделать это ближе к среднему пальцу и, сейчас же, приведя стекло в горизонтальное положение, прикладывают к его поверхности узкое ребро того стекла, которое держат в правой руке. Приложенное ребро должно лежать перпендикулярно к длинным граням предметного отекла, а самое приложенное стекло нужно наклонить в сторону капли под углом в 40—50°. Держа это стекло, таким образом, осторожно двигают его в сторону капли до соприкосновения с нею. Как только капля, коснувшись подвижного стекла, разойдётся по линии соприкосновения стёкол, верхнее наклонное стекло быстрым, но ровным движением направляют обратно, в сторону большого пальца, сохраняя всё время прежний угол наклона в 40—50°. Полученный таким способом мазок высушивают на воздухе и на нём пишут иглой название или номер животного, его пол ((J или Q), и дату взятия крови.
Можно изготовлять мазки и на покровных стёклах. Для этого одним покровным стеклом берут очень маленькую каплю крови и прикладывают к нему другое покровное стекло так, чтобы углы одного стекла легли на середину рёбер другого. Как только капля крови разойдётся тончайшим слоем между обоими стёклами, последние параллельным
движением в противоположные стороны разводятся, и, таким образом, получаются два мазка.
В. ФИКСАЦИЯ МАЗКА
Чтобы закрепить все форменные элементы крови в препарате с максимально возможным сохранением их структуры и подготовить мазки к последующей окраске, существуют различные методы фиксации мазков. Наибольшее практическое значение имеют:
1. Фиксация абсолютным метиловым спиртом. Это лучший метод фиксации. Сухие мазки на 3 минуты погружаются в абсолютный метиловый спирт или на то же время спирт наливается на мазок, вполне покрывая препарат. Через 3 минуты мазки вынимают (или сливают с них спирт) и просушивают на воздухе.
2. Фиксация абсолютным этиловым спиртом, смешанным с равным количеством эфира. Фиксация длится 10—30 минут в обычных сосудах для гистологических растворов. Этот способ значительно хуже, так как даёт много артефактов.
В. ОКРАСКА МАЗКА. ОСНОВНОЙ МЕТОД ОКРАСКИ ПО РОМАНОВСКОМУ
Посредством окраски препарата наиболее отчетливо выявляется тончайшая структура, как ядра, так и цитоплазмы. Принцип современных методов окраски мазков крови открыт в 1891 г. Д. Л. Романовским и заключается в избирательном поглощении (химическом и коллоидальнохимическом) веществами клетки трёх красящих веществ — азура метиленовой синьки и эозина. Азур («красная из метиленовой синьки») имеет амфотерноосновную реакцию, метиленовая синька — щелочную, эозин — кислую.
Ядро клетки, богатое нуклеопротеидами и нуклеотидами, базофильно, т. е. окрашивается основными красками с избирательным поглощением а з у р а.
Цитоплазма молодых клеток, относительно богатая нуклеиновыми кислотами (нуклеотидами), также, хотя и в меньшей степени, базофильна. При этом избирательно поглощается преимущественно метиленовая синька. Цитоплазма же многих зрелых клеток крови (прежде всего нейтрофилов) ацидофильна (оксифильна).
Лимфоциты сохраняют базофилию цитоплазмы на всех стадиях развития, избирательно поглощая метиленовую синьку. Наличие базофилии молодой цитоплазмы, указывающее на относительное богатство её нуклеиновыми кислотами, связано с сохранением способности молодых клеток к интенсивному синтезу белков.
Лимфоциты сохраняют эту способность на весь онтогенез.
Базофилия гранул базофилов определяется наличием в них кислой слизи (мукоитиносерная кислота).
В лабораторной практике чаще всего пользуются следующими способами окраски по методу Романовского.
Окраска раствором Гимза
Краска Гимза, применяемая при окраске по методу Романовского, представляет собой комбинацию метилен-азура (азур II) и эозина (В, жёлтого). Она состоит из азура II*—3,0, эозина В —0,8, химически чистого глицерина 250,0 и метилового спирта 250,0.
Эта краска обычно отпускается готовой. Очень многое в успехе окрашивания определяет безупречное качество раствора краски, а последнее в высшей степени зависит от реакции воды.
Для приготовления рабочего раствора краски употребляется дважды дистиллированная вода. Обычно она имеет рН=5,4, т. е. слишком кисла, и даёт слабую, плохую окраску. Поэтому такую воду нужно подщелочить, прибавив к 2—3 л воды несколько капель 1-процентного раствора соды. Лучшим рН воды следует считать 6,8—6,9 (до 7,1). При более щелочной реакции воды мазки получаются более синими (даже эритроциты).
Практически пригодность воды к окраске определяют по растворению в ней гематоксилина. В 10 см3 дистиллированной воды (лучше всего в часовом стёклышке) кладут пинцетом несколько крупинок гематоксилина. Не ранее как через 1 минуту и не позже 5 минут вода должна окраситься в ясный слабофиолетовый цвет. Более раннее и интенсивное окрашивание указывает на сильно щелочную реакцию, более позднее — на кислую.
Если нет очень хорошего гематоксилина, то реакцию воды, подщелачиваемой раствором соды, можно определить, пользуясь в качестве индикатора нейтральной красной. В два химических стакана (или колбы Эрленмейера) наливают по 200 см3 дистиллированной воды и прибавляют 1 — 2 капли 1-процентного раствора нейтральной красной. При рН дистиллированной воды, равном 5,4—5,5, получается свекловично-красная (рубиновая) окраска. После этого в один из стаканов прибавляют по капле, тщательно размешивая, 1% раствор соды до появления слабого оранжевого оттенка (цвет лососины). Нельзя доводить воду до ясно оранжевого и, тем более, жёлтого цвета, так как в этом случае реакция будет сильно щелочной.
Более кропотливо пользоваться индикаторами Михаэлиса и менее точно — универсальным индикатором.
Лучше всего для получения нужной и стойкой реакции воды применять буферные растворы. Хорошими буферными растворами для этой цели будут фосфатные. Для них нужно иметь два исходных раствора:
1. Двуосновного фосфата натрия (Na2HP04. •2Н20)—17,814 г на 1 л (рН =8,302).
2. Одноосновного фосфата калия (КН2Р04) — 13,638 г на 1 л (рН =4,529).
Азур II — смесь в равных частях красок: азур I (диметилтиониохлорид) и метиленовой синьки. В постаревшем растворе исходной краски Гимза метиленовая синька часто плохо окрашивает цитоплазму лимфоцитов (нет чисто голубого цвета). Тогда необходимо добавить метиленовой синьки в исходный раствор краски.
Если к литру дистиллированной воды прибавить по 5 см3 того и другого раствора, то рН такой воды будет равен 6,813. Случайные колебания концентрации углекислоты в воздухе при таком способе не оказывают влияния на рН воды.
Перед окраской (ex tempore) к дистиллированной воде прибавляют исходный раствор краски Гимза из расчёта 1,0—1,5 капли краски на 1 см3 воды.
Рабочий раствор краски наливается пипеткой (осторожно!) на предметное стекло так, чтобы препарат (мазок крови) был полностью покрыт краской. Стёкла помещаются над широкой чашкой Петри на стеклянных палочках, соединённых резиновыми трубками попарно. Во избежание осадков, которые невозможно отмыть, можно стёкла укладывать мазками вниз, на стеклянные палочки, лежащие в чашке Петри, так, чтобы краска покрывала мазки полностью (способ академика Н. Д. Стражеско).
При первом способе на один мазок тратится 2,5— 3,0 см3 рабочего раствора краски.
Через 20—30 минут краску сливают, препараты промывают водопроводной чистой водой и высушивают на воздухе. Для окраски старой краской требуется меньше времени.
При окраске раствором Гимза хорошо дифференцируется структура ядра, несколько хуже — структура цитоплазмы, особенно нейтрофильная зернистость. Однако при очень умелом окрашивании и зернистость выявляется достаточно хорошо.
По этому методу плохо окрашиваются псевдоэозинофилы (палочкозернистые гранулоциты) крови сельскохозяйственных птиц.
Окрашенные краской Гимза ядра имеют красивый фиолетово-красный цвет (цвет вишни); нейтрофильная зернистость — розовато-фиолетовый; эозинофильная зернистость — розовый или красно-розовый; базофильная —цвета мальвы; азурофильная — красно-фиолетового цвета.
Цитоплазма лимфоцитов — голубая, моноцитов — от голубовато-серой до пепельно-серой.
Эритроциты — красновато-розового цвета, полихроматофилъные эритроциты — синеватые, базофильная пунктация эритроцитов — синяя.
Если нет хорошей готовой краски Гимза, то можно хорошо окрасить мазки по Н о х т у. Для окраски по Нохту приготовляется два раствора: 1) 1-промил-льный раствор азура II; 2) 1-промилльный раствор эозина. Перед приготовлением рабочего раствора краску нужно оттитровать. Для этого сначала берут на 3 см3 дистиллированной воды 4 капли раствора азура II и 3 капли раствора эозина (т. е. в отношении 4 : 3). Если окраска мазков неправильна, пробуют отношение 4 : 4, или 4 : 5, или 4 : 6, и т. д.
Достаточно интенсивное окрашивание получается, если на 1,5 см3 азура II берётся 1,0 см3 эозина и 6 см3 воды.
Модификация Паппенгейма (Май-Грюнвальд — Гимза)
При этом способе окраски предварительная фиксация мазка не нужна, так как первая краска — Май-Грюнвальд имеет растворителем метиловый спирт.
Метод окраски двухмоментный. Сперва мазок покрывают 2 см3 неразведённой краски
Май-Грюнвальд, представляющей собой раствор в метиловом спирте эозина и метиленовой синьки. Если нет готовой надёжной краски, то растворяют приготовленный фабричным способом сухой порошок Май-Грюнвальд: 1,0 г порошка на 100 см3 абсолютного метилового спирта и 50 см3 чистого глицерина. Хорошая краска получается и без глицерина.
Через 3 минуты к краске Май-Грюнвальд, находящейся на мазке, прибавляют 2 см3 дистиллированной воды и тщательно смешивают их продуванием или последовательным набиранием и выпусканием через тонко оттянутую пипетку. Когда, примерно через 1 минуту, мазок приобретает розовый оттенок, краску с препарата сливают и после этого, не высушивая, 10—12—15 минут красят мазок рабочим раствором краски Гимза, а затем промывают чистой водопроводной водой. Этот способ окраски удачно сочетает хорошее выявление зернистости клеток краской Май-Грюнвальд с чёткой окраской структуры ядра раствором Гимза.
Такая окраска особенно ценна для выявления псевдоэозинофилов (специальных гранулоцитов) куриной крови.
Результаты окраски: ядра красно-фиолетовые, цитоплазма лимфоцитов голубовато-синяя, азурофильная зернистость лимфоцитов пурпурно-красная, миелоидная азурофилия фиолетово-коричневая, так же как и центральная субстанция кровяных пластинок. Нейтрофильная зернистость коричневато-красная, до синевато-розовой; эозинофильная — от красно-оранжевой до кирпично-красного цвета; базофильная зернистость тёмного ультрамариново-фиолетового цвета (метахромазия); эритроциты медно-розовые; полихроматофильные эритроциты синеватые; базофильная пунктация эритроцитов (слабо выявляемая) синего цвета *.
В целом, мазки, окрашенные по этому способу, несколько богаче оттенками, чем при окраске раствором Гимза, но кажутся более тёмными, «мрачными».
Цветные таблицы картин крови выполнены с препаратов крови, окрашенных по Романовскому в модификации Паппенгейма, лучше всего диференцирующей структуру клеток.
Ускоренная окраска раствором Гимза (новая модификация)
Этот метод даёт хорошие результаты только в руках опытного исследователя. Преимущество — быстрота приготовления препарата, так как фиксация и окрашивание происходят одновременно.
Для работы необходимы капельницы ёмкостью в 30 см3, в которые наливается исходный раствор краски Гимза, разведённый пополам метиловым спиртом или чистейшим ацетоном. В хорошо закупоренной склянке этот раствор может сохраняться месяцами.
Окрашивание производится или в чашках со специальными перекладинками, или в обычных чашках Петри. На свежий мазок (не позднее 2-дневного!), высушенный на воздухе и не фиксированный, наливают из капельницы около 20 капель краски. Чтобы предохранить краску от испарения, чашка, в которой лежат препараты, закрывается стеклом.
Через 1/2 минуты — 1 минуту к краске на мазке приливают около 10 см3 подщелочённой дистиллированной воды (1—2 капли 1-процентного раствора щелочи на 50 см3 воды). Покачиванием чашечки хорошо перемешивают краску с подлитой водой. Через 10— 15 минут воду с краской сливают и мазок промывают водопроводной (недистиллированной!) водой.
В случае приготовления основного раствора с ацетоном особенно хорошо выявляется зернистость структура ядер кровяные пластинки.
• Описание цветов дано, с некоторыми небольшими изменением, по А. II. Крюкову.
Окраска крови и кровепаразитов по Г. Эпштейну
Фиксация метиловым спиртом
Готовят два раствора.
1-й: дистиллированной воды 100 см3; лимоннокислого лития — 1 г; толуидиновой голубой — 1г. После разведения профильтровать.
2-й: насыщенный водный раствор пикриновой кислоты.
Мазки красят 20—30 минут в первом растворе и, ополоснув в проточной воде, помещают на 1—2 секунды во второй раствор (пикриновой кислоты). Промывают (тщательно!) снова в водопроводной воде и после этого быстро обсушивают фильтровальной бумагой.
Окраска: эритроциты зелёные; ядра лейкоцитов фиолетово-синие; базофильная зернистость вишнёвая; эозинофильная зернистость изумрудно-зелёная; нейтрофильная зернистость серая; у кровепаразитов ядро красное, а цитоплазма синяя.
Окраска составом Лейшмана
На нефиксированный препарат налить 15—20 капель готового раствора краски Лейшмана (0,1 г порошка краски растворить в 10 см3 метилового спирта). Через 2,5—3 минуты прибавить 30 капель дестиллированной воды и красить ещё 5 минут. Промыть в течение 2—3 минут проточной водой и высушить на воздухе.
Специальные способы окраски и фиксации мазка
а) Получение и окраска толстой капли. На хорошо промытое (подщелочённой водой, затем спиртом с эфиром) предметное стекло наносят 2 крупные капли крови. Собственно, достаточно одной капли, но вторая служит «резервом» на случай неосторожного стирания одной капли, неудачи окраски и т. д. Каждая капля сейчас же, с помощью иглы, распределяется по стеклу ровным слоем — примерно в 1\4 - 1\2 мм толщины, чтобы получились пятна размером с десятикопеечную монету. Препараты тщательно высушиваются (в термостате при 37° или на солнце) в течение получаса.
После этого высохший препарат дважды окрашивают рабочим раствором Гимза (1 капля исходного спиртового раствора Гимза на 1 см3 дистиллированной воды).
Первое окрашивание длится около 3 минут после того, как в растворе краски появится красное облачко растворившегося гемоглобина. Затем один конец предметного стекла слегка приподнимают и старый раствор Гимза заменяют новым, приливая его очень осторожно с приподнятого конца препарата, в то время как прежний раствор краски с гемоглобином стекает с другого конца. Когда таким образом вся старая краска сменена новой, предметное стекло снова устанавливают горизонтально и продолжают докрашивание ещё 25 минут.
Значение метода состоит в том, что в толстой капле удается обнаружить таких паразитов крови, которые находятся в ней в небольших количествах. Быстро устанавливается наличие или отсутствие эозинофилов и производится их подсчет их подсчёт.
То же самое в отношении базофильных эритроцитов.
б) Оксидазная и пероксидазиая реакции лейкоцитов. Оксидазная реакция основана на возникновении индофеноловой голубой краски при воздействии окисляющих ферментов на анафтол и диметилпарафенилендиамин; в местах локализации оксидаз в клетке возникает синее окрашивание.
Техника реакции состоит в следующем:
1. Фиксация мазка в смеси из 1 части 40-процентного формальдегида и 9 частей 95-процентного спирта в продолжение нескольких секунд пли 40-процентного формальдегида и абсолютного алкоголя аа в продолжение 15—20 минут.
2. Окраска: а) 3 минуты слегка разведённым 1-процентным водным щелочным раствором анафтола (раствор приготовляется следующим образом: анафтол при нагревании в дестиллированной воде поднимается кверху и плавает в жидком виде; после введения в раствор кристалла едкой щёлочи анафтол растворяется в воде); б) не удаляя анафтола, на препарат наслаивают 1-процентный водный раствор диметилпарафенилендиамина. Через несколько минут зернистость лейкоцитов, содержащая оксидазу, становится темносиней. Докрашивается препарат сильно разведённым раствором фуксина Циля.
Пероксидазная реакция.
а) Окраска по Край-биш в модификации Грэма. Хорошо высохший мазок в течение 10—15 минут фиксировать жидкостью, состоящей из 1 части 40-процентного формалина и 9 частей 95-процентного спирта. После фиксации слегка промыть водой и покрыть раствором бензидина (приготовление: к 10 см3 40-процентного этилового спирта прибавляется несколько кристаллов бензидина +00,2 см3 3-процентной перекиси водорода). Окраска длится 5 минут. Затем смыть водой.
Места локализации пероксидаз окрашиваются сначала в сероватый, а затем в золотисто-коричневый цвет.
Последующее докрашивание — тионином, метиленовой синькой или краской Гимза.
б) Окраска по Сато. Воздушносухие мазки фиксируют в течение 30 секунд 1/2-процентным раствором медного купороса (CuS04) и затем окрашивают бензидином с перекисью водорода (рецепт приготовления — как в предыдущем методе). Через 2 минуты препарат осторожно промывают дистиллированной водой, на мазок наливают слой 1-процентного водного раствора сафранина, через 15—20 минут сафранин смывают водой и высушивают препарат на воздухе (избегать высушивания фильтровальной бумагой!).
Пероксидазо-положительные гранулы окрашиваются в темносиний цвет, ядра — в красно-жёлтый; эритроциты не окрашиваются.
Посредством оксидазной и пероксидазной реакций облегчается диференциация миэлоидных клеток от лимфоидных. Обе реакции дают аналогичные результаты, но оксидазная реакция более чувствительна.
Нейтрофилы и эозинофилы реагируют резко положительно, базофилы так же, но только на ранних стадиях развития. Зрелые формы оксидазо-отрицательны. Однако ряд авторов считает, что и зрелые базофилы оксидазо-положительны.
Лимфоциты дают безусловно отрицательную реакцию. Моноциты — иногда очень слабо положительную.
С клинической точки зрения представляет интерес тот факт, что при некоторых инфекционных заболеваниях у нейтрофилов исчезают положительная оксидазная п пероксидазная реакции.
в) Окраска токсической зернистости раствором Гимза при рН =5,4. Токсическую зернистость, в отличие от обычной, нормальной зернистости гетерофилов (нейтрофилов), избирательно окрашивают, при окраске по принципу Романовского раствором краски Гимза, применяя буферный раствор с рН =5,4.
Буферный раствор:
Едкий натр (химически чистый) . 21,6 г
Уксусная кислота (химически чистая) .............. 27,0 »
Дистиллированная вода до.....1000,0 см3
Приготовление краски:
Исходной краски Гимза …………10см3
Дистиллигрованной воды ……….40 »
Буферного раствора до ………….100 »
Свежие мазки окрашивают в продолжение 1 часа, старые препараты — дольше (до 2 часов). Краска с мазка смывается буферным раствором и затем высушивается, как обычно.
При окрашивании препарат нужно класть на раствор краски мазком вниз.
Белые кровяные тельца – лейкоциты.
Лейкоциты (белые кровяные тельца) различаются между собой как морфологически, так и по биологической роли в организме. Будучи полноценными клетками, имеющими протоплазму и ядро, лейкоциты обладают отчётливо выраженной способностью к активному способу питания путём захвата и внутриклеточного переваривания попадающих в кровь органических тел. Эта способность приобретает первостепенное биологическое значение в случае проникновения в организм патогенных микробов: пожирание их лейкоцитами — фагоцитоз (Мечников, 1882—1893) — составляет важнейшее средство борьбы организма с инфекцией.
Наряду с фагоцитозом, весьма важное значение имеет образование лейкоцитами иммунных тел. У многих низших, а весьма возможно и высших животных особые лейкоциты выполняют также функцию переноса питательных веществ (трефоциты). Наконец, отдельные виды лейкоцитов (эозинофилы высших животных) способны обезвреживать токсины. Крупную роль лейкоциты играют в обмене веществ и в образовании так называемых трефонов — стимуляторов клеточного роста, особенно в условиях регенерации тканей.
Структурные различия отдельных видов белых кровяных телец изучены, начиная с работ П. Эрлиха (Р. Ehrlich, 1877—1898 гг.), достаточно хорошо. Значительно менее изучены их функциональные особенности, их целлюлярная физиология. Несмотря на огромное количество работ, онтогенез белой крови полностью ещё не выяснен. Наконец, сложная нейро-гуморальная регуляция сосудистой и внесосудистой белой крови исследована в чрезвычайно малой степени. Мало данных имеется даже о длительности жизни белых кровяных телец. По некоторым авторам, она весьма невелика (3—4 дня).
Основным принципом современной классификации лейкоцитов является морфологический.
У различных сельскохозяйственных и лабораторных животных один и тот же тип лейкоцитов (особенно эозинофилы и нейтрофилы, или гетерофилы) имеет специфические отличия в структуре. Однако в главном структура каждого типа лейкоцитов у всех сельскохозяйственных животных весьма близка и поэтому целесообразно вначале дать их общее описание, без видовой дифференциации.
По структуре ядро эозинофилов близко к ядру нейтрофилов, но несколько бледнее и выглядит грубее, так как чередующиеся светлые (оксихроматин) и тёмные (базихроматин) участки ядра эозинофилов крупнее, чем у нейтрофилов.
По мере созревания клетки ядро эозинофильных лейкоцитов изменяется в том же направлении, что и нейтрофильных, т. е. ядерный жгут скручивается и утончается, сперва равномерно (юные и палочкоядерные формы),а затем отдельные участки (сегменты) почти перестают утончаться и остаются сравнительно толстыми, а находящиеся между ними — превращаются в "тончайшие нити (сегментоядерные формы). Однако сегментация ядра эозинофилов выражена не очень резко. Очень частой, типичной формой является 2-дольчатая форма ядра, причём дольки напоминают формирующиеся и только что отрывающиеся капли, обращенные друг к другу узкими концами, соединёнными перемычкой, или две груши, соединённые плодоножками. У овец полиморфность ядра эозинофилов выражена сильнее. Хотя при некоторых болезнях можно наблюдать в крови изменение отношения между возрастными формами эозинофилов в сторону увеличения более молодых (палочкоядерных, юных и даже миэлоцитов. — «сдвиг ядра влево»), но, ввиду относительной малочисленности (3—10%) эозинофилов, учёт ядерного сдвига в лейкоцитарной формуле не производится.
Эозинофилы имеют очень большое клиническое значение. Эозинофилы или исчезают из крови (анэо-винофилия), или уменьшаются в количестве (гипоэозинофилия), или, наконец, количество их резко нарастает (гиперэозинофилия, или просто эозинофилия). Большинство инфекционных заболеваний в первом своём периоде связано с резким уменьшением количества эозинофилов (гипоэозинофилия). Возврат эозинофилов в кровяное русло считают признаком ослабления болезни. При роже свиней и при многих инвазиях (особенно гельминтозах) наблюдается резкое увеличение эозинофилов (эозинофилия), доходящее у крупного рогатого скота до 40%. Эозинофилия встречается и при аллергических реакциях, причём здесь её связывают, так же как и при гельминтозах, с раздражением системы блуждающего нерва.
Функции эозинофилов недостаточно изучены.
Вероятна способность их зернистости к обезвреживанию токсинов, а также участие зёрен в окислительных процессах. Эозинофилы скопляются в местах тканевой регенерации. Характерна локальная эовинофилия кишечника.
III. Специальные зернистые лейкоциты, или нейтрофилы
Нейтрофилы (специальные зернистые лейкоциты, гетерофилы, псевдоэозинофилы или амфиоксифилы некоторых животных) имеют очень важное значение для клиники и физиологии.
Клетки нейтрофилов округлые, диаметром от 7,0 до 15,0 µ. В цитоплазме обильная, очень мелкая, нейтрофильная зернистость. Я д р о, по мере развития клетки, постепенно сегментируется. Зернистость ясно заметна даже в свежей неокрашенной крови. Эти при жизни клетки серебристо блестящие зёрнышки густо выполняют эндоплазму, передвигаясь с нею при амебоидных движениях клетки. Эктоплазма представляет собой тонкий гомогенный периферический слой, свободный от гранул. У некоторых животных (мыши, крысы и кошки) эерни-стость выражена очень слабо, но, однако, вопреки отрицанию Максимова, несомненно есть.
Цитоплазма оксифильна, окрашивается в бледнорозовый цвет, иногда почти бесцветна. Изредка в цитоплазме нейтрофилов встречаются небольшие участки, сохранившие базофилию, характерную для материнской клетки. Такие ясноголубые пятна получили название телец Деле (Dohle).
Окраска зернистости специальных гранулоцитов несколько различна у разных видов животных. Поэтому в последнее время для нейтрофилов предложено новое, удачное наименование — гетерофилы.
У обезьяны, собаки, кошки и свиньи зернистость имеет сродство к нейтральным краскам и при комбинациях красок по Романовскому окрашивается в розово-фиолетовый цвет. У большинства же остальных млекопитающих зернистость амфофильна, т. е. красится как кислыми, так и основными красками. У коровы, овцы, лошади и морской свинки (по Максимову) эти зёрна амфооксифильны, т. е. имеют большее сродство к кислым краскам; у кролика они окрашиваются эозином в яркокрасный цвет и поэтому называются псевдоэозинофилами.
У некоторых животных гранулы амфобазофильны. Зернистость псевдоэозинофилов кур и других домашних птиц окрашивается в яркокрасный цвет,весьма крупна и в большинстве случаев (особенно у зрелых форм) имеет палочковидную и даже веретенообразную, с заострёнными концами, форму. У более молодых форм зёрна округлы (Лебедев). Ряд авторов (Букраба, Я. Соловей) считает, что у кур нет вообще псевдоэозинофилов, а только эозинофилы. Но большинство исследователей диференцирует эозинофилов от псевдоэозинофилов, и морфологически и функционально, сближая последних со специальными гранулоцитами (Максимов, Рухлядев, Клинебергер и Карл, Лебедев). Особенно тщательное исследование разницы между эозинофильной и псевдоэозинофильной зернистостью произвёл Лебедев (1940 г.). Он установил, что при суправитальной окраске бриллианткрезиловая голубая окрашивает гранулы эозинофилов в голубовато-розовый цвет, а псевдоэозинофилов — в зеленовато-синий. Оксидазо- и пероксидазо-положительными оказались лишь эозинофилы. Окраска на липоиды по Зерту (Sehrt) дала положительный результат только с зернистостью эозинофилов. При обработке окрашенных препаратов смесью уксусной кислоты и спирта, зёрна эозинофилов сохраняют свою окраску, а верна псевдоэозинофилов обесцвечиваются. Наконец, сдвиг ядра псевдоэозинофилов у кур был идентичен с закономерностями сдвига ядра нейтрофилов при ряде патологических состояний у других животных. Следует, однако, отметить, что ранние стадии развития псевдоэозинофилов и эозинофилов, окрашенные растворами Гимза или по Паппенгейму, различать крайне трудно.
Разделение лейкоцитов на типы можно представить так:
| Лейкоциты (белые кровяные тельца) | ||||
| Гранулоциты | Агранулоциты | |||
| Имеют цитоплазматическую зернистость. Содержат оксидазу. По типу окислительного обмена отличаются более интенсивным поглощением кислорода и значительным анаэробным гликолизом | Не имеют цитоплазматической зернистости или имеют мелкую азурофильную зернистость, не определяющую функциональную значимость клетки. Оксидазы не содержат или содержат только следы по типу окислительного обмена менее интенсивно поглощают кислород и обладают вдвое слабейшей способностью к анаэробному гликолизу. | |||
| Базофилы или тучные клетки (с базофильностью в цитоплазме) | Эозинофилы (с ацидофильной зернистостью в цитоплазме | Нейтрофилы (гетерофилы), или специальные гранулоциты (с нейтрофильной зернистостью в цитоплазме) | Лимфоциты (цитоплазма голубая с перинуклеарной зоной. Округлое , темно прокрашивающееся ядро, относительно грубой структуры) | Моноциты (дымчато-серая, иногда с розоватым или лиловатым оттенком цитоплазма, несколько расчлененное, бледно окрашивающееся, тонкой структуры ядро) |
Следует иметь в виду, что так называемая «структура» ядер является, при обычных способах фиксации, в том числе и фиксации метиловым спиртом, в значительной степени результатом коллоидальной флокуляции веществ ядра. В зависимости от применяемых фиксаторов, эта структура существенно изменяется. На самом же деле, как показал П. В. Макаров (1948 г.), покоящееся нативное ядро — за исключением ядрышка — оптически пусто, без микроструктур. В период кариокинетического деления в нём возникают временные образования — хромосомы.
Поэтому в дальнейшем описании под структурой ядра следует понимать возникающие в ядре при взаимодействии с фиксирующими и красящими веществами варьирующие образования — коагуляты. В ядрах различных клеток, в зависимости от специфических коллоидально химических различий их ядерной плазмы (кариоплазмы), эти коагуляты имеют некоторые морфологические особенности, которые и дают возможность различать между собою виды клеток.
А. ГРАНУЛОЦИТЫ
I. Базофилы
Базофильные гранулоциты, или тучные клетки, обычно круглой или округло-овальной формы, диаметром 8—15 µ. (у лошадей и коров несколько более крупные). Сама цитоплазма слабооксифильна и окрашивается в бледный, розовато-фиолетовый или, иногда. сыровато-голубой цвет, но находящиеся в ней крупные округлые зёрна (гранулы) резко базофилъной природы и окрашиваются метахроматически в тёмный красно-фиолетовый или ультрамариново-фиолетовый цвет (цвет мальвы — по Крюкову).. Зёрна легко растворяются в воде и потому в препаратах, фиксированных плохо обезвоженным метиловым спиртом, часто на место верен в цитоплазме образуются белые «окошечки». При фиксации абсолютным метиловым спиртом зёрна сохраняются хорошо. Расположение гранул в цитоплазме неравномерное, рыхлое. Часто они закрывают отдельные участки ядра. По своей химической природе базофильные зёрна являются белками, близкими к гликопротеидам.
Ядро базофилов — неясной структуры, неправильно лопастное или округлое, окрашивается в фиолетово-розовый цвет. В ядре расплывчато чередуются более светлые поля оксихроматина с темноокрашенными базихроматиновыми полями.
В базофилах чрезвычайно трудно различить стадии миэлоцита — юную, палочкоядерную и сегментоядерную. Вообще сегментированность ядра выражена слабо. Практического значения, для подсчёта лейкоцитарной формулы, дифференциация базофилов по степени их зрелости не имеет, прежде всего, потому, что в крови млекопитающих их очень мало: от 0,1 до 1—2%, в среднем 0,5%. Кровь сельскохозяйственных птиц содержит 3—4% базофилов, а содержание их в крови лягушек доходит до 23%.
Вообще, содержание базофилов очень высоко у амфибий, рептилий и у некоторых рыб.
Функциональное значение базофилов не выяснено. Повидимому, они играют некоторую роль в защите организма при парентеральном введении чуждых белков. Они способны фагоцитировать и содержать окислительные ферменты. Ряд учёных считает их трефоцитами («питающие клетки» Либмана). Такие клетки, переносящие питательные вещества, особенно широко распространены у беспозвоночных, где они часто преобладают.
Клиническое значение базофилов невелико. Количество их несколько возрастает при инъекции белков, при некоторых авитаминозах (группы В) и гепатических циррозах.
II. Эозинофилы
Эозинофилы (синонимы — оксифилы или ацидофилы) — это крупные (особенно у лошади) круглые клетки, диаметром от 8,2 до 19,8)1. Очень редко попадаются карликовые формы эозинофилов (особенно у крупного рогатого скота при депрессии гемопоэза). Очень крупны Эозинофилы лошади.
Цитоплазма слегка базофилъна, бесцветна или голубоватого цвета. Зёрна ярко окрашены эозином в интенсивный красный или розово-красный цвет (по описанию Крюкова, в кирпично-красный). У птиц они скорее розовые, чем красные. У молодых форм гранулы часто окрашены базофильно и лишь постепенно, по мере созревания клетки, становятся ацидофильными. У кошек цвет верен красновато-пурпурный.
Размерь и форма гранул весьма различны. У лошади .они очень крупные (до Зµ в поперечнике], покрывают часть ядра и придают эозинофилу вид плода малины (табл. 1—2). Довольно крупные верна у эозинофилов кролика (до 1,5 µ). Значительно мельче эозинофильная зернистость овцы. У свиньи зерна очень правильной круглой формы.
Обычно зёрна эозпнофилов расположены очень тесно, у лошади они часто даже сдавливают друг друга и приобретают угловатую форму и между зёрнами трудно различить цитоплазму. Однако у некоторых животных (например, у овцы) зерна могут быть расположены сравнительно редко, особенно в молодых клетках, и тогда цитоплазма видна хорошо. Типичные эозинофилы имеются в крови почти у всех позвоночных (кроме некоторых рыб). У п т и ц (Казаринов, Лебедев) зёрна эозинофилов относительно мелки. У рептилий эозинофилы составляют большинство лейкоцитов. Ацидофильные зёрна эозинофилов рептилий, плотно расположенные в цитоплазме, то шарообразны, то овальны, иногда имеют форму ромбических кристаллоидов или, наконец, представляют собой глыбки неправильной формы. Эозинофилы амфибий весьма напоминают собой аналогичные клетки у млекопитающих. Их гранулы относительно весьма велики. У большинства рыб имеются типичные эозинофилы, чаще всего с простым, круглым ядром. У некоторых видов рыб эозинофилы атипичны, — это лимфоидные клетки с редкими, но очень крупными гранулами, в цитоплазме. Наконец, в крови некоторых видов рыб эозинофилы, невидимому, не содержатся.
Микрохимическими методами установлена липоидно-белковая природа зёрен эозинофилов; они содержат фосфор и, возможно, железо. По Кальману (Kallman), юные эозинофилы птиц имеют гранулы нуклеопротеидной природы; позднее они становятся чисто альбуминовыми.
Зёрна эозинофилов видны даже в неокрашенных клетках, где они выделяются жёлтым цветом и высоким показателем преломления.
У амфибий, особенно лягушек, при хорошей фиксации и окраске по Романовскому в модификации Паппенгейма, зернистость удаётся выявить достаточно ясно. Зернистость гетерофилов у рептилий выражена слабо, но утверждение Максимова, что цитоплазма гетерофилов амфибий красится диффузно или выявляет сетчатое строение, но не содержит различных гранул, несомненно неправильно.
Окрашиваемость гранул в гетерофилах рыб сильно варьирует; у одних видов зернистость нейтрофильна, у других амфофильна. Наконец, у некоторых видов рыб гетерофилы (типичные по сегментированному ядру) до сих пор не найдены.
Форма ядра специальных гранулоцитов изменяется в зависимости от возраста клетки. Редко появляющаяся в крови (только при патологических состояниях) начальная форма — миэлоцит имеет округлое, реже с отдельными вдавленнями, ядро. В дальнейшем оно вытягивается («скручивается», по А. Н. Крюкову) в сочное бобовидное или колбасовидное ядро (юная форма), а  затем ещё более вытягивается и изгибается то в форме изогнутой палочки, то подковы или буквы S. Это палочкоядерная форма. Наконец, ядро перекручивается и образует ряд сегментов (долек), связанных очень тонкими, иногда почти незаметными нитями. Это полиморфноядерные или сегментоядерные формы. Так как первые исследователи не замечали перетяжек между сегментами и каждый сегмент принимали за отдельное ядро (Эрлих), то эти клетки получили сначала название полинуклеаров (многоядерных). В настоящее время их правильнее называют полиморфноядерными нейтрофилами. Описанный процесс изменения ядра наблюдался у свиньи, собаки и морской свинки.
затем ещё более вытягивается и изгибается то в форме изогнутой палочки, то подковы или буквы S. Это палочкоядерная форма. Наконец, ядро перекручивается и образует ряд сегментов (долек), связанных очень тонкими, иногда почти незаметными нитями. Это полиморфноядерные или сегментоядерные формы. Так как первые исследователи не замечали перетяжек между сегментами и каждый сегмент принимали за отдельное ядро (Эрлих), то эти клетки получили сначала название полинуклеаров (многоядерных). В настоящее время их правильнее называют полиморфноядерными нейтрофилами. Описанный процесс изменения ядра наблюдался у свиньи, собаки и морской свинки.
У большинства сельскохозяйственных животных процесс созревания сопровождается не сегментацией ядра, а образованием колец и приводит к возникновению так называемых цепочкообразных и узловатых форм ядра. Это видно из следующего рисунка (рис. 2).
Ядро специальных гранулоцитов окрашивается интенсивно (особенно у молодых), с резким чередованием базихроматина и оксихроматина (тёмных и светлых участков). Поэтому у зрелых форм структура ядра грубая. В ядре относительно много базихроматина (нуклеопротеидов и нуклеиновых кислот).
Специальные гранулоциты — это микрофаги И. И. Мечникова. Он объясняет перешнуровывание и сегментацию их ядра как специальное приспособление к диапедезу (миграции с проникновением через стенки капилляров). Именно поэтому они получили название специальных гранулоцитов (А. Максимов).
Гетерофилы содержат оксидазу и протеолитические ферменты (трипсин). Но некоторым данным, содержание ферментов, особенно трипсина, увеличивается при преобладании в пище белков.
Количество специальных гранулоцитов в крови довольно велико и колеблется в зависимости от вида животного, его функционального состояния и заболевания. Больше всего их у собак (60—70% всех лейкоцитов), меньше всего — у крупного рогатого скота (25—35%).
При патологических состояниях организма состав специальных гранулоцитов значительно изменяется. Резко уменьшается количество сегментоядерных клеток и нарастает количество палочкоядерных, юных и даже миэлоцитов, мобилизуемых из костного мозга в сосудистую кровь. Так как в самой левой графе лейкоцитарной формулы отмечаются наиболее молодые, в нормальной крови не встречающиеся клетки — миэлопиты, а все более взрослые формы — юные, палочкоядерные и сегментоядерные — размешаются в соответствующих графах все правее, то обогащение крови более молодыми формами получило название «сдвига ядра влево».
Регенеративный и дегенеративный сдвиги ядра. Различают два основных типа сдвига ядра: а) регенеративный и б) дегенеративный.
а) Регенеративный сдвиг ядра выражается в сдвиге ядра влево с увеличением в крови палочкоядерных, юных и даже миэлоцитов; обычно при этом наблюдается лейкоцитоз. Этот сдвиг и усиление лейкопоэза являются показателем раздражения костного мозга, происходящего при его функциональной достаточности. Костный мозг, компенсируя гибель нейтрофилов в борьбе с инфекцией, отдаёт в кровяное русло, наряду со зрелыми, всё возрастающее количество недостаточно зрелых форм, обычно не поступающих в сосудистую кровь.
б) При дегенеративном сдвиге общее часто уменьшается, отмечается нарастание палочкоядерных форм, в значительной степени дегенеративных без дальнейшего сдвига ядра влево. Дегенеративный сдвиг является показателем функциональной недостаточности костного мозга, в котором наблюдается тканевая дегенерация.
Индексом сдвига ядра называется отношение (М+Ю+П)/С равное обычно для крови взрослой лошади (О+О+4)/50 = 4/50
Для крови верблюда он равен 12.5/38 , коровы 6/25 и свиньи 3/40 (по Сёмушкину и Домрачеву).
В легких случаях патологического процесса сдвиг ядра влево не идёт далее увеличения палочкоядерных и частично юных форм. Напротив, появление большого количества миэлоцитов и юных специальных гранулоцитов в крови свидетельствует о тяжести заболевания.
При некоторых заболеваниях (особенно кроветворных органов) в крови появляются гигантские полисегментированные клетки. У некоторых животных, однако (например, у овцы), полисегментированные нейтрофилы находятся и в нормальной крови.
К дегенеративным изменениям специальных гранулоцитов относятся: пикнотичность и причудливые, резко угловатые формы ядра, токсическая зернистость и многочисленные вакуоли в цитоплазме.
Особенно большое значение имеет токсическая зернистость цитоплазмы. При обычной окраске растворами Гимза или Паппенгейма, мелкая в физиологической норме зернистость резко укрупняется, и зёрна часто сливаются в причудливую сеть (токсически изменённая зернистость). Для удобства дифференциации нормальной зернистости от токсической лучше применять окрашивание карболфуксинметиленовой синькой по Е. Фрейфельд. В этом случае физиологически нормальная зернистость гетерофилов почти не окрашивается, а патологическая резко выступает в виде фиолетово-синих зёрен или нитей и сеток на нежнорозовом фоне цитоплазмы. Можно также применять окраску по Гимза при кислой реакции воды (рН=5,4).
Вакуоли довольно часты в токсически изменённых или «старых» гетерофилах.
Иногда при инфекциях и интоксикациях в цитоплазме гетерофилов встречаются серо-голубые участки в виде хлопьев или бляшек, так называемые тельца Дёле (Dohle). Это остатки базофильных участков цитоплазмы раннего периода развития клетки.
Количество специальных гранулоцитов резко возрастает в начальной стадии большинства инфекционных болезней («нейтрофильная фаза борьбы»).
В. АГРАНУЛОЦИТЫ
IV. Лимфоциты
Лимфоциты являются типичными агранулоцитами, так как не содержат никакой характерной зернистости в цитоплазме, 8а исключением изредка попадающихся отдельных азурофильных верен. Клетки лимфоцитов округлые, с круглым или овальным ядром, которое окружено или очень узким (малые лимфоциты), или более широким (средние и большие лимфоциты) поясом цитоплазмы. Лимфоциты птиц и амфибий (лягушка) часто встречаются с зафиксированными в момент передвижения псевдоподиями.
Диаметр малых лимфоцитов от 4,5 до 6,5 (л, средних от 6,5 до 10 р. и больших от 10,0 до 18,0 jx.
Цитоплазма лимфоцитов базофильна; при окраске по способу Паппенгейма имеет сетчатое строение, а окрашенная раствором Гимза — гомогенна. Цвет— от бледноголубого у больших и средних лимфоцитов до синего у малых. Вокруг ядра заметна светлая, так называемая перинуклеарная зона. Последний признак помогает диференцировать больших лимфоцитов от не имеющих этой зоны моноцитов. В некоторых (преимущественно малых, иногда средних) лимфоцитах в цитоплазме встречаются в очень небольшом количестве азурофильные зёрнышки (2—8). Крайне редко эти зёрна бывают очень крупными (до 2 ji в диаметре).
Цитоплазма малых лимфоцитов иногда видна лишь с одной стороны ядра в виде очень узкого, едва заметного ободка (форма "серпа"). В некоторых клетках и этот серп незаметен, и тогда малый лимфоцит имеет вид «голого ядра».
Вообще по отношению к цитоплазме ядро лимфоцитов велико, форма его круглая или овальная, особенно правильная у малых лимфоцитов. Часто встречаются ядра с односторонним вдавлением, придающим ядру форму боба (ридеровская форма ядра). Крупные лимфоциты иногда имеют ядро менее правильной формы — угловатое, с выступами или вдав-лениями. В патологических случаях встречаются лимфоциты с неправильной лопастной формой ядра или расчленение ядра может напоминать сегментированные ядра специальных гранулоцитов.
В строении ядра лимфоцитов характерно наличие темноокрашивающихся, неясноочерченных больших глыбок базихроматина, со слабыми просветами между ними. Иногда это чередование тёмных глыбок с тонкими просветами придаёт ядру некоторое сходство с рисунком колеса, спицами которого служат светлоокрашивающиеся участки (А. Н. Крюков и др.). У малых лимфоцитов тёмные глыбки базихроматина настолько сливаются, что структуру ядра установить трудно.
Ядро больших лимфоцитов более рыхлое и менее интенсивно окрашивающееся. В ядре крупных лимфоцитов имеются не всегда ясно заметные 1—2 ядрышка.
Лимфоциты содержат липазу и, повидимому, принимают известное участие в кишечном пищеварении (Синельников). Их базофильная, содержащая некоторое количество нуклеотидов цитоплазма, продуцирует значительное количество иммунных тел (Догерти и Вайт) (Dougherty, White) (1945 г.).
Наконец, лимфоциты участвуют в образовании, из белков плазмы крови, трефонов (Хрущев).
Лимфоциты составляют большинство клеток белой крови у крупного рогатого скота (50—60% всех лейкоцитов), свиней (45—60%), овец (55—65%), коз (40—50%), кур (45—65%) и кроликов (50—65%). У этих животных имеется так называемый лимфоцитарный профиль крови. У собаки и лошади количество лимфоцитов в крови меньше; там превалируют специальные гранулоциты. Однако и у этих животных число лимфоцитов остаётся довольно значительным (20—40% от всех белых кровяных телец).
Количество лимфоцитов в крови молодых животных больше, чем в крови взрослых (за исключением первых дней после рождения). У низших позвоночных количество лимфоцитов может быть относительно очень велико.
В клинике лимфоцитоз встречается в конце благоприятно протекающего инфекционного заболевания («лимфоцитарная фаза выздоровления»). Лимфоцитоз характерен для лимфатической лейкемии, встречается при инфекционной анемии у лошадей и некоторых других заболеваниях.
V. Моноциты
Моноциты — большие клетки крови (от 10,0 до 20,0 µ в диаметре), большей частью округлой, иногда неправильной формы, с хорошо выраженной цитоплазмой, имеющей мельчайшую азурофильную зернистость, и большим, часто эксцентрически расположенным ядром с бухтообразными вдавлениями и лопастями.
Мелкая азурофильная вернистость цитоплазмы почти не видна у моноцитов сельскохозяйственных птиц.
Цитоплазма моноцитов слегка базофилъна, голубовато-серого или пепельно-серого цвета («цвета сигарного дыма») при окраске раствором Гимза п свинцово-серого пли грязноспнего цвета при окраске по способу Паппенгейма. Перинуклеарной зоны нет или она выражена очень слабо. По Крюкову, особенности окраски цитоплазмы моноцитов зависят от того, что преобладающая в ней пара-плазма методом Паппенгейма красится частью в синий цвет, частью в розовый, причём в некоторых клетках превалирует синяя субстанция при почти полном отсутствии розовой, в других обилие розовой субстанции оставляет явственный, своеобразный . отпечаток на морфологическом облике клетки, придавая её протоплазме фиолетово-синий или серо-фиолетовый тон.
У птиц цитоплазма моноцитов серовато-голубая и мало отличается от цвета цитоплазмы лимфоцитов.
Азурофильная зернистость моноцитов хорошо выявляется при окраске по Паппенгейму и с трудом, только при длительной и очень хорошей окраске, — по Гимза. Зернистость розово-красная, очень мелкая, пылевидная.
Ядро сравнительно велико, обычно образует выступы (лопасти) и бухтообразные углубления. Оно имеет очень нежную, тонкую структуру. Ядро моноцитов амблиохроматично (бледно окрашивается), с широконитчатой, мягкой, «облачносливающейся», неравномерной хроматиновой сетью. Интенсивность окраски ядра моноцитов гораздо слабее, чем у лимфоцитов.
Моноциты — это типичные макрофаги И. И. Мечникова. Они захватывают и переваривают остатки распавшихся клеток, попадающие в кровь, инородные частички, в том числе некоторые бактерии, и играют значительную роль в образовании иммунных тел.
В моноцитах имеется протеолитический фермент типа катепсина.
Нормальное количество моноцитов в крови млекопитающих и птиц колеблется в пределах от 2 до 8%. Моноцитоз (повышенное содержание моноцитов) наблюдается в первую фазу выздоровления при большинстве случаев инфекционных болезней («моноцитарная защитная фаза, или фаза преодоления»), при инфекционной анемии лошадей, протозойных заболеваниях и большинстве других инфекционных болезней. По Н. М. Николаеву, однако, моноцитоз при заболеваниях далеко не всегда благоприятный признак, знаменующий собой начало выздоровления.
Плазматические клетки (клетки раздражения)
Плазматические клетки (клетки раздражения) характеризуются одним общим для них признаком — резкой базофилией цитоплазмы (ультрамариновый цвет). Иногда в цитоплазме видны вакуоли. Эта весьма немногочисленная группа клеток имеет полифилетическое, главным образом лимфоцитоидное или миэлоидное происхождение. В соответствии с этим, ядро клеток Тюрка имеет структуру, соответствующую структуре ядер тех клеток, из которых они возникли, но окраска его всегда относительно темнее. Форма ядра — круглая или овальная. Правильные глыбки хроматина придают ядру пятнистый и несколько пикнотический характер.
Вокруг ядра обычно хорошо заметна перинуклеарная зона, периферический же слой цитоплазмы окрашен в интенсивносиний (ультрамаринового оттенка) цвет. Форма клеток — овальная, иногда сильно вытянутая или полигональная, реже круглая. Расположение ядра обычно эксцентричное. Структура цитоплазмы волокнистая или комковатая.
Из плазматических клеток могут возникнуть резко отличные от них по виду дегенеративные формы. В протоплазме плазматических клеток, утрачивающей базофильность, появляются крупные эозинофильные гранулы, вначале имеющие игольчатую форму. Ядро пикнотизируется, и клетка распадается. Гранулы распавшихся клеток, проникшие в соединительную ткань, называются русселевскими тельцами.
Плазматические клетки в крови млекопитающих в заметных количествах встречаются только при патологии. Ими характеризуется так называемая «пёстрая картина крови». У сельскохозяйственных птиц они имеются и в нормальной крови (у кур 0,1 %, по Лебедеву, у гусей до 1,5%, по Домрачеву).
КЛАССИФИКАЦИЯ БЕЛЫХ КЛЕТОК КРОВИ ПО Н. М. НИКОЛАЕВУ
Описанная до сих нор классификация лейкоцитов основывается, главным образом, на их морфологии, так как современное состояние наших знаний о физиологии белых кровяных клеток недостаточно для составления обоснованной функциональной классификации лейкоцитов. Однако некоторые попытки в этом отношении имеются.
Одной ив таких попыток является классификация лейкоцитов Н. М. Николаева. Он рассматривает зернистость белых кровяных клеток как момент, тесно связанный с их функцией. Хорошо выраженная зернистость — признак высокой реактивности клеток мезенхимы.
Соответственно этому основному положению, Н. М. Николаев выделяет пять групп лейкоцитов:
![]()
I группа А
эндотелий
I группа моноцит
гистиоцит
миэлобласт
![]()
I группа Б
промиелоцит
миелоцит
I группа юный нейтрофил (гетерофил)
I группа В
Палочкоядерный нейтрофил (гетерофил)
II группа { сегментоядерный нейтрофил (гетерофил)
III группа { эозинофил одно- и двуядерный
IV группа { базофил
![]() V группа А
V группа А
Лимфобласт
Клетки раздражения
V группа Эритрогоний
Эритробласт
Нормобласт
V группа Б
Лимфоцит
К первой группе Н. М. Николаев относит исходные (материнские) клетки и близкие к ним; ко второй — сегментоядерные и нейтрофилы (зрелые микрофаги); к третьей — клетки фагоцитировавшие (Н. М. Николаев считает, что зёрна эозинофилов — это остатки поглощённых эритроцитов); к четвёртой — дегенеративные клетки и, наконец, к пятой — так называемые синтетические клетки, образующие или гемоглобин (эритробласты), или глобулин (лимфоциты).
В качестве принципиально новой клеточной формы среди агранулоцитов Н. М. Николаев выделяет так называемый гистиоцит или микромоноцит. При окраске раствором Гимза он может быть отличен от лимфоцитов по таким признакам (цитируем по Н. М. Николаеву):
| Лимфоцит Узкий пояс протоплазмы Интенсивная базофилия протоплазмы Гомогенная или грубозернистая протоплазма Азурчфильные зёрна редки или единичны Темнофиолетовая окраска ядра Густое пикнотрчное ядро, иногда глыСчатое Перинуклеариая зона вокруг ядра | Гистиоцит Более широкая протоплазма Светлоголубая или сероватая протоплазма Сетчатая или вакуолизиро-ванная протоплазма Большей частью азурофиль-ные зёрна Более светлая окраска ядра Более равномерное, менее плотное ядро Перинуклеарная зона часто отсутствует |
В ряде случаев такое выделение гистиоцитов начинает проникать в практическую медицину и ветеринарию.
РАЗМЕРЫ ЛЕЙКОЦИТОВ СЕЛЬСКОХОЗЯЙСТВЕННЫХ ЖИВОТНЫХ
Видовые различия в величине белых кровяных телец незначительны. Ниже приводится таблица диаметров эритроцитов, лейкоцитов и кровяных пластинок у сельскохозяйственных и лабораторных животных.
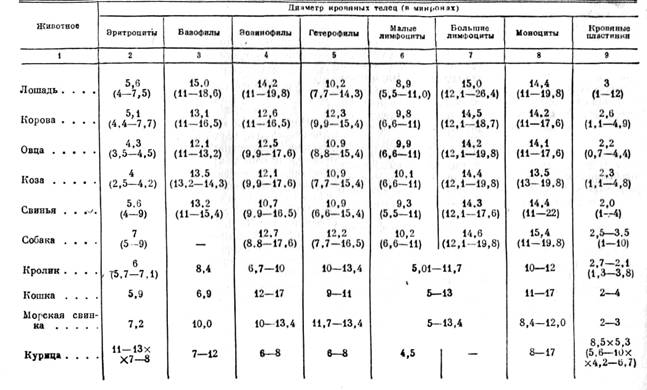
Размеры (диаметры в µ) кровяных клеток у лабораторных и сельскохозяйственных животных
ЛЕЙКОЦИТАРНАЯ ФОРМУЛА И ЛЕЙКОЦИТАРНЫЙ ПРОФИЛЬ КРОВИ
Количественный и качественный состав крови зависит от функционального и патологического состояния организма. Сложные биохимические и физиологические изменения, происходящие в организме при различных патологических состояниях, изменяют функциональное состояние гемопоэтической системы, а стало быть, и состав крови. Эти влияния изучены в совершенно недостаточной степени. Решающая роль здесь, несомненно, принадлежит изменению характера обмена веществ в самих периферических тканях. Некоторое представление об этом даёт схема взаимоотношений кроветворных органов с железами внутренней секреции, в основном заимствованная у Н. М. Шустрова и X. X. Владоса (1930 г.) (рис. 3).
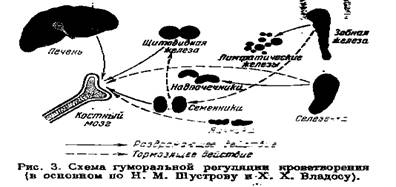
Известно также влияние нуклеиновокислого натра, вызывающего лейкоцитоз. Несомненное, хотя и мало изученное, влияние на кроветворение оказывает активная реакция ретикулоэндотелиальной системы тканей внутренней среды.
При патологическом раздражении вегетативной нервной системы наблюдаются две фазы лейкоцитоза: 1-я фаза — лейкоцитоз с миелоидной тенденцией, сочетающийся при болезни с усилением лихорадочного состояния, обмена веществ, ускорением распада белков, повышением содержания сахара и падением содержания холестерина в крови и ацидозом,—преимущественно симпатикотония; 2-я фаза — лейкопения с лимфатической тенденцией, эозинофилия, ослабление лихорадки и обмена веществ, замедление распада белков и вообще явления, противоположные наблюдающимся в 1-й фазе, преимущественно ваготония. Влияние блуждающего нерва на эозинофилню установлено с достаточной достоверностью, так же как влияние симпатического на нейтрофилию.
На гемопоэз влияют следующие основные гуморальные факторы:
а) продукты распада красных кровяных телец и,
возможно, лейкоцитов — стимулирующе;
б) щитовидная железа — стимулирующе;
в) печень — стимулирующе;
г) половые гормоны: андроген — стимулирующе— и эстроген — угнетающе (это установлено только для кролика);
д) ряд витаминов группы В, прежде всего фолеивая кислота, — стимулирующе;
е) токсины микроорганизмов, особенно патогенных, и продукты их распада (действие неоднозначное и диференцированное по отношению к различным видам кровяных клеток);
ж) гуморы: ацетилхолин, адреналин (влияние мало изучено);
з) антианемический фактор желудка — стимулирующе (П. А. Троицкий и др.);
и) гормон селезёнки — угнетающе.
Под воздействием этих гуморальных факторов количественный и качественный состав крови своеобразно меняется. Однако следует иметь в виду, что картина крови oтражает (и то не всегда прямо) функциональное состояние лишь кроветворных органов, а не организма в целом. При этом токсины, действующие, например, на нервную ткань, могут не оказывать существенного влияния на систему кроветворения, и наоборот. Очевидно, при различных заболеваниях состав крови может быть одинаковым, и, наоборот, одно и то же заболевание, в зависимости от функционального состояния кроветворных органов, может дать различные картины крови. Поэтому Е. Фрейфелъд (1948 г.) считает, что при пользовании лейкоцитарной формулой нужно руководствоваться следующими положениями: 1. Так как кроветворная система является для организма очень важным органом, то необходимо знать, как она функционирует, точно так же, как необходимо знать функции сердца, почек и т. п.
2. По крови мы устанавливаем функциональную диагностику кроветворной системы, некоторые функции которой вам известны, других же мы не знаем.
3. Ввиду того, что некоторые заболевания дают резко выраженный различный морфологический состав крови возможно исследованием крови исключить одно заболевание и высказаться в пользу другого.
4. Так как кровяные клетки постоянно сменяются новыми, то в случаях, когда они выявляют морфологически действие токсина (токсичность лейкоцитов, различные степени созревания — сдвиги), можно легко проследить, когда действие токсина прекращается, и, наоборот, выявить его, как только оно появляется.
Похожие работы
... ревматизма обусловила значительное снижение заболеваемости — до 0Д8 на 1000 детского населения. В разработку проблемы детского ревматизма внесли большой вклад отечественные педиатры В. И. Молчанов, А. А. Кисель, М. А, Скворцов, А. Б. Воловик, В. П. Бисярина, А. В. Долгополова и др. Эпидемиология, Установлена связь между началом заболевания и перенесенной стрептококковой инфекцией, в основном в ...
... крови в мокроте больного в период стихания процесса не является противопоказанием к назначению массажа по предлагаемой методике. Продолжая поиски возможностей более эффективного применения массажа при этой патологии, О.Ф-.Кузнецов (1979, 1980) предложил для больных хронической пневмонией, бронхиальной астмой и хроническим бронхитом новую методику и обосновал ее большую эффективность при равнении ...
0 комментариев