Навигация
Определение массовых изобарной и изохорной теплоёмкостей
3.3. Определение массовых изобарной и изохорной теплоёмкостей.
Массовые изобарная и изохорная теплоёмкости (кДж/(кг·К)) определяется по формуле:
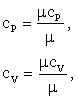
где ![]() – мольные изобарная и изохорная теплоёмкости, кДж/(кмоль ·К).
– мольные изобарная и изохорная теплоёмкости, кДж/(кмоль ·К).
Таблица 2
Приближенные значения мольных теплоемкостей при постоянном объеме и постоянном давлении (![]() ) [
) [![]() ]
]
| Газы |
|
|
| Одноатомные | 12,56 | 20,93 |
| Двухатомные | 20,93 | 29,31 |
| Трехатомные | 29,31 | 37,68 |
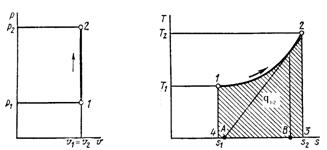
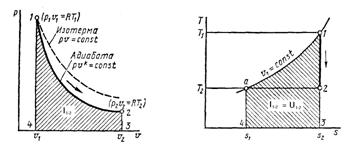
3.4. Процессы газового цикла.
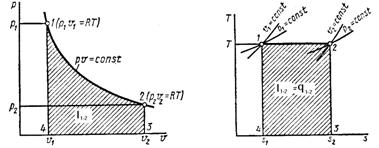
Рассматриваемые процессы газа равновесные, т. е. состоят из равновесных промежуточных состояний, которые характеризуются одинаковым давлением, удельным объемом и температурой. Расчет процессов газового цикла начинается с процесса (1-2).
Уравнение первого закона термодинамики дает возможность исследовать явления, происходящие с газами при изменении его состояния.
В общем виде первый закон термодинамики представляет собой математическое
выражение закона сохранения и превращения энергии. Его можно представить в таком виде ![]() :
:
![]() ,
,
т.е. подведенное к газу тепло расходуется на изменение внутренней энергии газа и на совершение работы.
Изменение энтальпии для термодинамических процессов ![]() определяется по формуле
определяется по формуле
![]()
Превращение работы в теплоту происходит всегда полностью, обратный же процесс превращения теплоты в работу при непрерывном переходе возможен лишь при определенных условиях. Второй закон термодинамики устанавливает условия преобразования тепловой энергии в механическую, определяет направление, в котором протекают процессы, а также максимальное значение работы, которая может быть произведена тепловым двигателем.
Для изучения процессов превращения тепла в работу в тепловых двигателях используют параметр состояния газа – энтропию газа.
В данной работе рассматривается прямой обратимый цикл. Второй закон термодинамики для обратимого процесса имеет вид ![]() :
:
![]()
Для вычисления изменения энтропии для термодинамических процессов (кроме адиабатного) используют логарифмические зависимости. В адиабатном процессе изменения состояния газа, в котором ![]() , энтропия не изменяется.
, энтропия не изменяется.
Если в прямом цикле в процессе расширения к газу подводится тепло в количестве ![]() , а в процессе сжатия от газа тепло отводится в количестве
, а в процессе сжатия от газа тепло отводится в количестве ![]() , то разность
, то разность ![]() как теплота исчезает в течение цикла в результате преобразования её в механическую энергию. Так как газ возвращается в первоначальное состояние, изменение внутренней энергии нет
как теплота исчезает в течение цикла в результате преобразования её в механическую энергию. Так как газ возвращается в первоначальное состояние, изменение внутренней энергии нет ![]() , т.е. в соответствии с первым законом термодинамики:
, т.е. в соответствии с первым законом термодинамики:
![]() ,
,
так как в течение цикла совершена полезная работа. Исчезнувшее тепло ![]() , затраченное на совершение полезной работы, называется полезным теплом; количества тепла
, затраченное на совершение полезной работы, называется полезным теплом; количества тепла ![]() называется подведенным теплом, а
называется подведенным теплом, а ![]() - отведенным.
- отведенным.
Для количественной оценки работы идеального теплового двигателя, в котором отсутствуют потери на трение, пропуски через не плотности, излучение вводится отношение
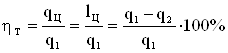 ,
,
называемое термическим коэффициентом полезного действия. Этот коэффициент измеряет количество полезной работы на единицу подведенного тепла.
Похожие работы
... термодинамических процессов. Процесс изохорный изобарный изотермический адиабатный 2. Варианты заданий [4] В приведенных ниже вариантах заданий на курсовую работу рассматривается газовые циклы тепловых двигателей. Основное допущение для термодинамического расчета газового цикла теплового двигателя: ...
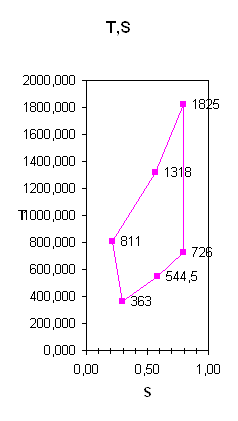
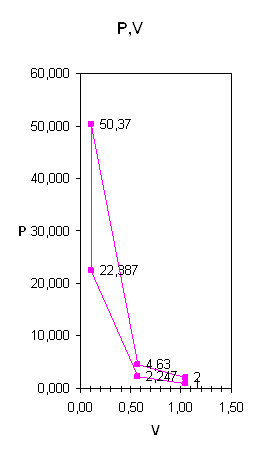
... , определены изменения внутренней энергии, энтальпии, энтропии, теплоты, удельные работы процессов и за цикл. Изображён идеальный цикл в p-v и T-S-координатах. Определены погрешности рассчитанных и . Рассчитаны энергетические характеристики ГТД. Введение Авиационный газотурбинный двигатель является сложной технической системой с высокими удельными параметрами. Конструкция доводилась до ...
... 575 1,725 1,875 ηt % 57,6 59,5 61,2 62,6 63,8 64,9 64,3 63,3 62,4 61,5 60,6 59,7 61,3 61,6 61,8 62,0 62,1 62,2 5.4 Анализ В ДВС с воспламенением рабочей смеси (около ВМТ) от электрической искры время сгорания очень мало, в связи, с чем допустимо принять, что процесс подвода теплоты осуществляется при постоянном объеме ( ...
Исходные данные: Рабочее тело обладает свойствами воздуха, масса равна 1 кг Газовый цикл состоит из четырех процессов, определяемые по показателю политропы. Известны начальные параметры в точке 1 (давление и температура), а также безразмерные отношение параметров в некоторых процессах Дано: n1-2 =1,35; n2-3 = ∞; n3-4 = К; n4-1 = ∞; p1 = 1∙105 Па; t1 = 90 ºC; v1/v2 ...


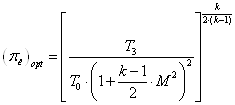
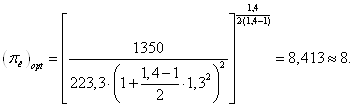


0 комментариев