Навигация
Согласно классификации фазовых превращений, предложенной в 1933 г. Эрипреситом, превращения подразделяются на превращения (переходы) I и II родов
1. Согласно классификации фазовых превращений, предложенной в 1933 г. Эрипреситом, превращения подразделяются на превращения (переходы) I и II родов.
Переходы первого рода характеризуются тем, что первые производные термодинамического потенциала по температуре и давлению изменяются скачкообразно
![]()
![]() ,
,
здесь S – энтропия, V – объем
Так как термодинамический потенциал при фазовых переходе меняется непрерывно определяется выражением
![]()
то энергия U также должна изменяться скачком. Так как
![]()
то теплота перехода
![]()
равна произведению температуры на разность энтропии фаз, т. е. скачкообразное изменение или поглощение теплоты.
Важным является непрерывное изменение термодинамического потенциала. Функция ![]() (Т) и
(Т) и ![]() (Т) не изменяют особенностей вблизи точки фазового перехода, при этом с обеих сторон точки фазового перехода имеются минимумы термодинамического потенциала.
(Т) не изменяют особенностей вблизи точки фазового перехода, при этом с обеих сторон точки фазового перехода имеются минимумы термодинамического потенциала.
Этой особенностью объясняется возможность перегрева или переохлаждения фаз в случае фазовых переходов в системе.
Определим взаимосвязи между скачками термодинамических функций ![]() и
и ![]() . После дифференцировании по температуре соотношение Функция
. После дифференцировании по температуре соотношение Функция ![]() (Р,Т) =
(Р,Т) =![]() (Р,Т) с учетом выражения для S, V и q получим
(Р,Т) с учетом выражения для S, V и q получим
![]()
Эта известная формула Клайперона-Клаузиса. Она позволяет определить изменение давлений, находящихся в равновесии фаз при изменении температуры либо изменении температуры перехода между двумя фазами при изменении давления. Скачкообразное изменение объема приводит к отсутствию определенной связи между структурой и системой фаз, преобразующихся при фазовом переходе первого рода, которые в связи с этим изменяются скачком.
Типичными для фазовых переходов первого рода являются переходы между агрегатными состояниями вещества, аллотропическими превращения многие фазовые превращения в многокомпонентных материалах.
Принципиальное отличие фазовых переходов второго рода от фазовых переходов первого рода заключается в следующем: переходы второго рода характеризуются как непрерывностью изменения термодинамического потенциала, так и непрерывностью изменения производных термодинамического потенциала ![]() .
.
Химическое равновесие
Термодинамическая функция – функция состояния, определяющая изменение термодинамических потенциалов при изменении числа частиц в системе. Другими словами ![]() – есть функция, которая определяет направление и предел самопроизвольного перехода компонента из одной фазы в другую при соответствующих превращениях и условиях (T, P, V, S, ni).
– есть функция, которая определяет направление и предел самопроизвольного перехода компонента из одной фазы в другую при соответствующих превращениях и условиях (T, P, V, S, ni).
Термодинамические потенциалы связаны с друг другом следующими соотношениями
F = U – TS
H = U + pV
G = F + pV
![]() - количество вещества в граммах;
- количество вещества в граммах; ![]() - количества вещества в молях;
- количества вещества в молях;
![]()
М – молекулярный вес соответствующего вещества.
Для теории твердых растворов, на которых работают все приборы микроэлектроники огромное значение имеет развитый Гиббсом метод химических потенциалов. Химическое равновесие можно определить с помощью химических потенциалов.
Химический потенциал характеризуется энергией, приходящейся на 1 атом
![]()
![]() - химический потенциал; G – энергия Гиббса;
- химический потенциал; G – энергия Гиббса;
No – число Авогадро, NА – L = ![]() моль-1
моль-1
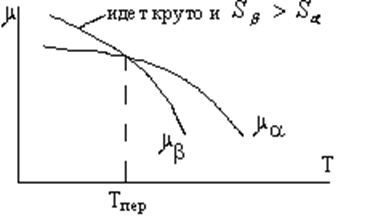
т. е. ![]() (Р,Т) =
(Р,Т) =![]() (Р,Т)
(Р,Т)
Обе кривые характеризуют монотонное убывание ![]() с температурой, определяя значение энтропии фаз
с температурой, определяя значение энтропии фаз
![]() и
и ![]() .
.
Выводы
Фазовые диаграммы состояний являются неотъемлемой частью обсуждения свойств материалов, когда речь идет о взаимодействии различных материалов.
Однофазовые диаграммы состояний изображают фазовое состояние только одного материала.
Двойная фазовая диаграмма (диаграмма состояния двойной системы) представляет состояние системы с двумя компонентами.
Комбинации элементов, образующих химические соединения, имеют более сложные диаграммы состояний.
Литература
1. Ормонт Б. Ф. Введение в физическую химию и кристаллохимию полупроводников. – М.: Высшая школа, 1973.
2. Физическое металловедение / Под редакцией Кана Р., вып. 2. Фазовые превращения. Металлография. – М.: Мир, 1968.
3. Ю.М. Таиров, В.Ф. Цветков «Технология полупроводниковых и диэлектрических материалов», - М.: Высшая школа, 1990р.
4. «Практикум по полупроводникам и полупроводниковим приборам», /Под ред. Шалимовой К.В. – М.: Высшая школа, 1968р.
Похожие работы
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
... переломов ослабленных костей / Тр. конгресса Человек и его здоровье. СПб, 1999 - с. 55. 44. Воложин А.И., Курдюмов С.Г., Орловский В.П., Баринов С.М. и др. Создание нового поколения биосовместимых материалов на основе фосфатов кальция для широкого применения в медицинской практике // Технологии живых систем. 2004. Т.1, №.1. С. 41-56. 45. Безруков В.М., Григорян А.С. Гидроксилапатит как ...
... (в первую очередь излучателя) и волокна. Оптимизация ввода излучения в волокно (рис. 10) может дать выигрыш по мощности до 10 дБ. Объединение элементов в систему. Волоконно-оптическая связь с момента своего появления основывается на принципах передачи цифровой информации. Это обусловлено тремя основными причинами. Во-первых, появление ВОЛС совпало со временем,, когда преимущества цифровых ...
... рисунков в формате А0-А1 со скоростью 10-30 мм/с. Фотонаборный аппарат Фотонаборный аппарат можно увидеть только в солидной полиграфической фирме. Он отличается своим высоким разрешением. Для обработки информации фотонаборный аппарат оборудуется процессором растрового изображения RIP, который функционирует как интерпретатор PostScript в растровое изображение. В отличие от лазерного принтера в ...





0 комментариев