Навигация
Аффинность антител и кинетика реакций
Контрольная работа
по биологии
2009
Содержание
1. Методы определения аффинности антител................................................ 3
2. Способы расчета констант комплексообразования реакции антиген—антитело 7
3. Кинетические закономерности реакции взаимодействия антиген—антитело 15
1. Методы определения аффинности антител
Определение аффинности антител в сыворотке или выделенных в очищенном виде представляет собой сложную экспериментальную и теоретическую задачу. Трудности обусловлены следующими обстоятельствами.
Во-первых, гетерогенностью антител по физико-химическим свойствам, в том числе по сродству к антигену. Во-вторых, сложностью определения общего количества антител, а также отдельных фракций. В-третьих, в случае поливалентных антигенов возможностью образования комплексов сложного состава, в том числе циклической структуры, в которых проявляется кооперативность взаимодействия активных центров антител. Все это не позволяет применить традиционные методы для расчета истинных значений констант связывания. Более надежные данные могут быть получены для моноклональных антител и их Fab-фрагментов, так как в этом случае могут быть выделены индивидуальные антитела в гомогенном виде.
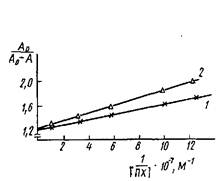
Истинные значения констант связывания важны для определения термодинамических характеристик процесса взаимодействия · антиген — антитело. Для практических целей, в частности для разработки методов иммуноферментного анализа, достаточно знать эффективные значения, характеризующие свойства используемых антител.
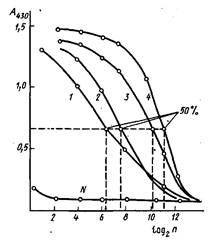
Рассмотрим принципиальные подходы к определению констант равновесия. Из уравнения следует, что для расчетов необходимо знать концентрации свободного и связанного с антителами антигена в условиях равновесия. Обычно для этого используют антигены, меченные маркером, который с высокой чувствительностью может быть определен одним из доступных физико-химических методов.
Все методы, позволяющие определять концентрации свободного и связанного антигена, можно условно разбить на две большие группы. К первой относятся методы, в которых стадия разделения свободного и связанного антигена осуществляется путем избирательного осаждения, аффинного связывания или гельфильтрации. Если реагенты достаточно сильно различаются своими молекулярными массами и размерами, то процедура разделения существенно упрощается. В случае корпускулярных антигенов оставшиеся несвязанные антитела могут быть отделены либо центрифугированием, либо пропусканием смеси через фильтр, задерживающий антиген. Для низкомолекулярных антигенов используется равновесный диализ.
Вторая группа включает методы, базирующиеся на изменении физико-химических свойств антигенов при комплексообразовании с антителами: тушении или усилении флуоресценции, изменении степени поляризации флуоресценции, ингибировании ферментативной активности.
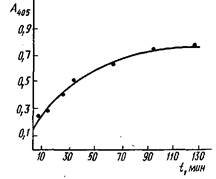
Равновесный диализ — наиболее распространенный метод изучения реакции антиген — антитело. Метод основан на различной способности антител и гаптена проходить через полупроницаемые мембраны. Раствор каждого реагента известной концентрации в одном и том же растворителе с одинаковой ионной силой и значением рН помещают по разные стороны мембраны. Молекулы гаптена диффундируют в раствор антител и связываются с ними. При достижении равновесия концентрация свободного гаптена выравнивается по обе стороны мембраны. Измерив равновесную концентрацию гаптена, можно рассчитать количество гаптена, связанного с антителами, и определить по уравнению константу связывания.
Как правило, метод равновесного диализа применяется для низкомолекулярных соединений с Afr<3000. Это обстоятельство существенно ограничивает область использования метода. К недостаткам метода надо также отнести относительно большое время достижения равновесия и необходимость учета эффектов, вызываемых присутствием мембраны, в результате чего необходимо работать с достаточно высокими концентрациями реагентов, что значительно понижает чувствительность определения константы связывания.
Методы фракционного осаждения используются для разделения комплексов антиген — антитело и несвязавшегося антигена. Они основаны на способности высокомолекулярных комплексов антиген—антитело избирательно осаждаться различными реагентами. При установлении в системе равновесия осаждающий реагент добавляют в такой концентрации^ при которой комплекс антиген—антитело и несвязавшиеся антитела становятся нерастворимыми и выпадают в осадок, который легко может быть удален центрифугированием.
Методы, не включающие фазовое разделение вступившего и не вступившего в реакцию антигена, относятся к группе гомогенных методов.
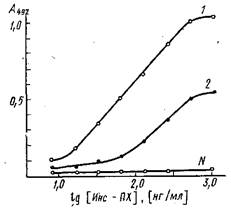
Флуоресцентные методы основаны на способности остатков триптофана в молекулах белков флуоресцировать при возбуждении УФ светом. Взаимодействие ряда антигенов с антителами приводит к изменению интенсивности флуоресценции, что может быть использовано для оценки количества антигена, вступившего в реакцию с антителами. В зависимости от химической структуры антигена может наблюдаться как усиление, так и гашение флуоресценции. Степень гашения интенсивности свечения зависит от концентрации активных центров антител, константы их ассоциации с антигеном и пропорциональна концентрации образовавшихся специфических комплексов. Методы флуоресценции просты, не занимают много времени и имеют высокую чувствительность, что сокращает расход реагентов.
Таблица 1. Методы определения аффинности антител
| Методы | Используемые антигены |
| Равновесный диализ Осаждение глобулиновой фракции сульфатом аммония Осаждение углем, модифицированным декстраном Осаждение антиглобулинами Гельфильтрация, разделение по молекулярной массе Тушение флуоресценции Усиление флуоресценции Поляризация флуоресценции Спектральные методы Тушение биолюминесценции | Гаптены, диализуемые антигены Гаптены, антигены, растворимые при 50%-ном насыщении сульфатом аммония Гаптены Гаптеиы, белки, полисахариды Гаптены, белковые полисахариды Гаптены и антигены со специфическими флуоресцентными свойствами Гаптеиы, белки Гаптены, белки Гаптены, связанные с красителем Гаптены, белки |
Метод деполяризации флуоресценции основан на измерении поляризации флуоресценции антигена, меченного красителем, до взаимодействия с антителами и после комплексообразования. Поляризация флуоресценции определяется молекулярным объемом частицы и степенью ее асимметрии. Комплексообразование антигена с антителом сопровождается резким изменением поляризации флуоресценции красителя, который играт роль метки антигена или антитела. Предел обнаружения антигена этими методами достаточно мал. Недостатками методов, основанных на измерении флуоресценции, являются необходимость работы с препаратами очищенных антител и строгие требования к структуре изучаемых антигенов. Вследствие этого флуоресцентные методы не являются универсальными и могут быть применены для ограниченной группы антигенов.
Методы тушения биолюминесценции основаны на использовании в качестве маркера АТР, пришитой к' молекуле антигена. В составе такого комплекса молекула АТР сохраняет активность в реакции биолюминесценции, катализируемой светлячковой люциферазой. При добавлении антител образуется комплекс с антигеном, в котором молекула АТР становится недоступной ферменту, в результате чего ингибируется реакция биолюминесценции. Указанный метод обладает высокой чувствительностью, что позволяет измерять константы ассоциации до 10-12 М.
Перечень экспериментальных методов определения аффинности взаимодействия антиген — антитело приведен в табл. 1.
Похожие работы
... мкг инсулина в 0,7 мл физиологического раствора. Отбор крови проводят через 7-9 дней из сердца. Второй цикл иммунизации осуществляется после месячного отдыха животных по схемам 45, 46 и 47 дней. Для получения антисывороток с титром, удовлетворительным для проведения ИФА, часто требуется 4-5-кратное повторение циклов иммунизации. Отбор крови каждый раз проводится на 7 - 9-й день после последней ...
... они прямо индуцируют В клетки). Развитие ответа на другие формы вирусного гликопротеина оболочки (VSV-G), такие как очищенный рекомбинантный белок VSV-G (мономер антигена) и рекомбинантный вирус оспы, (который включает VSV-G в виде подвижного, связанного с клеткой антигена, прикрепленного к полужидкой мембране), зависит от различных форм Т клеточной помощи при постепенном ее уменьшении (40-45). ...
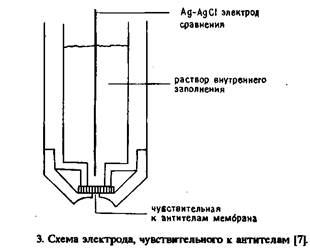
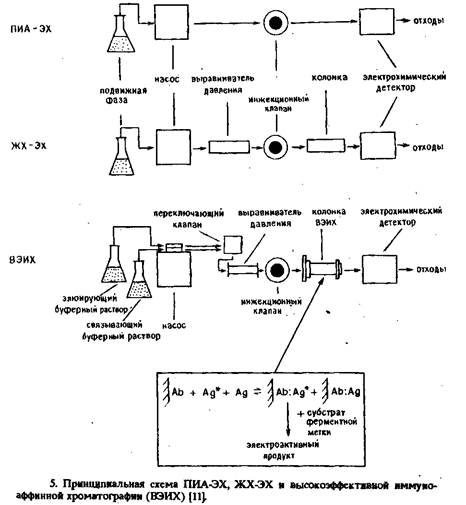
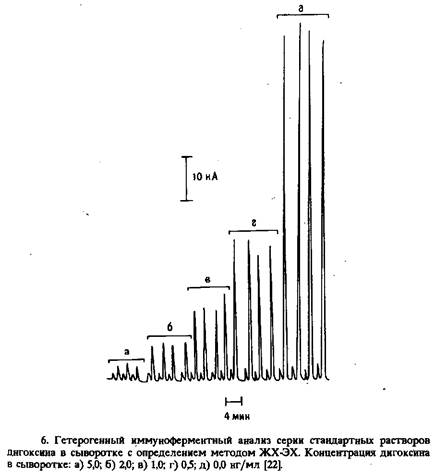
... электрода, обусловленное адсорбцией белков, и перекрестные реакции антител практически не влияют на результат анализа. Неферментативные электроактивные метки. Многообещающим направлением в амперометрическом иммуноанализе представляется применение металлсодержащих соединений. К таким меткам предъявляются следующие требования: 1) хорошие электрохимические свойства, 2) нечувствительность к рН в ...
... на основе электрофоретической мобильности и высокая специфичность иммунных антисывороток. Лекция 16. Принцип иммунного электрофореза. Иммунофиксация Электрофорез с иммунофиксацией (JFE) - это двухступенчатый процесс, использующий электрофорез протеинов на первом этапе и иммунопреципитацию на втором. При этом исследованию может быть подвергнута сыворотка крови, моча, спинномозговая или ...



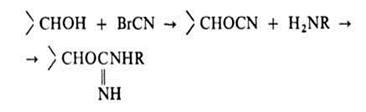
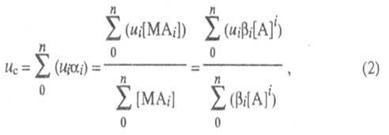
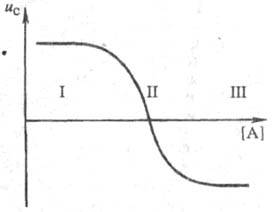
0 комментариев