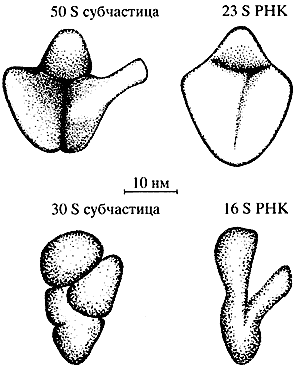
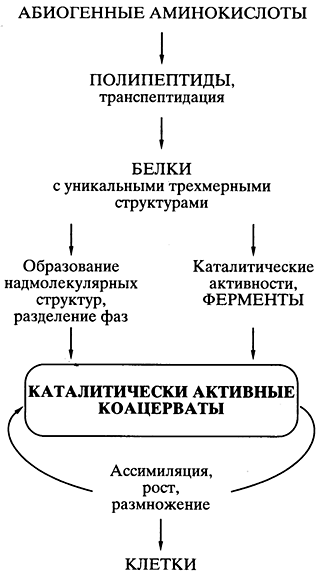
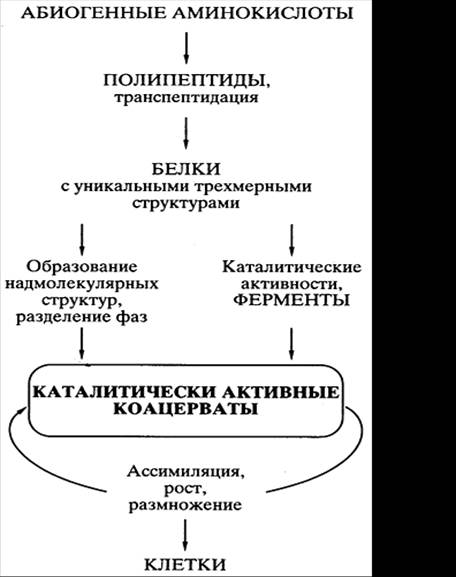
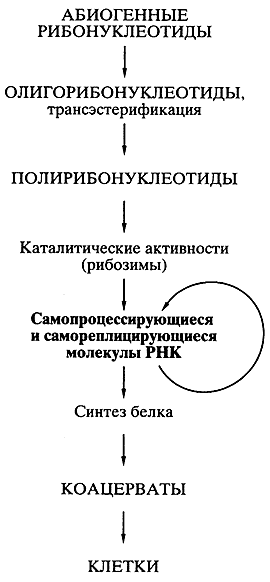
Навигация
Образование AMP и GMP из IMP
2. Образование AMP и GMP из IMP
Как показано на рис. 3 адениновые (реакции 12 и 13) и гуаниновые нуклеотиды (реакции 14 и 15) образуются путем аминирования и соответственно окисления и аминирования общего предшественника—инозинмонофосфата (IMP). Аминирование IMP протекает через стадию образования промежуточного соединения, в котором аспартат присоединяется к инозиновой кислоте, образуя аденилосукцинат. Эта реакция напоминает реакцию 8 биосинтеза пуринов (рис. 2), в которой а-азот аспарагиновой кислоты поставляет атом N-1 пуринового кольца. Образование аденилосукцината катализируется аденилосукцинатсинтазой и происходит при участии GTP. Удаление остающейся части аспарагиновой кислоты в виде фумарата приводит к образованию адениловой кислоты (аденозинмонофосфат; AMP). Отщепление фумарата от аденилосукцината катализируется ферментом аденилосукциназой. Этот же фермент катализирует отщепление фумарата от аминоимидазолсукцинилкарбоксамидрибозил-фосфата (реакция 9).
Так же, в две стадии, из IMP образуется гуанозинмонофосфат (GMP). В первой реакции на этом пути (реакция 14) при участии NAD и Н2О происходит окисление IMP с образованием ксантинмонофосфата (ХМР). Затем ХМР аминируется амидогруппой глутамина (реакция 15). Для этого процесса необходим АТР, что в какой-то мере напоминает потребность в GTP при превращении IMP в AMP.
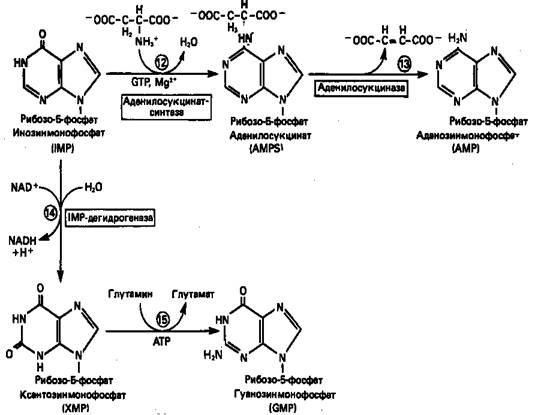
Рисунок 3. Превращение IMP в AMP и GMP
3. Ингибиторы биосинтеза пуринов
Несколько антиметаболитов — аналогов глутамина оказывают сильное ингибирующее воздействие на биосинтез пуринов. Азасерин (О-диазо-ацетил-L-серин) выступает как антагонист глутамина, особенно в реакции 5. Диазонорлейцин ([6-диазо-5-оксо]-L-норлейцин) блокирует реакцию 2, а 6-меркаптопурин наряду с другими эффектами ингибирует реакции 13 и 14 синтеза AMP и GMP соответственно. Микофеноловая кислота подавляет реакцию 14.
Превращение AMP и GMP в соответствующие ди- и трифосфаты осуществляется в две стадии (рис. 4). Реакции фосфорилирования — переноса фосфатных групп от АТР—осуществляются нуклео-зидмонофосфаткиназой и нуклеозиддифосфаткиназой.
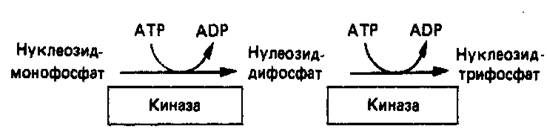
Рисунок 4. Реакции фосфорилирования нуклеозидмонофосфата и нуклеозиддифосфата.
4. Синтез пуриновых дезоксирибонуклеотидов
Синтез пуриновых и пиримидиновых дезоксирибонуклеотидов происходит путем прямого восстановления 2'-углерода рибозного остатка соответствующего рибонуклеотида, а не путем синтеза de novo из 2'-дезоксианалога ФРПФ. Восстановление 2'-углеродного атома рибозы происходит только после превращения пуриновых и пиримидиновых нуклео-тидов в соответствующие нуклеозиддифосфаты. У некоторых бактерий в этом восстановительном процессе участвует кобаламин (витамин В12). У животных процесс восстановления идет и в отсутствие витамина В12. Восстановление рибонуклеозиддифосфатов в дезоксирибонуклеозид-дифосфаты катализируется рибонуклеотидредуктазой и требует участия тиоредоксина (белковый кофактор), тиоредоксинредуктазы (флавопротеиновый фермент) и NADPH (кофактор). Непосредственным донором электронов для нуклеотида является тиоредоксин, который предварительно восстанавливается NADPH. Обратимое окислительно-восстановительное превращение тиоредоксина катализируется тиоредоксинредуктазой. Восстановление рибонуклеозиддифосфата восстановленным тиоредоксином катализируется рибонуклеозидредуктазой (рис. 5). Эта сложная ферментная система функционирует в клетках только в период активного синтеза ДНК и деления.
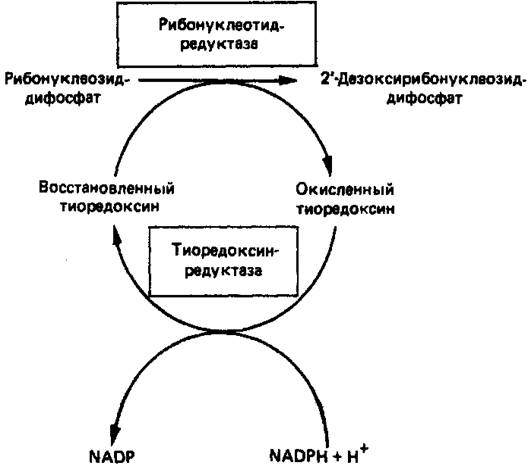
Рисунок 5. Восстановление рибонуклеозиддифосфата до 2-дезокси-рибонуклеозиддифосфата.
5. Тканевая специфичность биосинтеза пуринов
Не во всех тканях человека происходит синтез пуриновых нуклеотидов de novo. Эритроциты и полиморфноядерные лейкоциты не способны синтезировать 5-фосфорибозиламин, и поэтому для образования пуриновых нуклеотидов им необходимы экзогенные пурины. Периферические лимфоциты способны синтезировать небольшие количества пуринов de novo. Установлено, что в клетках мозга млекопитающих содержатся очень малые количества ФРПФ-амидотрансферазы, на этом основании был сделан вывод о зависимости синтеза пуриновых нуклеотидов в мозге от поступления экзогенных пуринов. Оказалось, что основным местом синтеза пуриновых нуклеотидов в организме млекопитающих является печень. Из нее свободные основания или нуклеозиды попадают в другие ткани, не способные к синтезу пуринов de novo.
6. Регуляция биосинтеза пуринов
На синтез молекулы IMP затрачивается энергия гидролиза шести макроэргических фосфодиэфирных связей АТР, при этом в качестве предшественников выступают глицин, глутамин, метенилтетрагидрофолат и аспартат. Для экономии энергетических и питательных ресурсов важна эффективная регуляция процесса биосинтеза пуринов de novo. Важнейшую роль в этом процессе играет внутриклеточная концентрация ФРПФ. Она определяется соотношением скоростей его синтеза, утилизации и деградации. Скорость синтеза ФРПФ зависит от 1) наличия субстратов синтеза, особенно рибозо-5-фосфата, и 2) каталитической активности ФРПФ-синтазы, которая в свою очередь связана с внутриклеточной концентрацией фосфатов, а также с концентрацией пуриновых и пиримидиновых рибонуклеотидов, выступающих в роли аллостерических регуляторов (рис. 6). Скорость утилизации ФРПФ в значительной степени зависит от интенсивности цикла реутилизации пуриновых оснований, в ходе которого ксантин и гуанин фосфорибозилируются до соответствующих рибонуклеотидов. В меньшей степени скорость утилизации ФРПФ зависит от интенсивности синтеза пуринов de novo. Этот вывод основан на следующем наблюдении: в эритроцитах и культивируемых фибробластах мужчин с наследственным нарушением активности гипоксантин-гуанин—фосфо-рибозилтрансферазы уровень ФРПФ повышается в несколько раз.
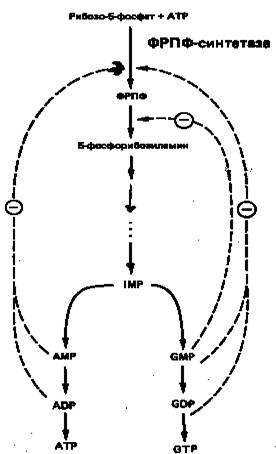
Рисунок 6. Регуляция скорости синтеза пуринов de novo. Сплошные линии указывают путь химических превращений. Пунктирные линии обозначают ингибирование конечными продуктами по принципу обратной связи.
Показано, что ФРПФ-амидотрансфераза – первый из ферментов, участвующих в процессе синтеза пуриновых нуклеотидов de novo, ингибируется in vitro пуриновыми нуклеотидами (особенно аденозинмонофосфатом и гуанозинмонофосфатом) по принципу обратной связи. Эти ингибиторы конкурируют с субстратом — ФРПФ, последний, как выяснилось, занимает центральное место в регуляции синтеза пуринов de novo. Многие косвенные данные свидетельствуют о том, что роль амидотрансферазы в этом процессе менее существенна, чем ФРПФ-синтетазы.
Образование GMP или AMP из IMP регулируется двумя механизмами (рис. 7).
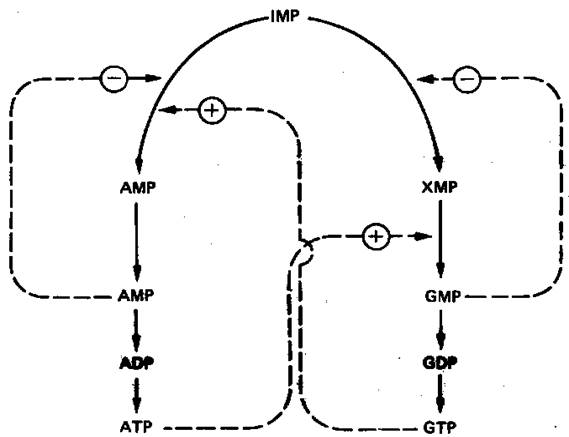 Рисунок 7. Регуляция превращений IMP в аденозиновые и гуанозиновые нуклеотиды. Сплошные линии указывают путь химических превращений. Пунктирные линии обозначают положительную и отрицательную регуляцию по принципу обратной связи.
Рисунок 7. Регуляция превращений IMP в аденозиновые и гуанозиновые нуклеотиды. Сплошные линии указывают путь химических превращений. Пунктирные линии обозначают положительную и отрицательную регуляцию по принципу обратной связи.
AMP регулирует активность аденилосукцинатсинтетазы, влияя по принципу обратной связи на собственный синтез. GMP регулирует собственный синтез, действуя по тому же принципу на 1МР-дегидрогеназу. Наряду с этим образование аденилосукцината из IMP на пути к AMP стимулируется GTP. Образование же GMP из ксантозинмонофосфата требует присутствия АТР. Таким образом, наблюдается существенная перекрестная регуляция дивергентных путей метаболизма IMP. Такая регуляция тормозит биосинтез одного из пуриновых нуклеотидов при недостатке другого. Гипоксантингуанин-фосфорибозилтрансфераза, катализирующая образо-вание из ксантина и гуанина IMP и GMP соответственно, весьма чувствительна к ингибирующему действию этих нуклеотидов.
Восстановление рибонуклеозиддифосфатов до дезоксирибонуклеозид-дифосфатов является объектом сложной регуляции. Этот процесс (рис. 8) обеспечивает сбалансированное образование дезоксирибонуклеотидов для синтеза ДНК.
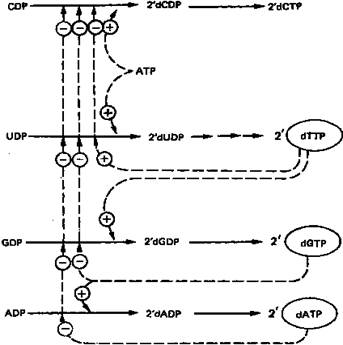
Рисунок 8. Регуляция восстановления пуриновых и пиримидиновых рибонуклеотидов до соответствующих 2'-дезоксирибонуклеотидов. Сплошные линии указывают путь химических превращений. Пунктирные линии обозначают положительную и отрицательную регуляцию по принципу обратной связи.
Похожие работы
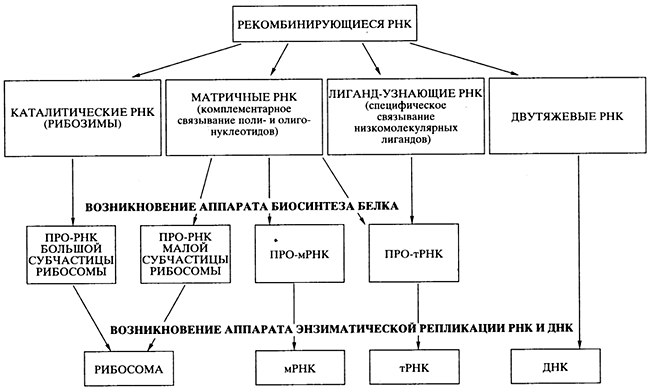
... функции в трансляции. Специальная малая РНК входит в состав важнейшего фермента, ответственного за поддержание редупликации ДНК в поколениях клеток - теломеразы. Следует сказать, что их молекулярные размеры сопоставимы с размерами клеточных глобулярных белков. Таким образом, постепенно становится ясно, что функционирование живой клетки определяется не только многообразием синтезируемых в ней ...
... , образуя вначале нуклеосому, а после гетерохроматин, из которого состоят хромосомы; ü передача наследственного материала происходит путем репликации ДНК; ü реализация наследственной информации в процессе синтеза белка. 5. РНК 5.1. Состав РНК Первые сведения о нуклеотидном составе РНК относились к препаратам, представляющим собой смеси ...
... формами географической (территориально-механической) изоляции, известны и разные формы биологической изоляции, которые могут быть разбиты на три основные группы: эколого-этологическую, морфо-физиологическую и собственно генетическую. Биологическая изоляция приводит к уменьшению вероятности встречи особей разных полов в период размножения, снижению полового влечения и эффективности спаривания, к ...
... Во-вторых, в настоящее время известно достаточное количество соединений, нерастворимых в неполярных растворителях или же, наоборот, хорошо растворимых в воде, которые, тем не менее, относят к липидам. В современной органической химии определение термина «липиды» основано на биосинтетическом родстве данных соединений — к липидам относят жирные кислоты и их производные [1]. В то же время в биохимии ...

0 комментариев