Навигация
Органическая химия
Контрольная работа №1
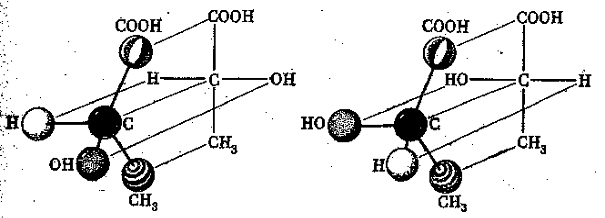
1 Приведите проекционные формулы оптических изомеров соединений
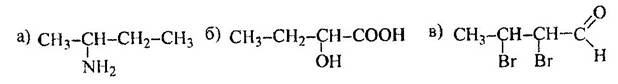
Определите, число изомеров и укажите, какие из них являются энантиомерами, а какие – диастереомерами.
Решение
а). Число изомеров – 2, оба изомера являются по отношению друг к другу энантиомерами.
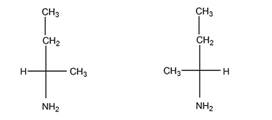
б). Число изомеров – 2, оба - энантиомеры
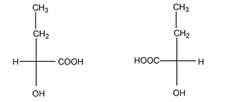
в). Число изомеров – 4.
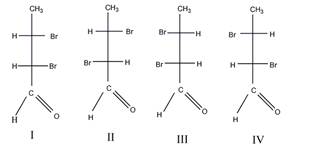
Пары энантиомеров: I и III, II и IV; пары диастереомеров: I и II, III и IV.
2 Приведите механизм реакции радикального замещения (SR) на примере бромирования 2-метилпропана и циклогексана. Объясните устойчивость третичного радикала по сравнению с вторичным и первичным
Решение
Механизм бромирования 2-метилпропана
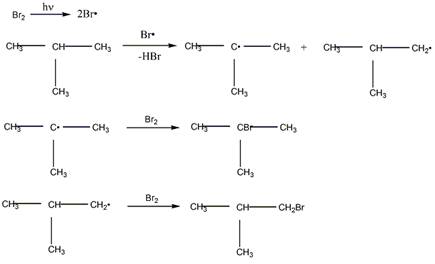
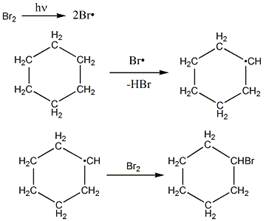
Механизм бромирования циклогексанаость свободных радикалов определяется энергией их образования из алканов. Энергия, необходимая для образования различных типов радикалов, уменьшается в следующем порядке: СН3 > первичный > вторичный > третичный. Если для образования одного радикала требуется меньше энергии, чем для образования другого, то это может означать только то, что в сравнении с образующимся алканом один радикал содержит меньше энергии и более устойчив, чем другой (см. рисунок ниже):
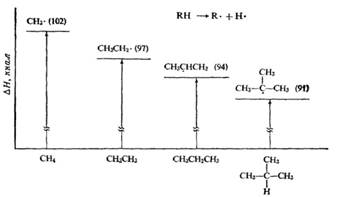
Абсолютное содержание энергии, например, метильного и этильного радикалов не сравнивается; просто говорят, что различие в энергиях между метаном и метильным радикалом больше, чем между этаном и этильным радикалом.
3 Дайте определение понятию «кислотности» органических соединений по Бренстеду-Лоури и расположите в ряд по возрастанию кислотных свойств следующие соединения: фенол, пропантиол-1, пропиловый спирт, пропановая кислота, пропан, пропанамин-1.
Укажите вид и знак электронных эффектов заместителей. Обоснуйте кислотные свойства указанных веществ, исходя из стабильности соответствующих анионов
Решение
По теории Брёнстеда (протолитической теории) кислотность и основность соединений связывается с переносом протона Н. Кислота <-> Н + Основание. Кислота и основание образуют сопряженную кислотно-основную пару, в которой чем сильнее кислота, тем слабее сопряженное ей основание, и напротив, чем сильнее основание, тем слабее сопряженная ему кислота. Например, хлороводородная кислота сильнее, чем уксусная кислота и соответственно ацетат-ион будет более сильным основанием, чем хлорид-ион. Кислоты Брёнстеда (протонные кислоты) нейтральные молекулы или ионы, способные отдавать протон (доноры протонов). Основания Брёнстеда — нейтральные молекулы или ноны, способные присоединить протон (акцепторы протонов). Кислотность и основность являются не абсолютными, а относительными свойствами соединений: кислотные свойства обнаруживаются лишь в присутствии основания; основные свойства только в присутствии кислоты.
Большинство органических соединений можно рассматривать как кислоты, поскольку в них содержатся поляризованные связи атома водорода с различными элементами (О, N, S, С). Органические кислоты классифицируют по природе кислотного центра:
ОН-кислоты: спирты, фенолы, карбоновые кислоты, сульфокислоты, гидроксикислоты, аминокислоты;
· SH-кислоты: тиоспирты, SH-содержащие аминокислоты и др. соединения;
· NH-кислоты: амины, имины, гетероциклические соединения с атомом азота;
· СН-кислоты: углеводороды, радикалы гетерофункциональных соединений.
Для количественной характеристики кислотных свойств используется величина
pKa = - lg Ka,
где Ка – константа кислотности. Чем меньше рКа, тем больше кислотность по Бренстеду.
Качественной характеристикой кислотных свойств может служить стабильность образующегося аниона. Сила кислоты определяется стабильностью аниона, образующегося из этой кислоты: чем стабильнее анион, тем сильнее кислота. Стабильность аниона, в свою очередь, определяется характером распределения отрицательного заряда аниона и зависит от ряда факторов:
1) природы атома в кислотном центре (электроотрицательности и поляризуемости элемента);
2) характера связанного с кислотным центром органического радикала (электроноакцепторного или электронодонорного);
3) сольватационных эффектов.
Электроотрицательность имеет значение, когда сравнивается кислотность соединений, имеющих одинаковые радикалы и элементы кислотного центра, относящиеся к одному и тому же периоду периодической системы Д.И. Менделеева (т.е. когда практически не изменяется поляризуемость). Чем более электроотрицательным является элемент в кислотном центре, тем он более способен нести отрицательный заряд, и тем стабильнее образующийся анион, и соответственно, сильнее кислота.
| С—Н кислота | N—H кислота | О—Н кислота | S—H кислота | О—Н кислоты | |
| С2Н5СH2←Н пропан |
С3Н7N←H пропанамин | С3Н7О←Н Пропиловый спирт | С2Н5S←H Пропантиол-1 | С6Н5О←Н фенол | С2Н5СОО←Н уксусная кислота |
| рКа =50 | рКа ≈ 30 | рКа ≈ 18 | рКа ≈ 12 | рКа = 10 | рКа = 4,9 |
Кислотность соединений в ряду слева направо увеличивается.
У пропана, пропанамина и пропилового спирта кислотность, ввиду отсутствия электроноакцепторных групп у кислотообразующей частицы обеспечивается исключительно электроотрицательностью этой самой частицы.
В пределах группы таблицы элементов Менделеева стабильность анионов возрастает с увеличением атомного номера элемента, так как увеличивается объем электронных орбиталей, и создается лучшая возможность для делокализации отрицательного заряда. Поэтому пропантиол является более сильной кислотой, чем пропанол.

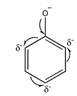
Фенильная группа (бензольное кольцо) обладает слабым отрицательным индуктивным эффектом и делокализует образовавшийся на атоме кислорода отрицательный заряд по всему бензольному кольцу:
Аналогично, для пропановой кислоты отрицательный заряд делокализуется по системе сопряженных связей:
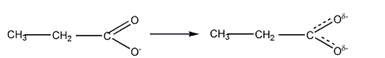
4 Объясните, как изменяется основность в указанном ряду соединений. Как практически можно подтвердить основность самого сильного основания этого ряда?
n-Хлоранилин, метиламин, метилпропиламин, п- нитроанилин, анилин, дифениламин
Решение
На основность аминов влияют различные факторы: электронные эффекты углеводородных радикалов, пространственное экранирование радикалами атома азота, а также способность образующихся ионов к стабилизации за счет сольватации в среде растворителя. В результате +I-эффекта алкильных групп основность алифатических аминов в газовой фазе (без растворителя) растет в ряду: первичные < вторичные < третичные. Однако в растворах оснoвные свойства третичных аминов проявляются слабее, чем у вторичных и даже первичных аминов, так как три радикала создают пространственные препятствия для сольватации образующихся аммониевых ионов. По этой же причине основность первичных и вторичных аминов снижается с увеличением размеров и разветвленности радикалов.
Основность ароматических аминов зависит также от характера заместителей в бензольном кольце. Электроноакцепторные заместители (-F, -Cl, -NO2 и т.п.), а также фенильная группа, уменьшают основные свойства ариламина по сравнению с анилином, а электронодонорные (алкил, -OCH3, -N(CH3)2 и др.), напротив, увеличивают.
Основность аминов (в растворе) возрастает в ряду:
дифениламин < анилин<п-хлоранилин <п-нитроанилин < метиламин < метилпропиламин
Водные растворы алифатических аминов проявляют щелочную реакцию, т.к. при их взаимодействии с водой образуются гидроксиды алкиламмония, аналогичные гидроксиду аммония:
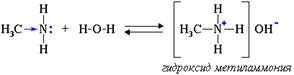
5 Установите строение углеводорода С5Н12, при монобромировании которого образуется третичный галогеноалкан. Искомый углеводород нельзя получить по реакции Вюрца без побочных продуктов. Запишите уравнения реакций получения этого углеводорода гидрированием алкена и щелочной плавкой соли карбоновой кислоты
Решение
Строение искомого углеводорода представлено ниже
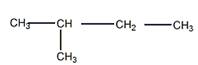
Гидрирование алкена
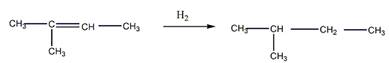
Щелочная плавка соли карбоновой кислоты
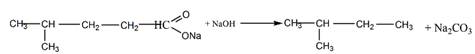
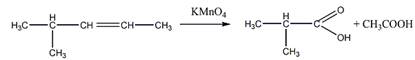
6 Углеводород С6Н]2 присоединяет 1 моль Вг2, растворяется в холодной концентрированной серной кислоте, при гидрировании превращается в 2-метилпентан, а при окислении перманганатом калия в кислой среде при нагревании образует среди продуктов реакции уксусную кислоту. Предложите его структурную формулу. Напишите уравнения перечисленных реакций
Решение
Строение углеводорода
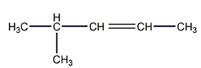
Присоединение брома
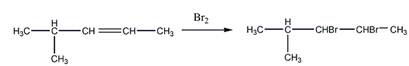
Растворение в холодной концентрированной серной кислоте
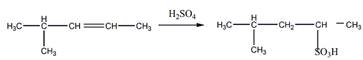
Гидрирование
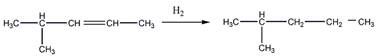
Окисление перманганатом калия
7 Установите строение углеводорода С6Н10, если известно, что он обесцвечивает бромную воду, образует красный осадок с аммиачным раствором оксида меди (I), а в результате присоединения воды в присутствии сульфата ртути превращается в изобутилметилкетон
Решение
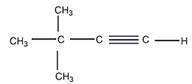
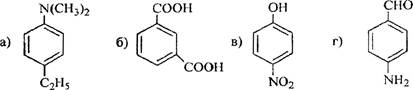
8 Определите, какие продукты будут преимущественно образовываться при бромировании (в присутствии катализатора FeBr3) следующих соединений
Решение
а). 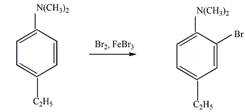
б). 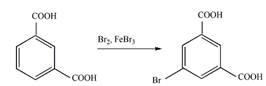
в). 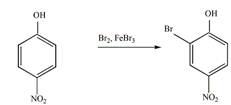
г).
9 Определите структурную формулу углеводорода состава С9Н10, который: а) обесцвечивает реактив Вагнера; б) вступает в реакцию полимеризации; в) существует в виде цис-транс-изомеров; г) при окислении даёт бензойную кислоту
Решение
Структурная формула углеводорода (бета-метилстирол)
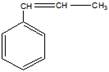
а). обесцвечивание реактива Вагнера
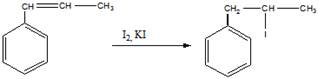
б). полимеризация бета-метилстирола (с добавлением перекиси бензоила в качестве инициатора)
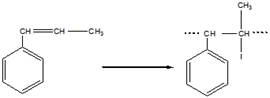
в). Цис-транс-изомерия
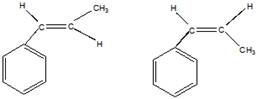
транс-изомер цис-изомер
г). окисление
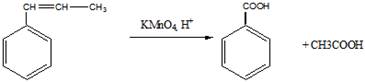
10 Установите структурную формулу соединения С5Н11Вг, легко вступающего в реакцию гидролиза, протекающую по механизму SN
Похожие работы
... -либо внешнего воздействия, и, наоборот, иногда требуются интенсивные внешние воздействия (катализаторы) для того, чтобы вызвать обратимые переходы изомеров друг в друга. Распространенное в органической химии явление, заключающееся в существовании двух или нескольких изомерных форм молекул, находящихся в состоянии динамического равновесия, называется таутомерией. В настоящее время установлено, ...
... деятельность. Поиск методов и форм обучения, способствующих воспитанию творческой личности, привел к появлению некоторых специфических способов обучения, одним из которых являются игровые методы. Реализация игровых методов обучения при изучении химии в условиях соблюдения дидактических и психолого-педагогических особенностей, повышает уровень подготовки учащихся. Слово «игра» в русском языке ...
... на новые программы и учебники этот вопрос становится наиболее острым. Наша школа перешла на новое учебники О.С. Габриеляна и новую программу, как и большинство школ Заволжского района, поэтому мы представляем календарно-тематическое планирование к курсу "Органическая химия" 10 класс. Тематическое планирование составлено согласно программе разработанной Департамента образовательных программ и ...
... . Работа предназначена учителям химии, а также может быть полезна студентам педагогических вузов и колледжей. 2.2.ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Необходимость разработки элективного курса для учащихся 10-х классов «Решение задач по органической химии повышенного уровня сложности» обусловлена несколькими причинами. В соответствии с базисным учебным планом полной средней школы на изучение химии за 2 ...
0 комментариев