Навигация
Комплексонометрическое определение железа в почвах
2.2 Комплексонометрическое определение железа в почвах
Определение общего содержания железа в почвах комплексонометрическим методом проводят титруя ионы трехвалентного железа. Комплексонат трехвалентного железа более устойчив, чем железа двухвалентного. Поэтому перед титрованием Fe(II) окисляют азотной кислотой при нагревании.
В связи с тем что Fe(III) легко гидролизуется, его комплексонометрическое титрование можно проводить лишь в сильно-кислой среде. Трехвалентное железо может быть оттитровано даже при рН 1, константа устойчивости комплексоната трехвалентного железа в этом случае равна 107'1 (1gКэффуст = 25,1 — 18,0). При титровании в сильнокислой среде устраняется мешающее влияние многих сопутствующих элементов, которые в этих условиях либо вовсе не образуют комплексонатов (Ва, Mg, Ca), либо комплексонаты образуются, но они малоустойчивы (Си и др.). Относительно устойчивые комплексонаты в сильно кислой среде образуют Bi3+, V3+, но их содержание в почвах невелико и влиянием этих элементов на результаты определения железа в почвах пренебрегают. Титан при высоких содержаниях в почвах может влиять на результаты определения валового содержания железа.[3]
В связи с тем что железо медленно реагирует с комплексном III, титруют подогретые растворы. В качестве индикатора используют сульфосалициловую кислоту. Интервал рН, в котором развивается красно-фиолетовая окраска сульфосалицилатного комплекса железа, не велик. Поэтому нужно очень строго соблюдать предписанные методикой условия проведения анализа. В противном случае окрашенное соединение может не образоваться. Часто раствор не приобретает красно-фиолетовой окраски в связи с тем, что имеет более кислую, чем необходимо, реакцию. В этом случае в анализируемую систему нужно добавить раствор аммиака, а не сульфосалициловой кислоты.
В конечной точке титрования сульфосалицилат железа разрушается вследствие образования более устойчивого комплексоната железа и лиловая окраска исчезает, переходя в лимонно- желтую, обусловленную комплексонатом железа. Как уже отмечалось, молярный коэффициент поглощения сульфосалицилата железа невелик, поэтому переход окраски при комплексонометрическом титровании железа нерезкий.
2.2.1 Методика комплексонометрического определения валового содержания железа в почвах
Прежде чем проводить анализ на конических колбах вместимостью 250 мл, делают отметку на уровне, соответствующем объему 50 мл. В колбу помещают 25 мл фильтрата, полученного после отделения кремниевой кислоты, добавляют 5—7 капель концентрированной HN03 и нагревают до кипения окисляя Fe(II).
Затем в колбу добавляют 10—15 капель 25%-ного раствора аммиака, помещают кусочек индикаторной бумаги конго-рот и добавляют по каплям сначала 25%-ный раствор аммиака, а затем 10%-ный до перехода синей окраски индикаторной бумаги в бурую. Если при этом выпадет осадок, его растворяют несколькими каплями 1 н. НСl. В колбу приливают 5 мл 1 н. НСl, и объем жидкости дистиллированной водой доводят до отметки, соответствующей 50 мл. Содержимое колбы нагревают до 50-60°, добавляют 1-3 капли 10%-ного раствора сульфосалициловой кислоты и титруют 0,01 М раствором комплексона III до перехода лиловой окраски сульфосалицилата железа в бледно-желтую комплексоната железа. Скорость реакции невелика, поэтому последние порции титранта добавляют медленно
Реагенты:
1. 0,01 Мраствор комплексона III. См. раздел 5.6.2.1.
2. 25%-ный раствор аммиака.
3. 1 н. раствор НС1. 8,2 мл конц. НС1 разбавляют водой до 1 л.
4. 10%-ный раствор сульфосалициловой кислоты.
2.3 Фотометрические методы определения железа
В связи с тем что и Fe2+ и Fe3+ обладают хромофорными свойствами (электронная конфигурация атома железа — 1s2 2s2 2р6 3s2 Зр6 3d6 4s2), для фотометрического определения железа используют различные типы химических реакций, которые приводят к образованию окрашенных соединений.
Для определения общего содержания железа в почвах разработаны фотометрические методы, основанные на образовании окрашенных соединений как двух-, так и трехвалентного железа. В России наиболее широко используют фотометрический сульфосалицилатный метод определения Fe(III).
Сульфосалициловая кислота в зависимости от рН раствора образует с Fe(III) три различно окрашенных комплекса. При рН 2-3 образуется красно-фиолетовый комплекс [FeSsal]+, при рН 4-8 коричневато-оранжевый комплекс [Fe(Ssal)2]- и при рН 8—10 в аммиачном растворе образуется устойчивый желтый комплекс [Fe(Ssal)3]3-.
Красно-фиолетовый комплекс, образующийся в кислой среде, может быть использован для селективного определения Fe(III) в присутствии Fe(II); вариант метода малочувствительный, молярный коэффициент поглощения при длине волны 490 нм равен 2,6-103. Этот комплекс используют при комплексонометрическом определении железа в почвах, предварительно переведя Fe(II) в Fe(III).
Для фотометрического определения валового содержания железа в почвах используют комплекс желтого цвета, устойчивый в щелочной среде. Этот вариант метода позволяет определить общее содержание железа в почвах, так как в условиях эксперимента Fe(II) легко окисляется до Fe(III). Максимум светопоглощения находится в области длин волн 420-430 нм, молярный коэффициент поглощения равен 5,8-103. Кривые светопоглощения сульфосалицилатных комплексов железа приведены на рис. 1.
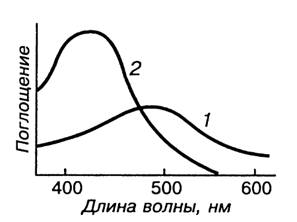
Рисунок 1. Кривые свстопоглощения сульфосалицилатных комплексов железа при рН 2 (1) и рН 9 (2) молярный коэффициент поглощения
Сульфосалициловая кислота образует устойчивые комплексные соединения со многими металлами. При проведении анализа добавляют избыток реагента, чтобы предотвратить осаждение алюминия, магния, кальция при подщелачивании раствора. Комплексы этих элементов с сульфосалициловой кислотой бесцветны. Окрашенные комплексы сульфосалициловая кислота образует с металлами, обладающими хромофорными свойствами.[3]
Для предотвращения выпадения в осадок гидроксида Mn(IV) при подщелачивании в раствор предварительно добавляют гидроксиламин.
Валовое содержание железа может быть определено по окрашенному комплексу двухвалентного железа с бртофенантролином (Methods of soil analysis, 1982). В этом случае железо восстанавливают гидроксиламином до двухвалентного состояния. Затем в раствор добавляют ортофенантролин, с которым Fe(II) образует устойчивый, имеющий красноватую окраску, комплекс — Fe(C12H10N2)2+3. Эта цветная реакция специфична для Fe2+. Присутствующие в почвах химические элементы, как правило, не влияют на результаты анализа.
Ортофенантролин может быть использован для раздельного определения Fe(II) и Fe(III). В этом случае анализируют две аликвоты исследуемого раствора. В одной из них определяют суммарное содержание Fe(II) и Fe(III) после предварительного восстановления трехвалентного железа, в другой — Fe(II). Определение Fe(II) рекомендуется проводить в темноте или при слабом красном свете, чтобы предотвратить фоторедукцию комплекса Fe(III) с ортофенантролином.
Окрашенный комплекс Fe(II) с ортофенантролином образуется сразу после добавления реагента и устойчив в течение нескольких суток. Окраска развивается в интервале значений рН от 2 до 9. Однако при проведении анализа почв оптическую плотность измеряют при рН 3—5, так как при высоком содержании кальция и фосфора в условиях меньшей кислотности может произойти образование труднорастворимого фосфата кальция.
Похожие работы
ления тяжелых металлов в природных водах Экстракционно-фотометрический метод определения хрома[16] На протекание естественных процессов в воде большое влияние оказывает содержание в ней тяжелых металлов. Были проведены исследования, целью которых являлась количественная оценка загрязнения реки Кальмиус тяжелыми металлами. Результаты данного исследования показали, что одним из тяжелых металлов ...
... алюминия. 6. ГОСТ Р 51211-98 Вода питьевая. Методы определения содержания ПАВ. 7. ГОСТ Р 51210-98 Вода питьевая. Метод определения содержания бора. 8. ПНД Ф 14.1:2:4.24-95 Методика выполнения измерений массовых концентраций алюминия в пробах природной, питьевой и сточной воды на анализаторе "ФЛЮОРАТ-02". 9. ПНД Ф 14.1:2:4.26-95 Методика выполнения измерений массовых концентраций нитрит ...
... воде, а зная концентрацию SH-групп в тканях рыб и их возраст можно оценить "интегральное биологическое воздействие" нефтяного загрязнения природных вод на гидробионты. Кинетический метод определения йода в пищевых продуктах и продовольственном сырье Среди каталитических методов получил применение рода-нидно-нитритный метод. Он основан на реакции окисления роданид-иона смесью нитрат- и нитрит- ...
... эквивалентности раствор обесцвечивается. Избыток [Hg2]2+-ионов реагирует с Fe(SCN)3 по уравнению: 3 [Hg2]2+ + 2 Fe(SCN)3 → 3Hg2(SCN)2 + 2Fe3+ 2.3 Инструментальные методы определения хлорид-ионов 2.3.1 Нефелометрическое определение хлоридов При прохождении пучка света через дисперсные системы наблюдается рассеяние или поглощение света твердыми частицами. Это явление положено в ...
0 комментариев