Навигация
Методы идентификации трансгенов
1.2 Методы идентификации трансгенов
Увеличение использования ГМО и их компонентов в производстве продуктов питания, сельскохозяйственных кормов и фармацевтических препаратов делает всё более актуальным вопрос разработки эффективных методов идентификации трансгенной ДНК. В настоящее время наиболее разработаны и широко применяются методы обнаружения фрагментов чужеродной ДНК, основанные на использовании различных видов ПЦР (полимеразная цепная реакция).
ПЦР – это метод, который позволяет проверить генетический материал, выделенный из исследуемого образца, на наличие в его составе участка чужеродной или измененной ДНК и используется для получения множества копий непротяженных участков ДНК, специфичных для каждого конкретного белка, а также исследуемого генетически обусловленного признака.
В основе метода ПЦР лежит способность хорошо известных в молекулярной биологии ферментов, ДНК-полимераз, осуществлять направленный синтез второй, т.е. комплементарной (спаренной) цепи ДНК, по имеющейся матрице одноцепочечной ДНК, наращивая небольшую олигонуклеотидную затравку (праймер), комплементарную участку этой матрицы, до размеров в несколько тысяч или даже десятков тысяч звеньев. Повышая температуру, можно добиться остановки реакции и последующей денатурации полученной ДНК, т.е. разделения цепей полученной в ходе реакции двуцепочечной ДНК. Если в реакционной смеси присутствует избыток праймера, то, значительно снизив температуру, чтобы праймер мог вновь связаться с тем же самым комплементарным участком ДНК, и добавив новую порцию фермента, можно вновь установить температуру, необходимую для реакции полимеризации, и, таким образом, проведя реакцию еще раз, увеличить количество ранее полученного продукта. Многократное, или как говорят, циклическое повторение этой процедуры позволяет наработать значительное количество копий участка ДНК, начинающегося с данного праймера. Один цикл ПЦР осуществляется за 1–2 мин, так что в течение нескольких часов можно получить 100 млрд. копий (рис. 2).
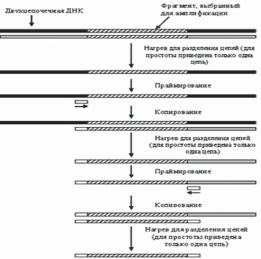
Рисунок 2. Метод ПЦР
Кроме описанного метода ПЦР, для выявления трансгенных фрагментов ДНК используется целый ряд других методов:
• Методы обнаружения ГМО, основанные на исследовании трансгенных белков. Процесс создания ГМ растений основан на введении в клетки организма-реципиента чужеродных генных конструкций, обеспечивающих синтез новых белков. Появляющиеся в растении в результате генетической модификации белки могут служить маркерами генетической модификации. К этой группе методов относят различные иммунологические методики, основанные на использовании антител (особые белки, вырабатываемые иммунной системой организма в ответ на проникновение чужеродных организмов или их фрагментов), специфичных к маркерным белкам, используемым при создании ГМО
• Хроматографические методы. Используются в том случае, когда генетическая модификация приводит к появлению и/или увеличению содержания специфических жирных кислот или триглицеридов. Использование подобного метода диагностики показана для растительного масла, полученного из ГМ-рапса.
• Методы спектроскопии. В ряде случаев генетические модификации могут приводить к изменению структуры растительных волокон при отсутствии видимых изменений
в белковом или жирно кислотном составе. Подобный тип изменений наблюдается, например, у трансгенной сои линии 40-3-2 (Roundup Ready Soy).
• Технология ДНК-чипов. ДНК- чипы – это наборы из большого числа олигонуклеотидов на миниатюрных твердых подложках, предназначенные для анализа последовательности ДНК. Метод основан на том, что с помощью фотолитографии на небольшой поверхности размещают огромное число олигонуклеотидов (одноцепочечные фрагменты ДНК). Их число, а следовательно, и количество различных нуклеотидных последовательностей может превышать 1 млн. на 1 см2, их длина варьирует от 9-10 до 1000нуклеотидов. После проведения ПЦР, полученные продукты реакции могут быть автоматически проанализированы методом гибридизации с меченными олигонуклеотидами на ДНК-чипах, что значительно ускоряет процесс идентификации трансгенной ДНК.
2. Экономика ГМО
2.1 Состояние и перспективны развития рынка генетически модифицированных товаров в мире
Генетическая инженерия имеет яркую историю благодаря тому общественному резонансу, который она вызвала с самых первых шагов. Начало этим событиям положило послание участников Гордоновской конференции (1973 г.) президиуму академии наук США, в котором говорилось о возможной опасности технологий рекомбинантных ДНК для здоровья человека. Возможные блага генетической инженерии признавались с самого начала, но разногласия по данной проблеме не затихли и сейчас.
Несмотря на отчаянную оппозицию по отношению к трансгенным организмам, новые сорта продуктов быстро завоевывают популярность в среде производителей. В период с 1996 по 2007 гг. площади, засеянные трансгенными сортами продовольственных культур увеличились в 70 раз (до 114.3 млн. га).
В первые устойчивый перенос чужеродного гена был продемонстрирован на растениях табака в 1983 г. Это было первое генетически модифицированное растение. Первые полевые опыты были проведены в США и Франции в 1987 г. В 1994 году в США было получено первое разрешение на коммерческое производство трансгенного сорта томатов.
В дальнейшем наблюдается интенсивное внедрение генетически модифицированных растений в практику сельскохозяйственного производства (табл.1).
| Год | Объем площадей | Процент приращения к предыдущему году (%) |
| 1997 | 11 | - |
| 1998 | 27.8 | 60 |
| 1999 | 39.9 | 43.5 |
| 2000 | 44.2 | 12 |
| 2001 | 52.6 | 20 |
| 2002 | 58.7 | 12 |
| 2003 | 67.7 | 12 |
| 2004 | 81.0 | 20 |
| 2005 | 90.0 | 11 |
| 2006 | 102.1 | 13 |
Следует отметить, что если с 1996 по 1999 гг. прирост посевных площадей под трансгенным культурам составлял ежегодно более 40%, то после 2000 г. он не превышал 20%.
В 2000 году рынок генетически модифицированных продуктов составлял 3.0 млрд. долл. США, в 2001 г. – 3.8 млрд. долларов. В 2002 он увеличился до 4.25 млрд. долларов, а в 2005г. – 5.25 млрд. долларов.
В 2007 г., число стран, выращивающих генетически модифицированные культуры, увеличилось до 23. Более 90 % всех посевных площадей под трансгенные культуры приходится на пяти странах: США, Аргентина, Канада, Бразилия, Китай (табл. 2)
Площади возделывания трансгенных культур в странах лидерах производство ГМО (млн. га).
| Страна | 2001г. | 2002г. | 2003г. | 2004г. | 2005г. | 2006г. | 2007г. |
| США | 35.7 | 39.0 | 42.8 | 47.6 | 49.8 | 54.6 | 57.7 |
| Аргентина | 10.0 | 13.5 | 13.9 | 16.2 | 17.1 | 18.0 | 19.1 |
| Канада | 3.2 | 3.5 | 4.4 | 5.4 | 5.8 | 6.1 | 7.0 |
| Бразилия | 1.6 | 2.0 | 3.0 | 5.0 | 9.4 | 11.5 | 15.0 |
| Китай | 1.5 | 2.1 | 2.8 | 3.7 | 3.3 | 3.5 | 3.8 |
Основными видами трансгенных культур, возделываемых в промышленных объемах, являются соя, кукуруза, хлопчатник, рапс, а также папайя и тыквенные культуры (таблица 3).
С 1996 г. по 2006г. в ЕС для употребления в пищу человеку одобрены 20 линий ГМ – культур: 1 линия сои «Монсанто»; 7 линий рапса «Байер кропсайнес», «Монсанто», 10 линий кукурузы «Байер Кропсайнес», «Монсанто», «Сингента», «Дюпон»; 2 линии хлопчатника «Монсанто», и 1 микроорганизм от компании F. Hoffman La Roche. На корм скоту в ЕС разрешено использовать 11 линий ГМ – культур: 1 линию сои «Монсанто»; 3 линии рапса «Байер Кропсайнес», «Монсанто»; 7 линий кукурузы «Байер Кропсайнес», «Монсанто», «Сингента», «Дюпон», «Доу Агросайенсис».
С 1994 г. по 2006г. в США для употребления в пищу человеку одобрены 114 линий ГМ – культур [4].
Площади возделывания трансгенных культур в мире (млн. га)
| Культура | 2003г | 2004г | 2005г | 2006г |
| Соя | 41.4 | 48.4 | 54.5 | 58.6 |
| Кукуруза | 15.5 | 19.3 | 24.0 | 25.2 |
| Хлопчатник | 7.2 | 9.0 | 11.0 | 13.4 |
| Рапс | 3.6 | 4.3 | 5.0 | 4.8 |
| Кабачки | < 0.1 | < 0.1 | - | - |
| Папайя | <0.1 | <0.1 | - | - |
| Картофель | - | - | - |
В Китае доминантной трансгенной культурой является хлопчатник; в Канаде – рапс. Сегодня доминирующими производителями трансгенного фуражного и продовольственного зерна являются только США и Аргентина.
По данным на 2007 год все возделыванные трансгенные культуры можно разделить по видам генетических модификаций:
- Устойчивость к гербицидам(69%);
- Устойчивость к насекомым(19%);
-Устойчивость к гербицидам и насекомым(12%);
-Устойчивость к вирусам и др.(<1%);
Самым важным аспектом рынка продуктов трансгенного растениеводства является негативное отношение общественности к генетически модифицированным продуктам. В настоящее время произошло разделение рынка продовольственного сырья на генетически модифицированные культуры и «обычные» генетически не модифицированные. Инициатором разделения явились японские импортеры.
Другим серьезным вызовом трансгенным продуктам является рынок натуральных экологически безопасных продуктов питания или, как их принято называть в англоязычных странах, органическая пища (Organic food). В США рынок генетически модифицированных продуктов за последние 10 лет демонстрировал ежегодный прирост 20 – 25% [2].
Похожие работы
... десятки тысяч, а возможно, несколько сот тысяч высококвалифицированных специалистов заняты в исследовательских и промышленных секторах фарминдустрии, и именно в этих областях интерес к геномным и генно-инженерным исследованиям исключительно высок. В 90-е годы продукты биотехнологических исследований стали появляться на коммерческом рынке. Длительный инкубационный период в развитии биотехнологии ...
... . Генно-инженерные технологии позволяют легко увеличивать промышленное производство ферментов. Ферменты находят все более широкое применение как биокатализаторы в фармацевтическом производстве. Биокаталитические технологии. Направленная модификация с помощью методов генной инженерии открывает возможности трансформации структуры ферментов таким образом, что они приобретают качественно новые ...
... с помощью биотехнологических процессов, комбинаторной химии, и новые мишени, которые идентифицируются в процессе изучения геномов. Это дает возможность отбирать молекулы, обладающие новыми биологическими и физиологическими свойствами, которые и будут выполнять роль лекарств. Прежде всего, обратимся к медицинской ветви биотехнологии. Рассматривая различные классы соединений, используемые в ...
... 10% всех структурных генов человека Быстро набирающие темпы исследования по генной вакцинации Набирающая темпы и расширяющаяся по номенклатуре генная терапия человека с массовой развивающейся базой и подготовкой новых возможностей Создание и разработка различных технологий уничтожения любых заданных клеток на животных моделях. Разработка технологий получения искусственных биологических ...
0 комментариев