Навигация
2.3 Ва́куум
Вакум — среда, содержащая газ при давлениях значительно ниже атмосферного. Вакуум характеризуется соотношением между длиной свободного пробега молекул газа λ и характерным размером процесса d. Под d может приниматься расстояние между стенками вакуумной камеры, диаметр вакуумного трубопровода и т. д. В зависимости от величины соотношения λ/d различают низкий (λ/d 1), средний (λ/d~1) и высокий (λ/d 1) вакуум.
Также вакуумом называют состояние газа, для которого средняя длина пробега его молекул сравнима с размерами сосуда или больше этих размеров.
2.4 Платиновая нить
Платиновая нить - толщина 0,07 – 0,1 мм является чувствительным элементом датчика, через нее пропускается электрический ток таким образом, чтобы она нагревалась до 150 градусов. Чем больше воздуха проходит через поперечное сечение трубопровода, тем сильнее охлаждается нить. На поддержание температуры требуется увеличение тока. Электронная схема преобразует этот прирост тока в полезный сигнал ДМРВ. Чем холодней воздух, тем сильнее охлаждается платиновая нить. Платиновая нить боится грязи. Поэтому воздухофильтр должен быть чистым и изготовлен из качественной фильтровальной бумаги. Схема датчика обеспечивает кратковременный нагрев нити для выгорания загрязнений - "режим прожига".
2.5 Серебро
Серебро Ag, (лат. Argrentum), химический элемент I группы периодической системы Д.И. Менделеева, атомный номер 47, атомная масса 107,8682. Серебро - металл белого цвета, ковкий, пластичный, хорошо полируется. Плотность 10,5 г/см3 (относится к тяжелым металлам), tпл=960,5 oС, tкип=2212 oС. Природное серебро состоит из двух стабильных изотопов 107Ag (51,35%) и 109Ag (48,65%), известны также 14 радиоактивных изотопов серебра и несколько изомеров.
2.6 Си́ла Кориоли́са
Си́ла Кориоли́са — одна из сил инерции, существующая в неинерциальной системе отсчёта из-за вращения и законов инерции, проявляющаяся при движении в направлении под углом к оси вращения.
Сила Кориолиса равна:
![]() (2.3)
(2.3)
где m — точечная масса, ω — вектор угловой скорости вращающейся системы отсчёта, ύ — вектор скорости движения точечной массы в этой системе отсчёта, квадратными скобками обозначена операция векторного произведения.
Величина называется кориолисовым ускорением.
2.7 Радиальные щели
Радиальные щели, образованные цилиндрическими соосными поверхностями, называют цилиндрическими концентричными щелями, а с не-соосными поверхностями - цилиндрическими эксцентричными щелями. Радиальные щели, образованные поверхностями с небольшой конусностью, называют конусными, а если оси поверхностей непараллельны, то - щелями с перекосом осей. Конусные щели в зависимости от того, сужается или расширяется зазор в направлении утечки, называют конфузорными или диффу-зорными. Радиальные щели наиболее часто используют в качестве передних и задних уплотнений закрытых рабочих колес роторных гидравлических машин. В целях повышения гидравлического сопротивления применяют многощелевые уплотнения. Радиальные щели широко используют также в качестве межступен-ных уплотнений, в устройствах, понижающих давление перед основным уплотнением вала, и в устройствах защиты основного уплотнения от абразивного изнашивания при герметизации жидкостей с твердыми включениями.
Радиальные и торцовые щели применяют в гидравлических и газовых затворах, в разгрузочных и уравновешивающих гидравлических устройствах, опорах скольжения, гидростатических уплотнениях и подшипниках.
2.8 Азот
Азо́т — элемент главной подгруппы пятой группы второго периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 7. Обозначается символом N (лат. Nitrogenium). Простое вещество азот (CAS-номер: 7727-37-9) — достаточно инертный при нормальных условиях двухатомный газ без цвета, вкуса и запаха (формула N2), из которого на три четверти состоит земная атмосфера.
2.9 Максвелловское распределение молекул по скоростям
Для газа, находящегося в замкнутом сосуде, результатом многочисленных столкновений молекул между собой и со стенками сосуда, является достаточно быстрое установление универсального распределения молекул по скоростям, которое было теоретически получено Максвеллом в 1860. На уровне макроскопического описания газа максвелловскому распределению молекул по скоростям соответствует состояние теплового равновесия в газе: давление и температура во всех местах внутри сосуда оказываются одинаковыми.
Молекулы газа даже в равновесии движутся беспорядочно, сталкиваясь между собой и со стенкой сосуда, беспрерывно меняя свою скорость. Это означает, что в каждый момент времени в газе есть молекулы, которые имеют самые различные скорости. Вместе с тем, поскольку давление и температура в газе остаются постоянными, то, как бы не менялась скорость молекул, среднее значение ее квадрата остается постоянным. Это оказывается возможным лишь при наличии неизменного во времени и одинакового во всех частях сосуда распределения молекул по скоростям.
Максвелловское распределение по скоростям можно вывести несколькими различными способами. Вид его может быть, в частности, установлен на основе простых соображений, основанных на применении так называемого принципа детального равновесия. Нужно однако предварительно отметить, что утверждение типа: "Такое-то число молекул в газе имеет скорость, например, 100 м/с" – не имеет конкретного смысла. Нельзя точно указать скорость какой-либо группы молекул, но можно говорить о среднем числе молекул, скорости которых находятся в некотором малом интервале скоростей dv между значениями v и v + dv. Число (доля) этих молекул – dn(v) = nf(v)dv, где n – число молекул в единице объема. Следует напомнить, что скорость v является вектором, поэтому функция распределения f(v), имеющая смысл функции вероятности, характеризует распределение молекул как по абсолютным значениям (модулям) скоростей, так и по их направлениям. В декартовой системе координат с осями x, y, z это соответствует представлению интервала скоростей в виде dv = dvx * dvy * dvz. Если интересоваться распределением только по модулям скорости, то в сферической системе координат
dn(v) = 4p nn2f(v)dv(2.4)
Для вывода максвелловского распределения рассматриваются две группы молекул, скорости которых лежат в интервалах dv и dvi.В результате столкновений молекул первой и второй групп скорости v и vi сталкивающихся молекул изменяются и переходят в v’ и vi соответственно. Среднее число таких столкновений, называемых прямыми столкновениями, будет пропорционально dndn1 или
![]()
Соответствующие им обратные столкновения переводят молекулы из интервалов dv’ и dvi в dv и dv1 . Среднее число обратных столкновений пропорционально
![]() (2.5)
(2.5)
Принцип детального равновесия состоит в том, что в состоянии хаотического движения, соответствующего тепловому равновесию, скорости прямого и обратного процессов должны быть одинаковы. В данном случае это соответствует выполнению условия
![]() (2.6)
(2.6)
Можно показать, что произведения элементов объема в пространстве скоростей для прямых и обратных столкновений равны. Поэтому написанное выше условие переходит в соотношение
![]() (2.7)
(2.7)
Логарифмирование этого соотношения дает
![]() (2.8)
(2.8)
Полученное равенство означает, что натуральные логарифмы функции распределения являются так называемыми аддитивными инвариантами. Они могут быть выражены через линейную комбинацию величин, которые сохраняются в парных столкновениях частиц, а именно массы, импульса и кинетической энергии частиц.
![]() (2.9)
(2.9)
Константы a, и c можно определить через известные макроскопические параметры газа – плотность n, скорость v0 и температуру T. Тогда в покоящемся газе (v0 = 0) максвелловское распределение по скоростям, следующее из (2.9), имеет вид
![]() (2.10)
(2.10)
Используя этот результат, с помощью выражения (2.4) можно определить относительную долю молекул, абсолютные скорости которых лежат в некотором узком интервале значений dv,
![]() (2.11)
(2.11)
Вид распределения dn/ndv, описываемого выражением (2.11), для двух различных температур (T2 > T1) представлен на рис. 9.
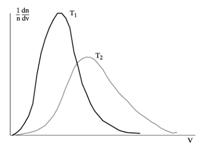
Рисунок 9
Площади под каждой кривой оказываются, очевидно, одинаковыми, что следует из нормировки на заданную плотность частиц n. Из представленного графика видно, что большинство частиц имеет скорости, близкие к некоторому среднему значению, и лишь малое их число обладает весьма высокими или низкими скоростями. С помощью распределения (2.11) могут быть рассчитаны такие характеристики как средняя, среднеквадратичная и наиболее вероятная скорость теплового движения молекул, число столкновений молекул со стенкой и другие важные параметры газа.
0 комментариев