Навигация
Применение комплексов полимер – металл в катализе
1.4 Применение комплексов полимер – металл в катализе
Одним из интенсивно развивающихся направлений химии является катализ полимерами, возникший на стыке химии высокомолекулярных соединений, координационной химии и каталитической химии. С помощью синтетических макромолекул можно конструировать полимерные катализаторы, работающие по принципу ферментов, многие из которых представляют собой ионополимеры с встроенными ионами металлов. Благодаря точности сборки такие полимер-металлические комплексы проявляют высокую каталитическую активность, стабильность и избирательность действия. В решении важных проблем химической и нефтехимической отрасли большая роль будет принадлежать каталитически активным металлокомплексам, закрепленным на полимерные носители. Они представляют собой гетерогенные катализаторы с активной фазой – гомогенным комплексом, который может быть закреплен на полимерной подложке различными способами – инкапсуляцией, ковалентным присоединением, координационными связями, гельиммобилизацией и т.д. Эти катализаторы сочетают преимущества как гомогенных (высокая активность и селективность), так и гетерогенных катализаторов (простота отделения катализатора от продуктов реакции).
Полимеры, содержащие функциональные группы, являются подходящими носителями ионов металлов. При взаимодействии их с ионами металлов образуются новые типы координационных соединений, в которых лигандами являются макромолекулы.
Интерес к координационным соединениям ионов различных металлов с макромолекулярными лигандами обусловлен тем, что ионы железа, меди, кобальта, цинка играют важную роль в ферментативных реакциях.
Каталитическое действие комплексов водорастворимых полимеров с ионами переходных металлов рассмотрено на примере реакций разложения пероксида водорода, окисления, гидрирования и др. Такие комплексы часто проявляют более высокую активность, чем соответствующие низкомолекулярные аналоги.[6,11,14].
2.Методическая часть
2.1 Характеристика исходных веществ
При выполнении работы были использованы следующие реактивы:
Полиамфолит ПКЭАК бетаиновой структуры (синтезирован в институте полимерных материалов и технологий г. Алматы)

CoCl2, NiCl2, Cd (CH3COO)2, Sr (NO3)2, CaCl2, ZnSO4, Pb (NO3)2, CuCl2.
NaOH (фиксанал), HCl – 37% , г/см3, Буферные растворы приготовленные из стандарт-титров с pH = 1,65; 6,86; 9,18.
Использованные приборы:
рН растворов измеряли на иономере универсальном ЭВ-74 со стеклянным и хлорсеребряным электродом.
Для работы были использованы:
1. Аналитические весы.
2. Технические весы.
3. Калька.
4. Фильтровальная бумага.
5. Мерные колбы на 25мл, 50мл, 100мл, 1000мл.
6. Пипетки на 1мл, 2мл, 5 мл, 10мл.
7. Колбы для титрования.
8. Бюретка.
9. Стаканчики на 25мл, 50мл.
10. Секундомер.
11. Груша.
12. Мерные цилиндры на 25мл.
13. Воронки.
2.2 Методика исследования
рН-метрическое титрование проводили при помощи иономера ЭВ-74 (точностью измерения + 0,05 ед рН) со стеклянными и хлорсеребряными электродами. Градуировку электродной системы осуществляли по стандартным буферным растворам с рН = 1,65; 6,86; 9,18.
В стакан для титрования наливают 10 мл 0,001 М раствора полимера. Титрование ведут 0,01 М раствором соли металла при постоянном перемешивании из микробюретки. Измерение рН производят через каждые 0,05 мл добавленной соли металла до постоянного значения pH. Результаты отображают в виде графика, где на оси абсцисс – объем прилитой соли металла, на оси ординат – соответствующее значение pH.
Таблицы и графики представлены в приложении.
3.Экспериментальная часть
3.1Результаты и обсуждение
Цель работы:
1. Исследование комплексообразования ПКЭАК с ионами двухвалентных металлов: Ca, Sr, Ni, Co, Cd, Pb, Zn, Cu.
Полимер бетаиновой структуры синтезирован в институте полимерных материалов и технологий г. Алматы содержит в полимерной цепи карбоксильные группы и аминогруппы, что позволяет рассматривать его как новый полиамфолит. Определение комплексообразования ПКЭАК с ионами двухвалентных металлов провели потенциометрическим методом.
Как видно из рис. 1 – 8 при титровании идет постепенное снижение pH раствора, что свидетельствует о взаимодействии ПКЭАК с ионами металлов, при котором в раствор постепенно выделяются ионы водорода. На рис. 4 представлена кривая титрования ПКЭАК раствором Cd(CH3COO)2. Из рисунка видно, что при титровании полимера кривая постепенно идет вниз, затем, достигнув точки эквивалентности, идет вверх. Предположительно увеличение pH, после точки эквивалентности, связано с гидролизом соли, образованной слабым основанием и слабой кислотой.
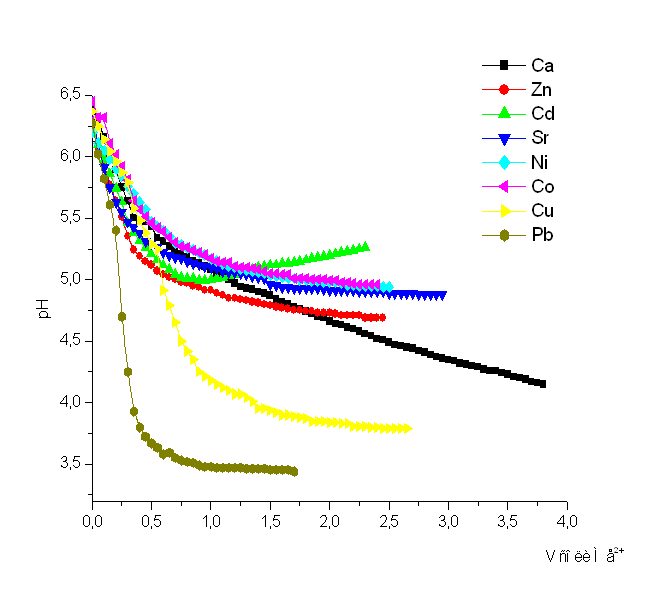
Как видно из сводного графика, рис. 9, наибольшей склонностью к комплексообразованию с ПКЭАК обладает ион Pb2+. Таким образом, кривые потенциометрического титрования свидетельствуют об образовании полимер – металлических комплексов (ПМК).
Заключение
В результате проведенных исследований получены следующие результаты:
1. Методом потенциометрического титрования исследовано взаимодействие полимера с ионами металлов Co2+ и Ni2+, Pb2+, Ca2+, Zn2+, Sr2+, Cd2+, Cu2+. Полученные данные свидетельствуют о возможности использования полибетаинов: в процессах очистки питьевой воды, для извлечения ионов металлов из промышленных сточных вод, извлечения ионов металлов из загрязненных почв и т.д.
Список использованных источников
1. Френкель С. Я. Полимеры, проблемы, перспективы, прогнозы. //В кн. Физика сегодня и завтра. Л. 1973. С. 179.
2. Волькенштейн М. В. Молекулярная биофизика. М. Наука. 1975. 616с.
3. Bekturov E. A., Bimendina L. A. //J. Macromol. Sci. Rev. Macromol. Chem.Phys. 1997.C37(3).P.501.
4. Зезин А.Б., Кабанов В. А. //Успехи химии. 1982. Т. 56. С. 1447.
5. Бектуров В.А., Бимендина Л.А. Интерполимерные комплексы. Алма-Ата. Наука 1977. 264с.
6. Бектуров Е.А., Бимендина Л А., Кудайбергенов С.Е. Полимерные комплексы и катализаторы. Алма-Ата. Наука. 1982. 192 с.
7. Бектуров Е. А., Кудайбергенов С. Е., Хамзамулина Р. Э. Катионные полимеры. Алма-Ата. Наука. 1986. 159с.
8. Бектуров Е.А., и др. Молекулярные комплексы полимеров. Алма-Ата. Наука. 1988. 174с.
9. Паписов И. М. //Высокомолек. ссоед. 1997. Т. Б39. С. 562.
10. Бимендина Л. А., Бектуров Е. А., Самоорганизация молекул в растворах и на границе раздела фаз. //В. Кн. «Неравновесность и неустойчивость в эволюции динамических структур в природе » Алматы. Ғылым. 1998. С. 157.
11. Бектуров Е. А., Кудайбергенов С. Е. Катализ полимерами. Алма-Ата. Наука. КазССР. 1988. 184с.
12. Кабанов Н. М. и др. //Высокомолек. соед. 1979. Т. А21. С.209.
13. Бектуров Е. А., Бимендина Л. А., Мамытбеков Г. К.//Комплексы водорастворимых полимеров и гидрогелей.
14. Бимендина Л.А., Яшкарова М.Г., Кудайбергенов С.Е., Бектуров Е.А. Полимерные комплексы (получение, свойства, применение): Монография / под редакцией Жубанова Б.А. – Семипалатинский государственный университет имени Шакарима – Семипалатинск, 2003. – 313 с.
Таблица 1
Результаты рН - метрического титрования 0,001 М р-ра ПКЭАК 0,01 н. р-ром Sr(NO3)2
| V Sr(NO3)2 | pH | V Sr(NO3)2 | pH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
Таблица 2
Результаты рН - метрического титрования 0,001 М р-ра ПКЭАК 0,01 н. р-ром Cd(CH3COO)2
| V Cd(CH3COO)2 | pH | V Cd(CH3COO)2 | pH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
Таблица 3
Результаты рН - метрического титрования 0,001 М р-ра ПКЭАК 0,01 н. р-ром ZnSO4
| V ZnSO4 | pH | V ZnSO4 | pH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
Таблица 4
Результаты рН - метрического титрования 0,001 М р-ра ПКЭАК 0,01 н. р-ром CaCl2
| V CaCl2 | pH | V CaCl2 | pH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
Таблица 5
Результаты рН - метрического титрования 0,001 М р-ра ПКЭАК 0,01 н. р-ром NiCl2
| V NiCl2 | pH | V NiCl2 | pH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
Таблица 6
Результаты рН - метрического титрования 0,001 М р-ра ПКЭАК 0,01 н. р-ром CoCl2
| V CoCl2 | pH | V CoCl2 | pH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
Таблица 7
Результаты рН - метрического титрования 0,001 М р-ра ПКЭАК 0,01 н. р-ром CuCl2
| V CuCl2 | pH | V CuCl2 | pH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
Таблица 8
Результаты рН - метрического титрования 0,001 М р-ра ПКЭАК 0,01 н. р-ром Pb(NO3)2
| Pb(NO3)2 | pH | Pb(NO3)2 | pH | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
Рисунок 1

Рисунок 2

Рисунок 3
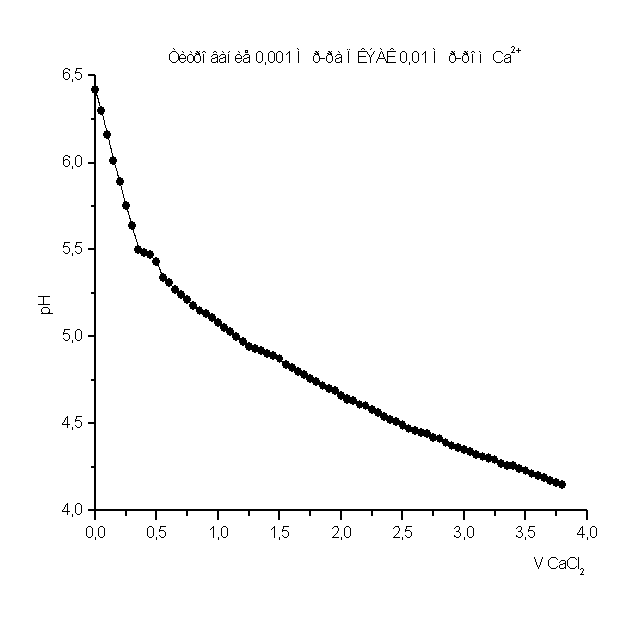
Рисунок 4

Рисунок 5
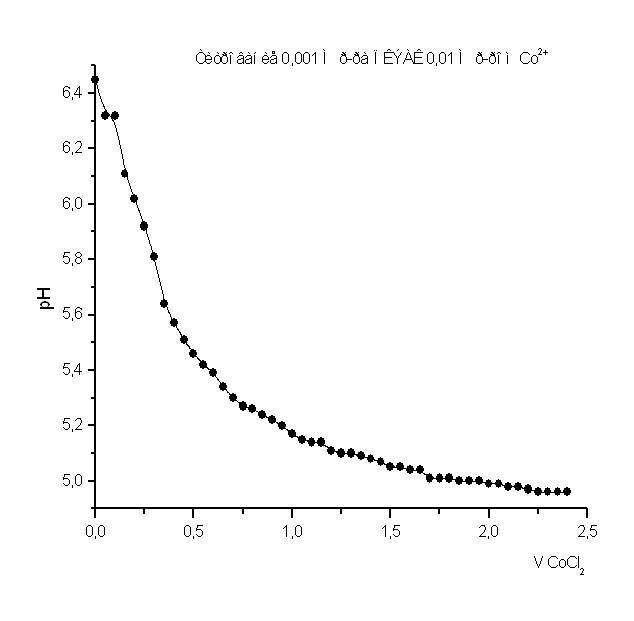
Рисунок 6

Рисунок 7

Рисунок 8

Рисунок 9
0 комментариев